不同呼气末正压与潮气量对离体损伤鼠肺泡稳定性的影响
刘 晖,刘 凯,招展奇
(1.同济大学附属同济医院普外科,上海 200065;2.上海市全康医疗中心口腔科,上海 200040;3.德国阿尔伯特·路德维希大学附属医院重症监护实验室,德国弗莱堡 79106)
机械通气是治疗呼吸衰竭的关键措施,应用不当可能会引起严重的并发症。如过多的能量传送至肺,可导致呼吸机性肺损伤(ventilator induced lung injury,VILI)。VILI与急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)患者死亡率高有密切的关系。VILI的主要发病机制之一是不张伤(atelectrauma),即由于肺泡复张/失复张时产生的应切力损伤肺泡上皮[1]。肺泡复张是指在正压通气过程中通过升高肺泡内压使原来塌陷的肺泡重新开放的过 程[2]。呼 气 末 正 压 (positive end-expiratory pressure,PEEP)的应用可防止肺泡失复张,即防止已开放的肺泡塌陷[3]。PEEP能维持肺容积,保持肺表面活性物质的功能,减少因肺泡或细支气管反复复张/失复张而产生的应切力。因此,PEEP能减少呼吸机性肺损伤的发生。
1990年之前,高潮气量(volume ventilation,VT)通气被广泛应用于ARDS的治疗,那时普遍的观点认为,机械通气的首要目标是使动脉血氧分压(PaO2)维持在正常水平。但是,采用高潮气量通气可能导致肺的具有氧合功能的正常区域发生过度膨胀。目前已知过量的呼气末肺容积是呼吸机性肺损伤的关键诱发因素[4-5]。1993年,美国胸内科医师全国会议建议对ARDS患者应采用低潮气量的机械通气[6]。1998年,Amato首先采用 VT <6 ml/kg的保护性机械通气模式治疗ARDS患者,相对于常规的通气策略,低潮气量的机械通气明显降低患者的死亡率(38%vs.71%)[7]。
以上结果源自间接测量所得,如压力-容积曲线,计算机断层扫描及电子束成像术等。2007年,Halter等[8]采用活体显微成像技术分析了不同的VT-PEEP组合对肺泡的影响。第一次观察到低VT-高PEEP对稳定肺泡具有协同作用。而且增加PEEP比减少VT更能有效地稳定肺泡。然而,他们忽略了肺泡显微镜物镜镜头与脏胸膜表面接触所产生的局部压力,这种压力可能对显微视野下脏胸膜肺泡有较大的影响,由此可能引发对实验结果的错误解释。
本研究开发了一种新的肺泡显微镜,它可以直接测量和控制显微视野下的局部压力,甚至能减少直至消除显微视野下的局部压力。本研究采用这个独特的肺泡显微镜检测离体无灌注损伤鼠肺及正常鼠肺的肺泡动力学,研究不同的PEEP-VT组合的机械通气模式对无灌注损伤鼠肺及正常鼠肺的肺泡动力学的影响。
1 材料与方法
1.1 肺泡显微技术
肺泡显微镜(图1)是物镜为视野10度、观察角度0度、直径2.3 mm的硬质透镜。外接冷光源,光线通过光导纤维传导。内窥镜置于双套管系统中(Schoelly fiberoptic GmbH公司,德国)。这套双套管系统由外径为6.5 mm的外套管和外径为3.3 mm的内套管组成。双套管系统的头部固定内窥镜,其末端平面正好位于内窥镜物镜的焦点上,焦点距物镜2 mm。应用肺泡显微镜时,物镜镜头和聚焦平面之间有一空间,该空间充满平衡盐溶液后,能在目镜上得到清晰的图像。平衡盐溶液从双套管系统的注水孔注入,将该空间内的残留空气排空,直至得到满意的显微图像为止。
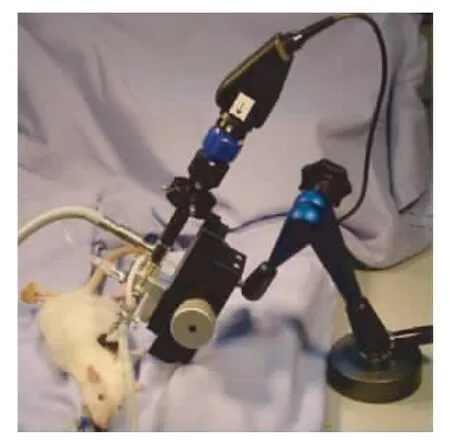
图1 肺泡显微镜Fig.1 Microscopic endoscope
数码相机的最大变焦距离f为50 mm。图像分辨率为 725×756像素,对应的脏胸膜面积为0.96 mm ×1.09 mm,数码相片采用 bitmap 文件格式保存(Ulead Video Studio 8,台湾ULEAD公司)。通过改变储水器中水平面与肺泡显微镜末端聚焦平面的相对位置,可以调节局部胸膜压。负压吸引的区域位于内外套管之间的环状管腔,它的作用是固定离体鼠肺和显微镜物镜之间的位置,保证显微视野在实验中不发生偏移。通过改变负压吸引器的控制阀可以控制负压吸引的大小。
1.2 离体无灌注肺的准备
12只280~350 g雌性Wistar大鼠被分为两组,损伤组8只,其他4只作为对照组。异氟烷气体吸入麻醉后,切开右颈动脉放血处死大鼠。开胸后,游离肺,仔细将肺与周围血管神经离断后移出体外。漏气肺被弃用。Tween-20能使肺泡表面活性物质失活,造成即刻肺损伤。5%Tween-20生理盐水溶液(4.5 ml/kg)被注入气管,气管插管与小动物呼吸机(Flexi Vent,加拿大SCIREQ公司)相连,采用PEEP 20 cmH2O-VT 6 ml/kg组合,机械通气10次,使离体肺膨胀,以提高肺泡表面物质失活剂Tween-20分布。随后,通过气管插管吸出残留的Tween-20生理盐水溶液。然后将肺悬挂固定于暗盒内(图2),暗盒与雾化器相连,雾化器产生雾化水蒸汽,防止离体肺干燥。

图2 离体肺在圆柱体暗盒内Fig.2 Schematic view of the exercised normal lung in chamber
正常对照组肺的处理方法同前,但不采用Tween-20生理盐水溶液灌注。Tween-20灌注引起了异质性损伤,肺表面不同区域损伤程度不同。在显微镜贴附于脏胸膜表面后,吸附孔与负压吸引器相连,采用-5 cmH2O吸附压以保证实验中被观察部位保持不变。随后,内套管和压力测量口注满了平衡液。吸附压测量孔和冲洗压测量孔与压力传感器(Medex MX960)连接。气道压力测定采用压电电阻压力传感器(德国SI-Special Instruments GmbH公司)。所有信号均经数字化处理(NI PCI-6289,美国National Instruments公司)。每次实验之前,所有传感器预先校准。
1.3 实验设计
研究采用三种不同水平的 PEEP:5、10、20 cmH2O(1 cmH2O=0.098 kPa),三种水平的 VT 分别为6、10、15 ml/kg,共有 9 组不同的 PEEP-VT 组合,实验过程中,吸附压保持-5 cmH2O不变,局部胸膜压固定于0 cmH2O。
取得离体肺后,肺泡显微镜放置于肺表面,数码摄像仪记录机械通气过程中每个PEEP-VT组合肺泡变化的情况。每次实验时,先固定VT,由高向低逐步降低 PEEP水平,即从20 cmH2O降至5 cmH2O。当完成PEEP为5 cmH2O水平的机械通气后,由低至高逐步调高潮气量,即从6 ml/kg至15 ml/kg,在每个不同的VT水平,如前所述由高向低逐步降低PEEP水平。为了规范标准通气量,每次更改潮气量设置前,预先采用PEEP 20 cmH2OVT 6 ml/kg组合进行机械通气,使塌陷的离体肺重新复张。每种PEEP-VT组合机械通气开始3 min后记录肺泡的视频影像。
1.4 呼吸机设置
机械通气采用容量控制模式,呼吸频率20次/min,吸气时间 1.2 s,呼气时间 1.8 s,吸气时间∶呼气时间 =1∶1.5。
1.5 图像分析
摄像仪连续记录5个通气周期。应用Virtual-Dub 软件(VitualDub 1.7.6,Avery Lee),从这些影像学资料中截取吸气末和呼气末的静止图像,分析可辨认肺泡结构的数量及大小。通过计算机辅助分析系统勾勒出肺泡的境界,然后采用Metlab R2006a计算其面积。为排除由于聚焦平面的变化对肺泡数量及大小的影响,实验中始终保持聚焦点的一致,避免重新聚焦。肺泡稳定性的评价采用(吸气末肺泡面积-呼气末肺泡面积)/吸气末肺泡面积 ×100%[9],用 I-E%表示。
本研究中所有实验均严格遵守德国国立卫生研究院有关实验动物使用的准则。议定书由德国Albert-Ludwigs大学附属医院人道使用动物委员会核准。
1.6 统计学处理
应用SPSS 12.0软件包进行单因变量方差分析。所有实验数据采用x±s表示,一旦F值有显著性差异,采用LSD法确定组间差异,P<0.05为差异有统计学意义。
2 结 果
2.1 对照组
当PEEP为5 cmH2O时,无论VT大小,在潮气通气过程中,肺泡的大小、形态无显著改变,各组之间差异无统计学意义(P>0.05)。当VT为6 ml/kg时,I-E%为0.6% ±6.4%;当 VT 为10 ml/kg 时,IE%为0.3% ±7.2%;VT 为 15 ml/kg时,I-E%为-6.3% ±13.3%。随VT的升高,正常离体肺肺泡吸气和呼气末的影像见图3。表明正常肺泡的动力学很稳定,无论机械通气采用何种PEEP-VT组合,I-E%变化很小,各组之间差异无统计学意义(P>0.05),见表1。
2.2 损伤组
Tween-20灌注后,当 PEEP为 5cmH2O或10 cmH2O时,无论机械通气采用的潮气量大小,肺泡均不稳定,与通气参数设置相同的正常肺比较差异有统计学意义(P<0.05)。并且当 PEEP为5 cmH2O时,无论机械通气采用的潮气量大小,肺泡的稳定性最小(I-E%为100%)。只有当PEEP为20 cmH2O时,损伤肺肺泡稳定,不论VT的设置,与正常肺相同的设置比较差异无统计学意义(P>0.05),肺泡都很稳定,I-E%为 0.2% ±9.3%。当VT 6 ml/kg时,随PEEP的降低,损伤肺吸气和呼气末的影像见图4。
显微视野下,正常肺肺泡数目在机械通气过程中没有显著变化(P>0.05)。由于损伤肺在机械通气过程中,显微视野下有一部分肺泡轮廓模糊,因此本研究没有计算损伤肺显微视野下肺泡的数目。当PEEP为20 cmH2O时,损伤肺肺泡数目在机械通气过程中几乎没有变化,而 PEEP为5或10 cmH2O时,肺泡数目在机械通气过程中变化很大,尤其当PEEP为5 cmH2O时,呼气末胸膜肺泡完全塌陷。

图3 正常离体肺吸气和呼气末的显微图像Fig.3 Photomicrographs of the same microscopic field at peak inspiration and end-expiration in normal Lung
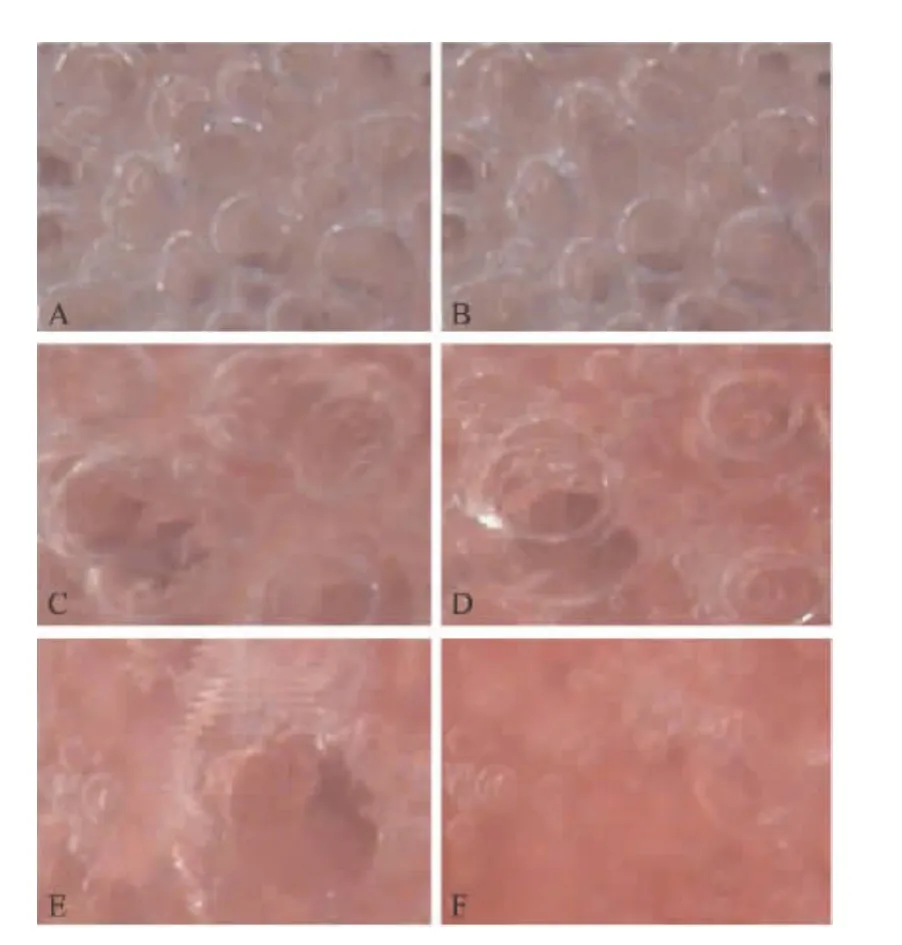
图4 损伤肺吸气末与呼气末肺泡显微照片Fig.4 Photomicrographs of the same microscopic field at the end of expiration and end of inspiration in injured lung
表1 正常肺及损伤肺的肺泡稳定性Tab.1 The quantity of the alveolar stability ofnormal lung and injured lung (±s,%)
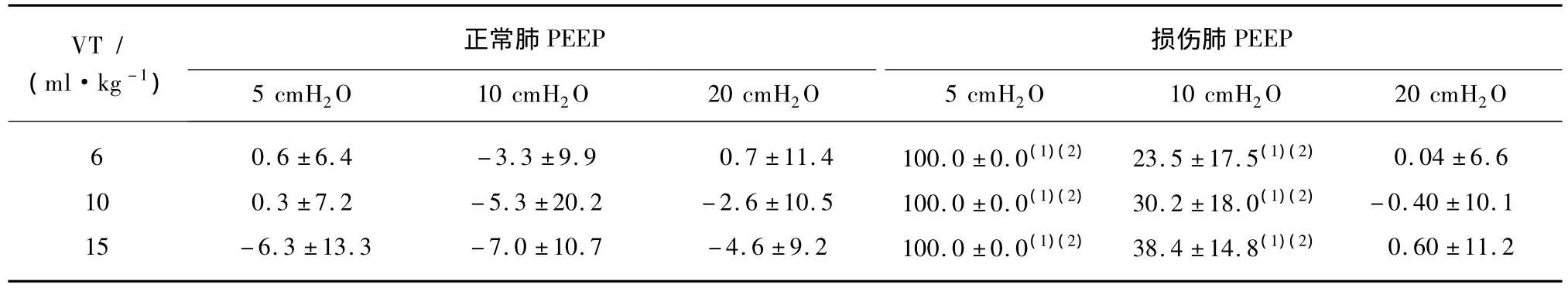
表1 正常肺及损伤肺的肺泡稳定性Tab.1 The quantity of the alveolar stability ofnormal lung and injured lung (±s,%)
与正常肺相比,(1)P<0.01;与相同设置的损伤肺PEEP为20 cmH2O时相比,(2)P<0.01
VT/(ml·kg -1)PEEP 5 cmH2正常肺PEEP损伤肺O 10 cmH2O 20 cmH2O 5 cmH2O 10 cmH2O 20 cmH2O 0.6 ±6.4 -3.3 ±9.9 0.7 ±11.4 100.0 ±0.0(1)(2) 23.5 ±17.5(1)(2) 0.04 ±6.6 10 0.3 ±7.2 -5.3 ±20.2 -2.6 ±10.5 100.0 ±0.0(1)(2) 30.2 ±18.0(1)(2) -0.40 ±10.1 15 -6.3 ±13.3 -7.0 ±10.7 -4.6 ±9.2 100.0 ±0.0(1)(2) 38.4 ±14.8(1)(2) 0.60 ±11.2 6
3 讨 论
比较机械通气时采用不同的PEEP-VT组合对正常肺及损伤肺的影响,结果显示二者的肺泡动力学差异很大。正常肺肺泡动力学稳定,不同的PEEP-VT组合之间,肺泡动力学差异无统计学意义(P>0.05)。通过肺泡显微镜直接观察机械通气过程中正常肺的肺泡,未发现肺泡的大小和形态有显著变化,这和众多研究[10-11]的结果是一致的。机械通气过程中肺泡的大小无显著变化的原因可能如下。(1)连续的肺泡复张/失复张:在机械通气过程中,肺泡数目发生显著变化,即吸气末肺泡数目增多,呼气末肺泡数目减少,但复张肺泡的大小不变;(2)肺泡发生皱褶和去皱褶改变;(3)机械通气过程中,肺泡管随呼吸周期膨胀和收缩,肺泡开口和肺泡管的大小发生改变,但肺泡本身大小不变[12-13]。
在本实验中没有观察到机械通气过程中正常肺胸膜下肺泡大小和数目发生显著变化。因此,本研究不能肯定在机械通气过程中正常肺肺泡发生复张/失复张。
本实验特别注意保证肺泡显微镜和肺的相对位置固定不变,跟踪研究同一显微视野下肺泡在不同实验条件下的动态变化。当肺扩张压降至临界值时,首先出现肺泡的融合,随后,随着扩张压的下降,合并的肺泡结构塌陷。发生肺泡融合时,单个肺泡样结构的大小明显增大。在同一实验组或不同实验组间,观察到塌陷的肺泡复张时不是以简单的爆发式的方式突然出现,而趋于从融合的肺泡结构中以“出芽”的方式出现。Direceo等[10]在研究损伤猪肺的肺泡动力学时也注意到了类似的现象。他认为是塌陷的肺泡以肺泡管为中心,围绕肺泡管形成团簇状结构。虽然依据二维图像很难从形态学上辨别单个肺泡或肺泡管,本研究的观察结果依然支持如下假设:融合肺泡可能塌陷形成细支气管。脏胸膜出现融合的肺泡状结构的大小不能反映单个肺泡的实际大小。为避免对实验结果严重影响,在对显微图像进行数据分析时,本研究排除了融合的肺泡状结构。
本研究认为,对于损伤肺,PEEP是独立于VT的肺泡稳定的关键因素。肺泡稳定与高PEEP相关。当VT为6 ml/kg,肺泡的稳定性随着PEEP从5 mmHg到20 mmHg的升高而逐渐升高,而当PEEP分别为5、10 mmHg时,减小VT肺泡的稳定性并没有发生变化。这可能意味着升高PEEP所带来的好处比减小VT所带来的好处大。
Hickling等[14]发现采用低 VT机械通气的益处,第一次证实在机械通气中通过减小VT来降低吸气峰压,能显著降低ARDS患者的死亡率(16%vs39.6%)[14]。Amato 等[7]研究高 PEEP-低 VT(6 ml/kg)和低PEEP-高VT(12 ml/kg)两种不同的机械通气设置对ARDS患者的治疗效果,结果发现,不同的PEEP-VT组合之间ARDS患者死亡率差异有统计学意义。采用高PEEP-低VT(6 ml/kg)组,患者第28天死亡率为38%,而另一组(VT 12 ml/kg)的死亡率为71%。2000年,美国国立卫生中心(NIH)进行了历史上最大规模的临床研究,通过多中心协作,他们分析了861例ARDS患者采用6 ml/kg和12 ml/kg两种不同潮气量对死亡率的影响,结果显示,采用VT 6 ml/kg组的死亡率较另一组下降了9%[15],这为在临床中采用低潮气量机械通气模式提供了强有力的依据。
本实验采用高PEEP,不同的VT设置对肺泡动力学改变差异无统计学意义。但高VT使肺泡过度扩张,升高吸气末峰压,这将导致机械牵拉力增高,导致呼吸机性肺损伤。而低VT能降低平台压,减少肺泡周期性的膨胀/塌陷,减少呼吸机性肺损伤的发生。
本研究表明对于损伤肺,采用20 cmH2O PEEP与6 ml/kg VT组合时,肺泡稳定性最高,20 cmH2O PEEP与不同的VT组合之间无显著性差异。当PEEP为5 cmH2O时,不论潮气量的大小,肺泡均不稳定,与Halter等[8]的研究结果一致。有趣的是,这两种实验条件有很大的差异。(1)采用的动物模型不同。本实验采用的是离体无灌注鼠肺,而Halter采用的是活体猪;(2)研究部位不同。本实验选择损伤程度相近的部位,而他们的研究部位是固定的,位于右胸第二肋间隙;(3)本实验肺泡显微镜能控制显微视野下的局部胸膜压,消除局部胸膜压对实验结果的影响,而在他们的实验中不能消除肺泡显微镜物镜和脏胸膜接触所产生的局部压力。
本研究中有关肺泡稳定性结果的标准误很高,原因可能如下。(1)尽管本研究尽量选取损伤程度相近的观察的部位,但这些部位的选择仅依赖肉眼判断;(2)由Tween-20引发的肺损伤为非同质性;(3)相同显微视野下,不同的肺泡的肺泡动力学也不尽相同,通过对正常肺和损伤肺的影像观察发现,即使是高PEEP-低VT组合,在吸气末,有些肺泡的面积轻微增大,而有些肺泡的面积会略减小;(4)使肺和肺泡显微镜保持固定的负压可能会对肺泡稳定性产生影响,尽管在实验中应用的负压为-5 cmH2O,这是目前已知能保持视野固定的最小负压,可以想象,呈圆环状分布的吸附固定负压,可能增加被吸附固定在显微视野下的脏胸膜的跨肺压;(5)在进行面积测量时,选取图像清晰、边界清楚的肺泡,因此,肺泡的选取具有非随机性。尽管标准误很大,但我们不但从统计学,而且通过肺泡显微镜直观地证明了从正常肺到损伤肺肺泡稳定性剧烈的变化。
在本实验中采用的动物模型为离体无灌注鼠肺。采用这种动物模型原因,其一是因为使选择损伤程度相近的部位作为肺泡显微镜的研究部位成为可能;其二,在实验中可以选择高 PEEP-高 VT组合,不存在活体实验时血流动力学受影响的问题。本研究有以下不足:肺泡显微只能研究临近脏胸膜的肺泡,即胸膜下肺泡。胸膜下肺泡的结构与肺实质内部肺泡有所不同。内部肺泡的四周被相邻肺泡所包绕,而胸膜下肺泡的其中一部分与脏胸膜相邻。因此,胸膜下肺泡的这种结构可能会减少肺泡的支持力,导致胸膜下肺泡较肺实质内肺泡更易于塌陷[16]。肺泡显微镜技术不能分析肺泡的三维结构,只能在聚焦平面上测量肺泡的二维面积。尽管在实验过程中避免重聚焦,但当脏胸膜肺泡塌陷后,深部肺泡结构会突向脏胸膜,进入聚焦平面,使肺和肺泡显微镜保持固定的负压可能会对肺泡稳定性产生影响。但众多研究表明,吸附压对肺泡的影响很小,可以忽略不计[17-18]。本研究采用的动物模型为离体无灌注鼠肺而不是活体动物。采用Tween-20灌注使肺泡表面活性物质失活引起快速肺损伤制作损伤肺的模型,尽管Dirocco等[10]的研究显示Tween-20灌注肺损伤和呼吸机性肺损伤的始动因素是一样的,即首先使使肺泡表面活性物质失活[10],但它是否能真实模拟呼吸机性肺损伤尚未确定。
本研究采用新的肺泡显微镜研究机械通气过程中离体非灌注大鼠肺的肺泡肺泡动力学。正常肺泡稳定性是独立于PEEP-VT设置。在损伤肺中,机械通气采用PEEP 20 cmH2O,肺泡稳定,而PEEP降低,无论采用的VT大小,肺泡均不稳定。
[1] Tschumperlin DJ,Oswari J,Margulies AS.Deformation-induced injury of alveolar epithelial cells.Effect of frequency,duration,and amplitude[J].Am J Respir Crit Care Med,2000,162:357-362.
[2] Hubmayr RD.Perspective on lung injury and recruitment.A skeptical look at the opening and collapse story[J].Am J Respir Crit Care Med,2002,165:1647-1653.
[3] Lachmann B.Open the lung and keep the lung open[J].Intensive Care Med,1992,18:319-321.
[4] Ricard JD,Dreyfuss D,Saumon G.Ventilator-induced lung injury[J].Eur Respir J Suppl,2003,42:2-9.
[5] Zilberberg MD,Epstein SK.Acute lung injury in the medical ICU:comorbid conditions,age,etiology,and hospital outcome[J].Am J Respir Crit Care Med,1998,157:1159-1164.
[6] Slutsky AS.Mechanical ventilation:American College of Chest Physicians'Consensus Conference[J].Chest,1993,104:1833-1859.
[7] Amato MB,Barbas CS,Medeiros DM,et al.Effect of a protective-ventilation strategy on mortality in the acute respiratory distress syndrome[J].N Engl J Med,1998,338:347-354.
[8] Halter JM,Steinberg JM,Gatto LA,et al.Effect of positive end-expiratory pressure and tidal volume on lung injury induced by alveolar instability[J].Crit Care,2007,11:20-32.
[9] Stahl C,Schumann S,Knorpp H,et al.Intravital endoscopy of alveoli:a new method to visualize the mechanical alveolar dynamics[J].J Biomech,2006,39(Suppl 1):598.
[10] DiRocco JD,Pavone LA,Carney DE,et al.Dynamic alveolar mechanics in four models of lung injury[J].Intensive Care Med,2006,32:140-148.
[11] Steinberg J,Schiller HJ,Halter JM,et al.Tidal volume increases do not affect alveolar mechanics in normal lung but cause alveolar overdistension and exacerbate alveolar instability after surfactant deactivation[J].Crit Care Med,2002,30:2675-2683.
[12] Gatto LA, FluckRR Jr, NiemanGF. Alveolar mechanics in the acutely injured lung:role of alveolar instability in the pathogenesis of ventilator-induced lung injury[J].Respir Care,2004,49:1045-1055.
[13] Kitaoka H,Nieman GF,Fujino Y,et al.A 4-dimensional model of the alveolar structure[J].J Physiol Sci,2007,57:175-185.
[14] Hickling KG,Henderson SJ,Jackson R.Low mortality associated with low volume pressure limited ventilation with permissive hypercapnia in severe adult respiratory distress syndrome[J].Intensive Care Med,1990,16:372-377.
[15] No authors listed.The Acute Respiratory Distress Syndrome Network:Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome[J].N Engl J Med,2000,342:1301-1308.
[16] Schiller HJ,McCann UG 2nd,Carney DE,et al.Altered alveolar mechanics in the acutely injured lung[J].Crit Care Med,2001,29:1049-1055.
[17] Nieman GF, BredenbergCE, Clark WR, et al.Alveolar function following surfactant deactivation[J].J Appl Physiol,1981,51:895-904.
[18] Perlman CE,Bhattacharya J.Alveolar expansion imaged by optical sectioning microscopy[J].J Appl Physiol,2007,103:1037-1044.

