反复植入失败—胚胎因素的重要性
李博,王晓红
(第四军医大学唐都医院生殖医学中心,西安 710065)
尽管我们在辅助生殖领域已经取得了非常大的成就,但仍然有许多患者承受着反复种植失败带来的巨大的心理压力和高昂的治疗费用。目前,国际上对反复种植失败(Recurrent Implantation Failure,RIF)仍然没有一个统一的定义,通常将经历2~6次体外受精(IVF)周期或者移植10个高质量胚胎仍未获妊娠,视为RIF[1]。而且在具体的IVF临床工作中,3次IVF周期未获妊娠的患者即应引起高度重视[2]。
胚胎植入宫腔的过程依赖于很多因素的同步化,如胚胎质量、理想的培养条件、子宫内膜容受性和母体免疫系统等。植入过程中胚胎与内膜的关系,被很多学者形象的比喻为“种子”和“土地”之间的关系。Patrizio等[3]明确提出,RIF的发生主要由种子(胚胎因素)决定。另外,早在1886年就有宫外孕的报道[4],而且在1942年英格兰医学杂志上报道了一篇关于一位腹腔妊娠后产出活婴的病例[5],从而从另一个视角揭示了胚胎在植入过程中的重要作用。
因此,本综述将从胚胎视角审视其在RIF中扮演的重要角色,并从染色体异常、透明带硬化、体外培养条件、滋养层细胞功能以及胚胎早期代谢等方面,进行深度的解析和讨论。
一、染色体异常
染色体异常主要包括染色体结构和数目异常。目前公认,在发生RIF的患者中,高比例的染色体异常是主要原因之一。下面,我们将从父、母双方染色体和胚胎染色体两个方面进行阐述。
Raziel等[6]以65位重度RIF患者(≥6次IVF周期或者≥15个移植胚胎数)外周血为材料进行核型分析,结果显示,染色体结构异常如异位、倒位、微缺失等的比例显著增高。另有研究也支持此观点,Stern等[7]观察到RIF患者中染色体异常的比例为2.5%,且主要表现为异位(相互、罗氏)高发。因此,他们建议针对这些RIF患者,最好在IVF之前进行相应的遗传咨询。近年来,有学者专注于精子染色体异常与RIF之间的相关性研究。Rubio等[8]报道在少弱畸精症患者夫妇中,植入率和临床妊娠率均显著降低,该学者利用三色荧光原位杂交(FISH)技术针对13、18、21、X和 Y染色体进行了非整倍性和二体性比例的统计分析,结果显示,RIF患者进行卵胞浆内单精子注射(ICSI)治疗后,性染色体二体性的比例显著增高。另有研究证明,精子DNA损伤程度越高,其胚胎植入率和妊娠率越低[9]。而且进一步的研究显示,精子DNA损伤程度的增加与IVF或者ICSI后流产率增加密切相关[10]。因此,大量证据表明,不论来自父源或者母源的染色体异常因素,在RIF致病机理中均扮演着重要的角色。
我们知道,染色体非整倍性可以降低胚胎成功植入和妊娠的机率,但遗憾的是,现行的胚胎形态分级方法无法排除掉非整倍性胚胎,为RIF患者挑选出更具植入潜能的胚胎。有国外学者对高龄、反复流产和反复种植失败的患者进行了胚胎的植入前染色体筛查(Preimplantation Genetic Screening,PGS),数据显示,这些患者在IVF周期内获得的卵母细胞或者胚胎具有高比例的非整倍性,并分析认为,胚胎的非整倍性是植入失败的主要原因[3]。通过FISH技术对RIF患者第3天卵裂球的染色体(13、16、18、21、22以及 X和 Y)进行检测,Pehlivan等[11]报道,在发生3次及3次以上IVF失败的患者胚胎中,非整倍性比例高达67%。另有一项研究选择了20名RIF的患者,仍然是活检了单个卵裂球,但使用了比较基因组杂交技术(CGH),结果显示,胚胎非整倍性达到了60%[12],这与前者的研究相一致。该项研究中检测的染色体异常,包括一两条染色体非整倍性和复杂的染色体异常,因此,研究者认为,在人类早期胚胎中,不论是母源细胞质因子还是细胞周期控制因子突变造成的染色体复制和分离障碍,均是引起RIF的主要原因。
二、透明带硬化
哺乳动物的卵子周围被一层透明带包被着,透明带主要由糖蛋白、碳水化合物以及透明带特异蛋白组成[13]。透明带在精子结合、诱导顶体反应以及精卵结合方面发挥着重要作用[14]。在自然状况下,精卵结合后会发生透明带硬化,这是一种生理性变化,主要起到阻止多精受精、保护植入前胚胎完整性和有利于输卵管运输的作用[15]。在早期卵裂时期,透明带的存在可以维持内细胞团的完整性,但是在囊胚扩张时期,必须先发生孵化,才能完成植入[16]。在生殖领域,出于生殖力保存或者因为某些原因无法进行新鲜周期移植的原因,我们通常会通过冷冻技术,将卵母细胞和胚胎进行冷冻。有学者认为,冷冻后卵母细胞的皮质颗粒会提前释放,造成透明带硬化,从而影响精子穿透卵母细胞的能力[17]。1992年,Wood等[18]研究发现,冷冻-解冻后透明带发生硬化会明显阻碍受精过程,尤其影响体外受精时精子的穿透。导致受精失败的机制可能是透明带硬化会消耗精子的能量,降低精子穿透,并且改变精子头部的结合位点。Tian等[19]研究发现,冷冻剂处理和开放式拉长塑料细管法冷冻绵羊卵母细胞,透明带消化时间明显比对照组长。冷冻剂毒性试验组和玻璃化冷冻组单精子入卵率显著低于对照组。由于冷冻剂毒性试验组和玻璃化冷冻组透明带消化时间和单精子入卵率相比差异不显著,故认为,只有将卵母细胞暴露于冷冻剂中才会引起透明带硬化和导致精子穿透率降低。囊胚期扩张后透明带的裂解失败,会造成孵化受损和RIF发生[15]。有研究显示,冻融过程会导致透明带增厚和弹性下降,影响胚胎的孵化,而通过对解冻后胚胎的激光辅助孵化,可以显著提高植入率和临床妊娠率[20]。
三、体外培养条件
使用高质量、标准化的培养液无疑是IVF成功的基础。不完善的胚胎培养体系会损害胚胎发育潜能[21],进而导致RIF发生。因此,我们需要通过渗透压检测、pH测定和精子生化实验等保证培养系统的标准化。而且,在某些RIF患者中,也许我们有必要采用一些个性化的培养方案来优化胚胎发育。
在IVF临床,大约有3%的患者会因为胚胎质量太差而发生无可用胚胎移植或者植入失败。Sermondade等[22]选择了一些IVF反复受精失败的患者,这些患者的获卵数和受精率都是正常的,但当胚胎发育到第2天的时候便发生了高比例(60%)的碎片化(≥40%)。因此,研究者们改变了移植策略,在原核期便进行了移植,结果获得了单胚6.4%的临床妊娠率和18.9%的活产率。并且进一步得出结论,不合适的体外培养条件会大大影响本来质量就不好的胚胎发育,从而导致胚胎植入失败。
四、滋养外胚层细胞
在胚胎发育成桑椹胚后,桑椹胚进一步发育,细胞开始出现分化。聚集在胚胎的一端,个体较大的细胞,称为内细胞团(ICM),而沿透明带内壁扩展和排列的,个体较小的细胞,称为滋养层细胞(Trophectoderm,TE),它们在胚胎植入过程中发挥着重要的作用,将来会发育成胎膜和胎盘。
在植入发生之前,哺乳动物的胚胎必须脱离透明带的包被,才能与子宫内膜发生实质性的接触。关于透明带裂解的机制目前不是十分清楚。很多的研究都停留在描述性研究的层面,通过体外观察,描述如下:透明带的裂解始于囊胚扩张,不断的扩张使得透明带变得越来越薄,直至发生裂解,使得囊胚从透明带的包裹中排出,样子看起来就像一个哑铃,这个过程称为孵化。但是这样的孵化模型受到了越来越多的质疑[23],并且对胚胎发育潜能的预测意义不大[24]。TE细胞质突触在透明带裂解以及植入中的作用,引起了人们的关注。关于TE细胞质突触的研究不多,最早的要追溯到1883年,Spee等[25]在豚鼠中第一次描述了TE细胞质突触可以穿透透明带,多年后Blandau等[26]验证了他们的研究结果。1990年,有学者通过小鼠胚胎TE细胞质突触的体外观察,发现植入前囊胚、植入延迟的囊胚与发生植入的囊胚相比,TE细胞质突触的有无和形态区别很大,并认为其在囊胚植入过程中起着重要的作用[27]。Gonzales等[28]利用先进的Time-lapse技术对马、牛和人类胚胎进行了实时观察,结果显示,在囊胚期,这三类胚胎的TE细胞确实会长出细胞质突触,进而通过生长和一定角度的运动穿透透明带(图1),并且证明随后发生的胚胎孵化过程,正是位于这个穿透点[24](图2),TE细胞质突触主要起到穿透和在子宫内膜上锚定的作用。2010年Stoikos等[29]研究显示,高浓度的activin A分子可以抑制TE细胞中具有粘附能力的分子的表达,从而导致植入失败。近年来,许多研究显示,TE细胞的质量对胚胎植入和活产率有很好的预测作用。由此可见,TE细胞确实在胚胎植入过程中发挥着重要的作用。
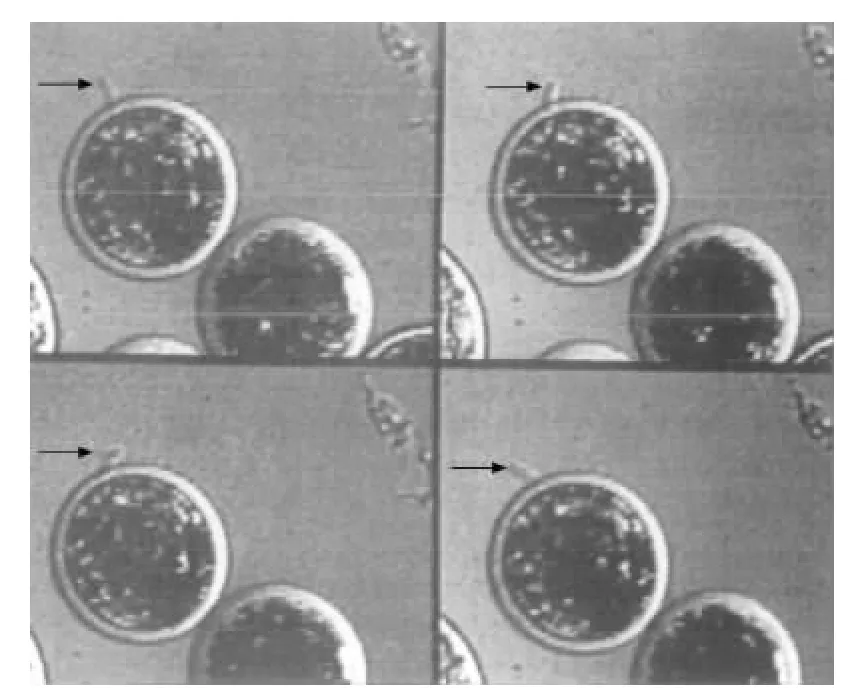
图1 TE细胞质突触通过一系列角度运动穿透透明带[24]

图2 胚胎孵化发生在TE细胞质突触穿透点[24]
五、胚胎发育潜能预测
从前面的论述中,我们可以看到,现行的胚胎形态学评价体系,还不足以精准地筛选出发育潜能好的胚胎,那么,除了我们前面提到的PGS和植入前遗传学诊断(PGD)的方法外,还有什么指标可以预测胚胎的发育和植入潜能呢?
人类白细胞抗原G(HLA-G)属非经典 HLA-I类抗原,最早在人类胎盘组织中发现[30],主要在母胎界面的绒毛外滋养层细胞上表达[27],是母体对同种半异体抗原的胎儿免疫应答中重要的免疫耐受分子。有研究表明,可溶性 HLA-G(sHLA-G)存在于体外培养几天后的胚胎培养液中,由胚胎分泌,并且与胚胎的植入潜能密切相关[31]。Yao等[32]研究了HLA-G分子在植入前胚胎发育过程中的表达,发现在2细胞卵裂期开始,便有不同亚型的HLA-G分子开始表达,当胚胎发育至囊胚期时,HLA-G便开始特异性表达于滋养外胚层细胞,开始为植入做准备。王晓红等[33]也证明了在卵裂早期便有HLA-G分子的表达,与上述结论一致。巨瑛等[34]收集了41名患者的84份胚胎培养液,通过ELISA方法测定了sHLA-G的浓度,sHLA-G阳性率为52%(44/84),阳性培养液中sHLA-G 浓度为3.7~16.6ng/ml。移植至少一个sHLA-G阳性胚胎的妊娠率为69%,移植胚胎全部为sHLA-G阴性者的妊娠率为18%,差异显著(P<0.05)。另外,Fishel等[35]通过腹腔镜手术获取卵母细胞,并进行了体外受精和培养,结果显示,在胚胎卵裂早期,无法检测到β-HCG,当胚胎发生致密化时,便可以检测到β-HCG含量,囊胚时期达到43U/L,孵化后达到6,033U/L,差异极显著(P<0.01)。大量研究显示,β-HCG 与胚胎植入密切相关[36-38]。
胚胎植入失败还与子宫内膜容受性以及胚胎与子宫之间的对话有关,但正如我们上面的论述一样,胚胎质量在其中起到了非常重要的作用,而且这种重要性甚至远超我们的理解和想象。
[1] Tan BK,Vandekerckhove P,Kennedy R,et al.Investigation and current management of recurrent IVF treatment failure in the UK[J].BJOG,2005,112:773-780.
[2] Margalioth EJ,Ben-Chetrit A,Gal M,et al.Investigation and treatment of repeated implantation failure following IVF-ET[J].Hum Reprod,2006,21:3036-3043.
[3] Patrizio P,Bianchi V,Lalioti MD,et al.High rate of biological loss in assisted reproduction:it is in the seed,not in the soil[J/OL].Reprod Biomed Online,2007,14:92-95.
[4] Robertson GJ.A case of extra-uterine Pregnancy:death of the fœtus at four months:intestinal obstruction from pressure:removal of the fœtus by perineal section:recovery[J].Br Med J,1886,1(1311):288-289.
[5] Gushue-Taylor G.Full-term extra-uterine pregnancy with living child[J].Br Med J,1942,1(4246):640.
[6] Raziel A,Friedler S,Schachter M,et al.Increased frequency of female partner chromosomal abnormalities in patients with high-order implantation failure after in vitro fertilization[J].Fertil Steril,2002,78:515-519.
[7] Stern C, Pertile M, Norris H,et al.Chromosome translocations in couples with in-vitro fertilization implantation failure[J].Hum Reprod,1999,14:2097-2101.
[8] Rubio C,Gil-Salom M,Simón C,et al.Incidence of sperm chromosomal abnormalities in a risk population:relationship with sperm quality and ICSI outcome[J].Hum Reprod,2001,16:2084-2092.
[9] Bungum M,Humaidan P,Axmon A,et al.Sperm DNA integrity assessment in prediction of assisted reproduction technology outcome[J].Hum Reprod,2007,22:174-179.
[10] Zini A,Boman JM,Belzile E,et al.Sperm DNA damage is associated with an increased risk of pregnancy loss after IVF and ICSI:systematic review and meta-analysis[J].Hum Reprod,2008,23:2663-2668.
[11] Pehlivan T,Rubio C,Rodrigo L,et al.Impact of preimplantation genetic diagnosis on IVF outcome in implantation failure patients[J/OL].Reprod Biomed Online,2003,6:232-237.
[12] Voullaire L,Wilton L,McBain J,et al.Chromosome abnormalities identified by comparative genomic hybridization in embryos from women with repeated implantation failure[J].Mol Hum Reprod,2002,8:1035-1041.
[13] Bleil JD,Wassarman PM.Structure and function of the zona pellucida:identification and characterization of the proteins of the mouse oocyte’s zona pellucida[J].Dev Biol,1980,76:185-202.
[14] van Duin M,Polman JE,De Breet IT,et al.Recombinant human zona pellucida protein ZP3produced by chinese hamster ovary cells induces the human sperm acrosome reaction and promotes sperm-egg fusion[J].Biol Reprod,1994,51:607-617.
[15] De Vos A,Van Steirteghem A.Zona hardening,zona drilling and assisted hatching:new achievements in assisted reproduction[J].Cells Tissues Organs,2000,166:220-227.
[16] Trounson AO,Moore NW.The survival and development of sheep eggs following complete or partial removal of the zona pellucida[J].J Reprod Fertil,1974,41:97-105.
[17] Wood MJ,Barros C,Candy CJ,et a1.High rates of survival and fertilization of mouse and hamster oocytes after vitrification in dimethyl sulfoxide[J].Biol Reprod,1993,49:489-495.
[18] Wood MJ,Whittingham DG,Lee SH,et a1.Fertilization failure of frozen mouse oocytes is not due to premature cortical granule release[J].Biol Reprod,1992,46:1187-1195.
[19] Tian SJ,Yan CL,Yang HX,et a1.Vitrification solution containing DMSO and EG can induce parthenogenetic activation of in vitro mature ovine ooeytes and decrease sperm penetration[J].Anim Reprod Sci,2007,101:365-372.
[20] Basak B,Bulent U,Kayhan Y,et al.Laser-assisted hatching increases pregnancy and implantation rates in cryopreserved embryos that were allowed to cleave in vitro after thawing:a prospective randomized study[J].Hum Reprod,2006,21:2136-2140.
[21] Gardner DK,Reed L,Linck D,et al.Quality control in human in vitro fertilization[J].Semin Reprod Med,2005,23:319-324.
[22] Sermondade N,Delarouzière V,Ravel C,et al.Characterization of a recurrent poor-quality embryo morphology phenotype and zygote transfer as a rescue strategy[J/OL].Reprod Biomed Online,2012,24:403-409.
[23] Gonzales DS,Bavister BD.Zona pellucida escape by hamster blastocysts in vitro is delayed and morphologically different compared with zona escape in vivo[J].Biol Reprod,1995,52:470-480.
[24] Bavister BD.Culture of preimplantation embryos,facts and artifacts[J].Hum Reprod Update,1995,1:91-148.
[25] Spee GF.Beitrag zur entwickelungsgeschichte der fruheren stadien des meerschweinchens bis zur vollendung der keunblase[J].Archiv Anat Physiol[Ger],1883,7:44-60.
[26] Blandau RJ.Observations on implantation of the guinea pig ovum[J].Anas Rec,1949,103:19-47.
[27] McRae AC, Church RB.Cytoplasmic projections of trophectoderm distinguish implanting from preimplanting and implantation-delayed mouse blastocysts[J].J Reprod Fertil,1990,88:31-40.
[28] Gonzales DS,Jones JM,Pinyopummintr T,et al.Implantation:Trophectoderm projections:apotential means for locomotion,attachment and implantation of bovine,equine and human blastocysts[J].Hum Reprod,1996,11:2739-2745.
[29] Stoikos CJ,Salamonsen LS,Hannan NJ,et al.Activin A regulates trophoblast cell adhesive properties:implications for implantation failure in women with endometriosis associated infertility[J].Hum Reprod,2010,25:1767-1774.
[30] Ellis SA,Sargent IL,Redman CW,et al.Evidence for a novel HLA antigen found on human extravillous trophoblast and a choriocarcinoma cell line[J].Immunology,1986,59:595-601.
[31] Kovats S,Main EK,Librach C,et al.A class I antigen,HLAG,expressed in human trophoblasts[J].Science,1990,248:220-223.
[32] Yao YQ,Barlow David H,Sargent IL.Differential expression of alternatively spliced transcripts of HLA-G in human preimplantation embryos and inner cell masses [J].Immunology,2005,175:8379-8385.
[33] 王晓红,姚元庆,罗亚宁 .HLA-G蛋白在人类着床前胚胎的表达[J].生殖与避孕,2006,26:271-274.
[34] 巨瑛,王晓红,罗亚宁,等 .胚胎分泌的可溶性人类白细胞抗原G(sHLA-G)与IVF临床妊娠率的相关性研究[J].生殖与避孕,2009,29:257-260.
[35] Fishel SB,Edwards RG,Evans CJ.Human chorionic gonadotropin secreted by preimplantation embryos cultured in vitro[J].Science,1984,223:816-818.
[36] Ertzeid G,Tanbo T,Dale PO,et al.Human chorionic gonadotropin levels in successful implantations after assisted reproduction techniques[J].Gynecol Endocrinol,2000,14:258-263.
[37] Kato K,Sairam MR,Manjunath P.Inhibition of implantation and termination of pregnancy in the rat by a human chorionic gonadotropin antagonist[J].Endocrinology,1983,113:195-199.
[38] Palomino WA,Argandoña F,Azúa R,et al.Complement C3 and decay-accelerating factor expression levels are modulated by human chorionic gonadotropin in endometrial compartments during the implantation window[J].Reprod Sci,2013,20:1103-1110.

