冰片对鼻咽癌细胞容积敏感性氯通道的激活作用
孟 龙,王海波,邓志钦,汪 源,伍嘉宝,赖周毅,吕瑞玲,孙晓雪,朱林燕,陈丽新,王立伟
(暨南大学1.医学院生理学系、2.医学院药理学系,广东 广州 510632)
冰片(borneol)又称龙脑、龙脑香,是一个双环单萜醇,具有芳香开窍、清热止痛,消炎消肿等作用;近来研究发现冰片作用广泛,冰片对颅脑缺血/再灌注损伤有抑制作用[1],可消除早期手术或外伤引起的脑细胞及组织水肿;冰片在肛肠外科也应用广泛,在消肿止痛方面效果明显[2],但冰片消除细胞肿胀及组织肿胀的机制却不清楚。
氯通道是人体各种细胞上内分布最广的阴离子通道。我们前期的研究发现,氯通道阻断剂可引起等渗环境中的细胞体积增大,提示氯通道在生理状态下仍有少量开放,参与细胞的基本形态调节,保持细胞内外水平衡。用低渗溶液灌流细胞时,细胞体积先增大,后回缩,趋向于原来的体积,容积敏感性氯通道的开放在其中起着重要作用[3]。文献报道,冰片的消肿作用不仅因为冰片具有抑制损伤组织产生炎症因子,更有明显消除组织细胞肿胀的作用[4-5]。冰片的抑制细胞肿胀是否与容积敏感性氯通道有关?目前未见报道。本实验拟研究冰片能否激活氯通道,探讨冰片的消除细胞肿胀作用是否与容积敏感性氯通道有关。
1 材料与方法
1.1 细胞培养 低分化鼻咽癌细胞(CNE-2Z)用含10%胎牛血清的RPMI 1640培养液,并加入双抗:10万 IU·L-1青霉素、0.1 g·L-1链霉素;在 5%CO2,37℃饱和湿度的细胞培养箱常规方法培养,间隔48 h传代1次。实验前用0.25%胰酶消化、收集并重悬细胞,细胞悬液接种在直径22 mm的圆形玻片上,放入培养箱使细胞贴壁,待细胞贴壁1 h后进行实验。
1.2 药物试剂 冰片购置于上海纯优生物科技有限公司,纯度:≥98%(HPLC),用二甲基亚砜(dimethyl sulpoxide,DMSO)配置成 20 mmol·L-1储存液。使用前用等渗灌流液稀释至终浓度20μmol·L-1。Tamoxifen购于 Sigma公司,用 DMSO配制为20 mmol·L-1储存液,使用前用等渗溶液稀释至20 μmol·L-1。
1.3 膜片钳实验
1.3.1 细胞外灌流液 等渗灌流液(isotonic solution)含(mmol· L-1):70 NaCl,0.5 MgCl2,2 CaCl2,10 HEPES,140 D-mannitol,渗透压为300mOsmol· L-1;高渗液(47%hyper)渗透压为440 mOsmol·L-1,除溶液中含280 mmol· L-1的D-mannitol外,其余成分均同于等渗灌流液。配制好的液体用Osmomat030冰点渗透压计(Osmomat030;Gonotec,Germany)测定渗透压,Tris碱调pH值至7.4。
1.3.2 电极内液 使用特配的溶液记录氯电流,电极内液含(mmol· L-1):70 N-methyl-D-glucamine chloride(NMDG-Cl),1.2 MgCl2,1 EGTA,10 HEPES,140 D-mannitol,2 ATP。
1.3.3 全细胞膜片钳记录 指数增殖期的CNE-2Z细胞,用0.25%的胰酶消化后,吹打配制成单细胞悬液,接种于直径22 mm的圆形玻片上,在5%CO2,37℃饱和湿度的细胞培养箱孵育,待细胞贴壁1 h进行实验。用微电极拉制器(PB-7)拉制电极,灌入电极内液后微电极前端电阻为5~10 MΩ。用EPC-7膜片钳放大器(HEKA,Darmstadt,Germany)记录单细胞的全细胞氯电流。用CED 1401(Cambrige,UK)采集电流和电压信号,采样频率为3 kHz。全细胞电压钳制模式在0、±40和±80 mV反复循环,脉冲波宽设置为200 ms,脉冲间隔为4 s。用EPC软件(CED,Camridge Electronic Design,UK)记录并分析实验数据。
将贴壁细胞玻片放在特制的灌流装置中,全细胞记录方式记录CNE-2Z细胞膜电流。记录稳定的背景电流3~5 min,加入20μmol·L-1冰片溶液灌流细胞,观察并记录激活电流的潜伏期、电流密度等。电流达到峰值并平稳后,加入20μmol· L-1tamoxifen氯通道阻断剂溶液,观察氯通道阻断剂对冰片激活电流的影响。计算氯通道阻断剂对冰片激活电流的抑制率。抑制率的计算公式为:抑制率/% =[(Cmax-CIso)-(CBlockers-CIso)]/(Cmax-CIso)×100%,其中 CIso是等渗溶液中的基础电流值,Cmax是冰片激活的电流最大值,CBlockers是加入阻断剂后的最大效应时的电流值。在观察冰片激活氯通道的容积敏感性实验中,当冰片激活细胞电流达到峰值并稳定后,换为含同等浓度冰片的高渗灌流液,观察渗透性细胞容积缩小对冰片激活氯电流的影响。
1.4 细胞体积测量 将已经贴壁的细胞玻片放入特制的灌流槽中,放在倒置显微镜下,选定好理想的视野,按特定的拍摄要求设定拍摄程序,用Image-Pro Plus图像分析软件控制数字式摄像机动态拍摄,制成序列文件。用Scion Image图像分析软件对拍摄的图片进行处理,测量细胞的面积并使用Sigma Plot软件按以下公式计算细胞体积:V=4/3×π×(S/π)3/2。对细胞体积进行标准化处理;公式为:V st=V t÷V a×100%;V t为冰片作用后细胞体积,V a是药物处理前等渗灌流液作用时细胞体积的平均值。细胞容积缩小率的百分率计算:V%=(VIso-Vmin)÷VIso×100%;VIso是药物处理前等渗灌流液时细胞的体积。Vmin是药物处理后细胞的最小体积。
1.5 统计学处理 采用SPSS 13.0软件进行统计分析,数据用¯x±s表示,根据实验情况,分别采用方差分析(ANOVA)或配对t检验进行显著性检验,每项实验至少重复3次。
2 结果
2.1 冰片激活CNE-2Z细胞电流 如Fig 1A所示,冰片可以激活CNE-2Z细胞电流。在细胞外灌流等渗溶液时,细胞的基础电流很小,在+80 mV电压钳制下,外向电流密度(6.73±3.6)pA·pF-1,在-80 mV电压钳制下,内向电流密度为(-6.34±3.5)pA·pF-1。当换用 20μmol·L-1冰片溶液灌流细胞后,可以明显激活一个电流,其潜伏期为(5.1±0.6)min(n=16)。外向电流较大(78.85±4.88)pA·pF-1(+80 mV),内向电流较小(-52.36±4.41)pA·pF-1(-80mV),呈现明显的外向优势(Fig 1B、D),无时间及电压依赖性的失活(Fig 1C,D)。该电流的翻转电位(-5.18±0.70)mV。接近本实验条件氯离子平衡电位理论值(-0.9 mV),提示冰片激活的电流为氯电流。
2.2 氯通道阻断剂tamoxifen对冰片激活电流的抑制作用 tamoxifen(tam)是常用的氯通道阻断剂,本实验观察了tamoxifen对冰片激活电流的作用。如Fig 2A所示,用冰片激活CNE-2Z细胞电流后,细胞外灌流20μmol·L-1tamoxifen可以完全抑制该电流。在不同钳制电压条件下,tamoxifen作用前后的电流密度见Fig 2B,在+80 mV电压钳制时,tamoxifen使外向电流从(78.7±9.56)pA/pF下降到(8.89±2.81)pA/pF(n=5,P<0.01),抑制率为(98.02±2.73)%;+80 mV电压钳制时,内向电流从(-52.59±10.84)pA/pF下降到(-7.25±1.95)pA/pF(n=5,P<0.01),抑制率为(101.57±5.35)%,tamoxifen对内、外向电流的抑制率差异无显著性(n=5,P>0.05)。Fig 2C,D分别显示在冰片、冰片加tamoxifen条件下的细胞电流瞬时图。用来配制tamoxifen储存液的DMSO在灌流液中的终浓度低于1‰,其对冰片激活的电流没有影响。本结果进一步证实冰片激活的电流是氯通道介导的氯电流。
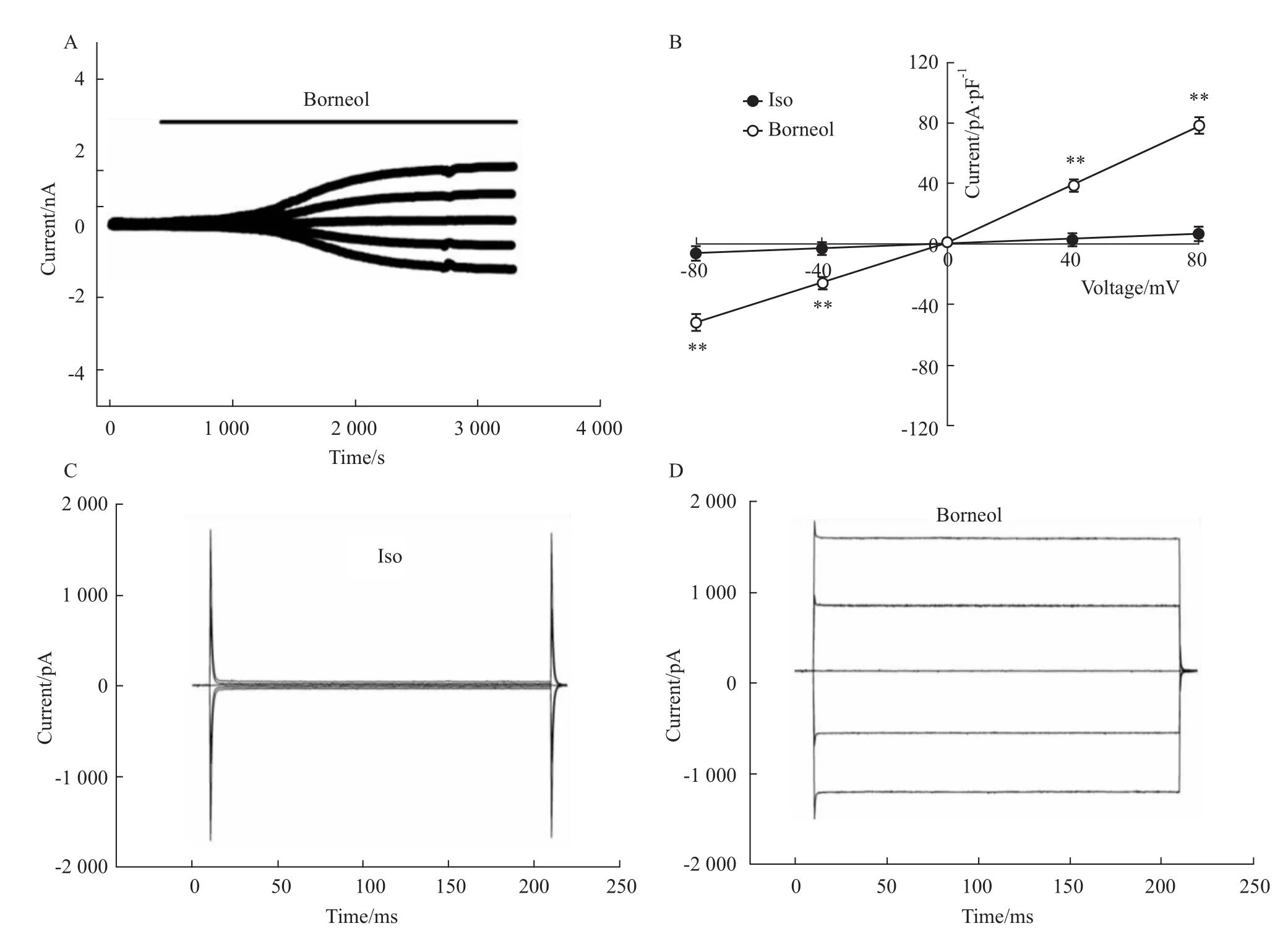
Fig 1 Borneol-induced currents in CNE-2Z cells(x¯±s,n=5)A:The time course of Borneol-activated currents in CNE-2Zcells;B:The current-voltage relationship of Borneol activated currents in CNE-2Z cells.**P<0.01 vs Iso;Cellswere clamped at0,±40 mV、±80 mV repeatedly;C:Traces of background currents recorded in the isotonic solution(Iso);D:Traces of Borneol-induced currents.
2.3 冰片激活氯电流的容积敏感性 Fig 3A显示了冰片激活的氯电流被440mOsmol·L-1高渗溶液抑制的全过程,细胞外灌流20μmol· L-1冰片等渗溶液后,激活外向优势的氯电流,当该电流达到峰值并稳定后;灌流含20μmol· L-1冰片的47%高渗溶液,内、外向氯电流被迅速而完全地抑制。换回含冰片的等渗溶液后,电流可恢复(数据未显示)。Fig 3B电流-电压曲线显示在等渗、高渗不同条件下,冰片激活的氯电流密度差异有显著性(n=5,P<0.01),表明在细胞外高渗条件下,细胞皱缩,容积缩小,可导致冰片激活的氯通道关闭,提示冰片激活的氯电流具有明显的容积敏感性。
2.4 冰片对CNE-2Z细胞体积的影响 在特制的浴槽中持续细胞外灌流20μmol·L-1的冰片溶液,在倒置相差显微镜下连续拍摄细胞图像,观察冰片对细胞体积的影响。如Fig 4A所示,细胞外灌流等渗溶液时CNE-2Z细胞体积比较稳定,在观察的50 min内细胞体积无明显改变。而冰片引起较明显的细胞体积缩小(Fig 4B),当细胞外灌流含20μmol·L-1冰片(Borneol)的溶液 30 min后,与加冰片前对照相比较,细胞体积减小(9.44±1.6)%(n=16,P<0.01)。在去除冰片后,细胞体积趋于稳定,没有进一步缩小,但未恢复至原来水平。氯通道阻断剂tamoxifen对冰片引起的细胞体积缩小有抑制作用(n=16,P<0.01)。如 Fig 4C(n=15)所示,在灌流氯通道阻断剂后加入冰片,细胞体积无缩小。
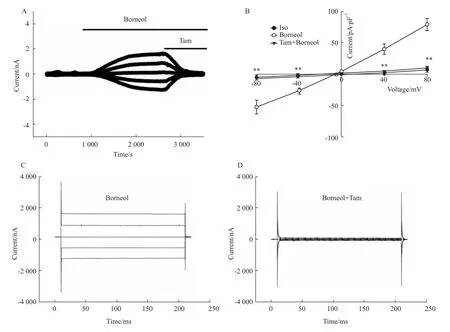
Fig 2 Inhibition of Borneol-activated currents by tamoxifen(x±s,n=5)A:The time course of inhition of Borneol-activated currents by tamoxifen(Tam);B:Current-voltage relationships.**P<0.01 vs Borneol;C:Current traces of Borneol-induced currents;D:Current traces showing inhibition of Borneol-activated currents by tamoxifen.
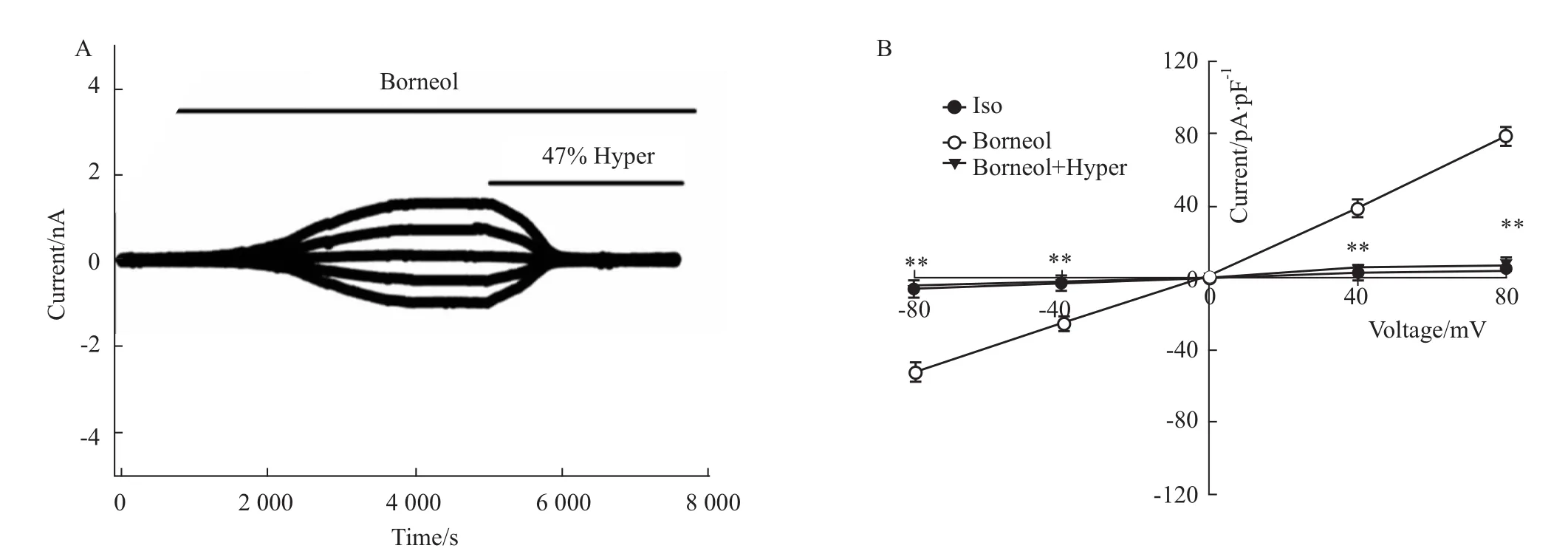
Fig 3 Inhibition of Borneol activated currents by 47%Hypertonic solution(±s,n=5)A:The time course of inhibition of Borneol-activated currents by 47%Hypertonic solution;B:Current-voltage relationships.**P<0.01 vs Borneol.
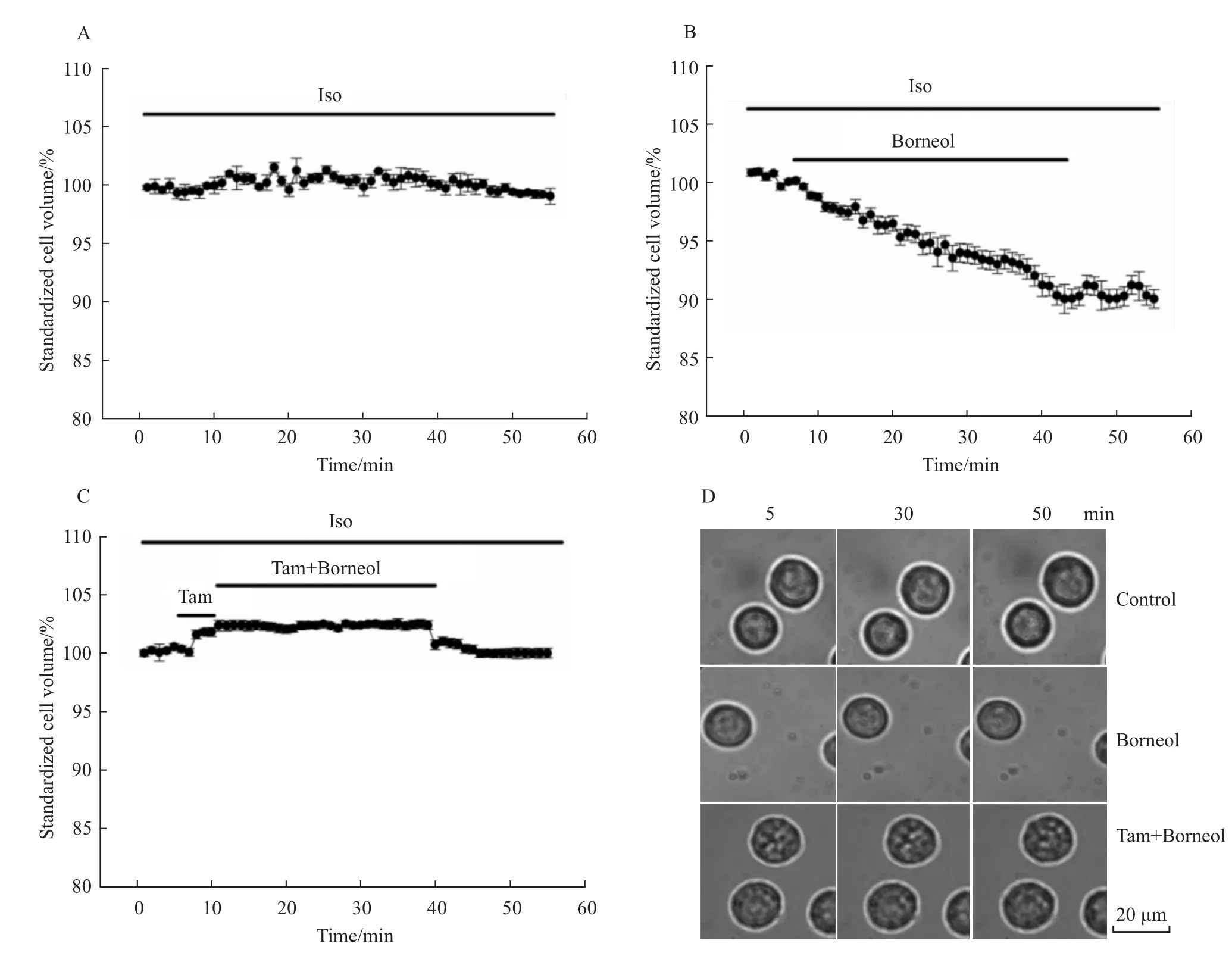
Fig 4 Changes of the CNE-2Z cell volume induced by BornolA,B,C show CNE-2Z cells bathed in different solutions;D shows CNE-2Z cells bathed in the three experiment conditions for different time periods.Upper line shows CEN-2Z cells bathed in isotonic solution,middle line shows CNE-2Z cells bathed in borneol solution,bottorn line shows CNE-2Z cells bathed in tamoxifen solution with Borneol.
3 讨论
冰片是我国常用中药之一。冰片常用于通诸窍、散郁火、去翳明目、清热止痛消肿。冰片可单用,在软组织肿胀消肿治疗中作用明显,也可配伍其它药物共同使用。研究发现冰片具有抑制组织分泌炎症因子作用,但冰片消肿的机制并不清楚。
我们前期的研究表明,氯通道参与细胞的多种基本生理功能调节,如细胞容积调节[6]、细胞周期调节[7],细胞凋亡[8]及参与红细胞溶血[9]等。研究表明[6],当细胞外灌流低渗溶液时,细胞体积胀大,激活容积敏感性氯通道,细胞内Cl-及水外流,使肿胀细胞恢复到或接近到原来的体积,这一过程称细胞调节性容积缩小(regulatory volume decrease,RVD);Cl-是细胞 RVD的关键离子,氯通道被激活,Cl-及水的外流是细胞调节性容积缩小的主要机制之一。
本实验使用全细胞膜片钳记录方法,直接观察冰片对氯离子通道的影响。实验结果证实,细胞外灌流等渗的冰片溶液可激活一个有明显外向优势的电流,并在不同的电压钳制下电流的方向与Cl-运动的方向一致;再者据细胞外灌流液及电极内液分析,钾、钠阳离子的平衡电位都比较高可达100 mV以上,而该电流的翻转电位为(-5.18±0.70)mV比较接近Cl-的平衡电位,这提示冰片激活的电流为氯电流。氯通道阻断剂tamoxifen完全抑制此电流,进一步证实冰片激活的电流为氯通道介导的氯电流。
冰片对炎症因子等所致的细胞肿胀有消肿作用,其机制是否与氯通道有关,目前没有报道。本结果显示冰片激活容积敏感性氯通道,导致细胞容积减小,该作用可被氯通道阻断剂tamoxifen所抑制,表明冰片通过开放氯通道,引起氯离子及水外排,导致细胞体积缩小。提示容积敏感性氯通道可能是冰片对细胞消肿作用的靶点之一。冰片激活的氯电流可以被细胞外灌流高渗溶液抑制,该电流无明显时间及电压依赖性并被氯通道阻断剂tamoxifen阻断,这些特征与我们前期报道的低渗激活容积敏感性氯通道的特征很相似[10],但冰片激活的氯通道和低渗溶液激活鼻咽癌细胞容积敏感性氯通道的激活途径可能不同,有待进一步研究。
参考文献:
[1] 李 欢,夏鑫华,刘 梅 ,等.麝香配伍冰片干预局灶性脑缺血-再灌注损伤的代谢组学研究[J].中药材,2012,35(8):1274-9.
[1] Li H,Xia X H,Liu M,etal.Metabolomics research on focal cerebral ischemia reperfusion injury in rats’brain treated by musk combined with borneol[J].J Chin Med Nat,2012,35(8):1274-9.
[2] Almeida JR,Souza G R,Silva JC,et al.Borneol,a bicyclic monoterpene alcohol,reduces nociceptive behavior and inflammatory response in mice[J].Scientific World J,2013,2013:808460.
[3] Sun X R,Chen L X,Luo H,et al.Volume-activated chloride currents in fetal human nasopharyngeal epithelial cells[J].J Membr Biol,2012,245(2):107-15.
[4] Juhás S,Cikos S,CzikkováS,etal.Effects of borneol and thymoquinone on tnbs-iinduced colitis inmice[J].Folia Biol(Praha),2008,54(1):1-7.
[5] 赵保胜,董淑云,宓穗卿,等.冰片对脑外伤脑血管内皮细胞INOS表达的影响[J].中国药理学通报,2002,18(5):590-1.
[5] Zhao B S,Dong SY,MiSQ,Wang N S.The influence of borneol to the iNOS of brain microvascular endothelial cells[J].Chin Pharmacol Bull,2002,18(5):590-1.
[6] 陈丽新,王立伟 朱林燕,等.Cl-在鼻咽癌细胞调节性容积回缩中的作用[J].中国病理生理杂志,2002,18(5):490-3.
[6] Chen L X,Wang LW,Zhu L Y,et al.Role of Cl-in regulatory volume decrease of nasopharyngeal carcinoma cells[J].Chin J Pathophysiol,2002,18(5):490-3.
[7] Chen L X,Zhu L Y,Jacob TJC,Wang LW.Roles of volume-activated Cl-currents and regulatory volume decrease in the cell cycle and proliferation in nasopharyngeal carcinoma cells[J].Cell Prolif,2007,40(2):253-67.
[8] 李 媛,刘善文,李华荣,等.丹参酮ⅡA对低分化鼻咽癌细胞氯通道的激活作用[J].中国药理学通报,2011,27(9):1205-9.
[8] Li Y,Liu SW,Li H R,et al.Activation of chloride channels by tanshinoneⅡA in nasopharyngeal carcinoma cells[J].Chin Pharmacol Bull,2011,27(9):1205-9.
[9] 滕双凤,刘振锋,厉冰雪,等.氯通道阻断剂和白头翁皂苷的协同溶血作用[J].中国药理学通报,2012,28(10):1379-82.
[9] Teng SF,Liu Z F,Li B X,et al.Synergistic effects of chloride channel blockers on the hemolysis induced by Pulsatilla saponin[J].Chin Pharmacol Bull,2012,28(10):1379-82.
[10]Chen L X,Wang LW,Zhu l Y,etal.Cell cycle-dependentexpression of volume-activated chloride currents in nasopharyngeal carcinoma cells[J].Am J Physiol Cell Physiol,2002,283(4):C1313-23.