沉默JAG1基因对人乳腺癌MDA-MB-231细胞增殖和凋亡的影响*
袁磊,李伯和,时冉冉,高丽,宋金玲,王建国
(漯河医学高等专科学校分子生物学实验室,河南漯河 462002)
沉默JAG1基因对人乳腺癌MDA-MB-231细胞增殖和凋亡的影响*
袁磊,李伯和,时冉冉,高丽,宋金玲,王建国△
(漯河医学高等专科学校分子生物学实验室,河南漯河 462002)
目的:探究沉默Jagged 1(JAG1)基因对人乳腺癌MDA-MB-231细胞增殖和凋亡的影响及其分子生物学机制。方法:用已构建的pRS-JAG1重组质粒转染人乳腺癌MDA-MB-231细胞,采用Western blotting方法检测重组质粒对JAG1蛋白表达的影响;MTT比色法测定沉默JAG1对细胞生长的抑制情况;流式细胞术检测细胞周期和细胞凋亡;蛋白印记分析细胞周期蛋白1(cyclin D1)、p21CIP1/WAF1、p27KIP1、p-Rb、Bcl-2、Bax、Bcl-xL和cleaved caspase-3蛋白水平的变化。结果:Western blotting结果证实重组质粒可在72h内有效抑制JAG1蛋白表达;人乳腺癌MDA-MB-231细胞JAG1被沉默后,细胞的生长速度明显减慢,细胞明显阻滞于G0/G1期,细胞凋亡率显著升高(P<0.05),cyclin D1、p-Rb、Bcl-2和Bcl-xL蛋白水平被下调(P<0.05),而p21CIP1/WAF1、p27KIP1、Bax和cleaved caspase-3的蛋白水平显著升高(P<0.05)。结论:沉默JAG1可有效抑制人乳腺癌MDA-MB-231细胞增殖,并诱导其凋亡。本研究为以JAG1为分子靶点的三阴乳腺癌治疗提供实验依据。
JAG1蛋白;短发夹RNA;细胞周期;细胞凋亡;MDA-MB-231细胞
乳腺癌是女性最常见的恶性肿瘤之一。近年来发病率和死亡率明显上升,并趋于年轻化。尽管手术治疗和术后多种辅助治疗对患者的预后有明显的改善,但是乳腺癌仍具有较高的复发率和死亡率[1]。Notch信号通路广泛存在于脊椎动物和非脊椎动物,在进化上高度保守,通过相邻细胞之间的相互作用调控胚胎发育、血管发生、程序性细胞死亡和细胞增殖等多种生理过程[2-5],在肿瘤的侵袭、转移、凋亡、增殖和血管生成等病理过程中也发挥着关键作用[6-7]。
Notch信号途径的激活始于Notch受体胞外区与相邻细胞表面的Notch配体胞外区的结合,哺乳动物有4种Notch受体(Notch1~4)和5种Notch配体(Delta-like ligand,DLL1,3,4和Jagged,JAG1,2)。在乳腺癌细胞系中,MDA-MB-231、MCF-7、MDA-MB-468、ZR-75-1、T47D和SKBR3等细胞均不表达DLL3、DLL4和Notch4,只有MDA-MB-231细胞不表达Notch3,MDA-MB-468和SKBR3细胞不表达JAG2,MCF-7、ZR-75-1和T47D细胞表达DLL1,JAG1在MDA-MB-231细胞中表达较强[8]。
O'Neill等[9]的研究发现Notch2信号通路可抑制MDA-MB-231细胞增殖并促进细胞凋亡。我们前期研究发现沉默Notch1基因可促进MCF-7细胞凋亡[10]。为进一步探讨Notch配体在细胞增殖和凋亡中的作用及其作为分子靶点用于乳腺癌治疗的潜在价值,本研究通过沉默JAG1表达,在体外观察其对人乳腺癌MDA-MB-231细胞增殖与凋亡的影响。
材料和方法
1 材料
人乳腺癌MDA-MB-231细胞由本实验室保存;重组质粒pRS-JAG1由本实验室前期构建;胎牛血清和RPMI-1640培养基购自Gibco;质粒提取试剂盒购自北京天根公司;脂质体Lipofectamine 2000购自Invitrogen;JAG1、cyclin D1、p21CIP1/WAF1、p27KIP1、p-Rb (Ser807/811)、Bcl-2、Bax、cleaved caspase-3、β-actin抗体和HRP标记山羊抗兔IgG购自Santa Cruz;Annexin V-FITC/PI细胞凋亡检测试剂盒购自Invitrogen。
2 方法
2.1 细胞培养用含10%胎牛血清的RPMI-1640培养基,于37℃、5%CO2培养箱中培养MDA-MB-231细胞,观察细胞生长情况,每2~3 d用胰酶消化,传代培养。
2.2 重组质粒转染当细胞汇合度达80%以上时换为无血清培养基,使用Lipofectamine 2000将构建好的重组质粒pRS-JAG1和pRS-scrambled分别转染MDA-MB-231细胞,置于37℃、5%CO2培养箱中培养6 h后用PBS洗去转染试剂,换成正常培养基继续培养。实验分组:(1)control组:转染重组质粒pRS-scrambled的MDA-MB-231细胞;(2)shJAG1组:转染重组质粒pRS-JAG1的MDA-MB-231细胞。
2.3 MTT检测细胞增殖取对数生长期细胞,调成密度为5×107/L的细胞悬液,每孔200 μL接种于96孔板,同时设空白对照孔。分别在1 d、2 d、3 d和4 d后,每孔加入20 μL MTT溶液(5 g/L),37℃培养4 h后,每孔加入150 μL DMSO,振荡10 min溶解结晶,酶标仪检测490 nm波长吸光度A值。每组设5个复孔,实验重复3次。
2.4 流式细胞术检测细胞凋亡重组质粒转染72 h后,制备各实验组细胞悬液,用PBS洗涤细胞2次,取约5×105个细胞重悬于200 μL 1×binding buffer,加入10 μL Annexin V-FITC和5 μL PI,轻轻混匀,避光室温反应15 min,加入300 μL 1×binding buffer,流式细胞术检测细胞凋亡。
2.5 流式细胞术检测细胞周期重组质粒转染72 h后,制备各实验组细胞悬液,用冷PBS洗涤细胞2次,加入1 mL 70%冰乙醇于4℃固定24 h,离心去除乙醇,再用冷PBS洗涤细胞2次,加入1 mL PI溶液(50 mg/L),4℃避光染色30 min,流式细胞术检测。
2.6 Western blotting检测蛋白水平重组质粒转染72 h后,裂解各组细胞提取总蛋白,用BCA法定量后,进行SDS-PAGE电泳并转移至PVDF膜。封闭液(5%BSA/TBST)封闭1 h,加入Ⅰ抗(1∶1 000稀释),4℃孵育过夜,TBST洗膜3次,加入Ⅱ抗(1∶1 000稀释)室温下孵育1 h,TBST洗膜3次,加入ECL进行发光反应,压片、显影、定影,观察蛋白印记,运用ImageJ软件测定各蛋白条带灰度值。
3 统计学处理
用SPSS 16.0统计软件分析。数据用均数±标准差(mean±SD)表示,组间均数比较采用t检验或单因素方差分析,以P<0.05为差异有统计学意义。
结果
1 特异性shRNA抑制MDA-MB-231细胞JAG1蛋白表达
Western blotting结果显示,MDA-MB-231细胞在转染重组质粒pRS-JAG1后的1~3 d,JAG1/β-actin灰度比分别为0.0820±0.0437、0.0517±0.0216和0.0323±0.0114,均显著低于control组(P<0.05),见图1。
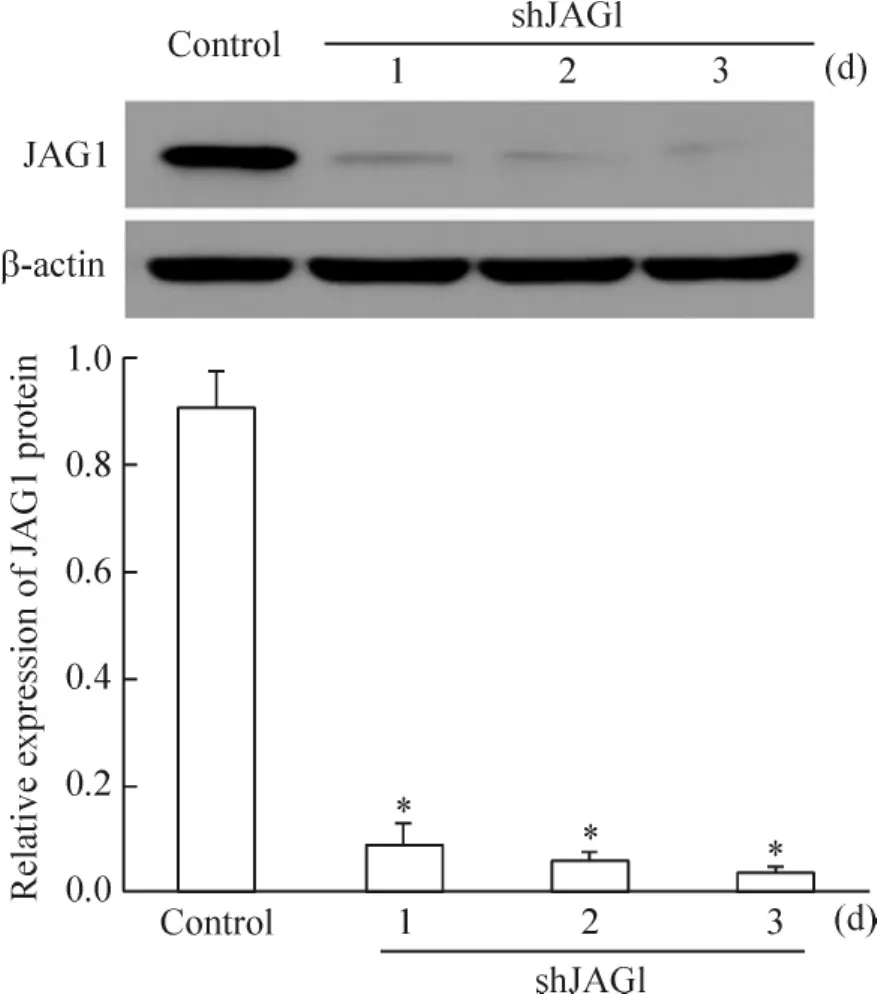
Figure 1.Expression of JAG1 protein in human breast cancer MDA-MB-231 cells after pRS-scrambled/pRS-JAG1 transfection.Mean±SD.n=3.*P<0.05 vs control group.图1 pRS-scrambled/pRS-JAG1转染MDA-MB-231细胞后JAG1蛋白表达
2 沉默JAG1抑制MDA-MB-231细胞生长
用MTT法检测1~3 d细胞的生长状况,发现转染重组质粒pRS-JAG1的细胞生长减慢,第3天A值显著低于control组(P<0.05),见图2。
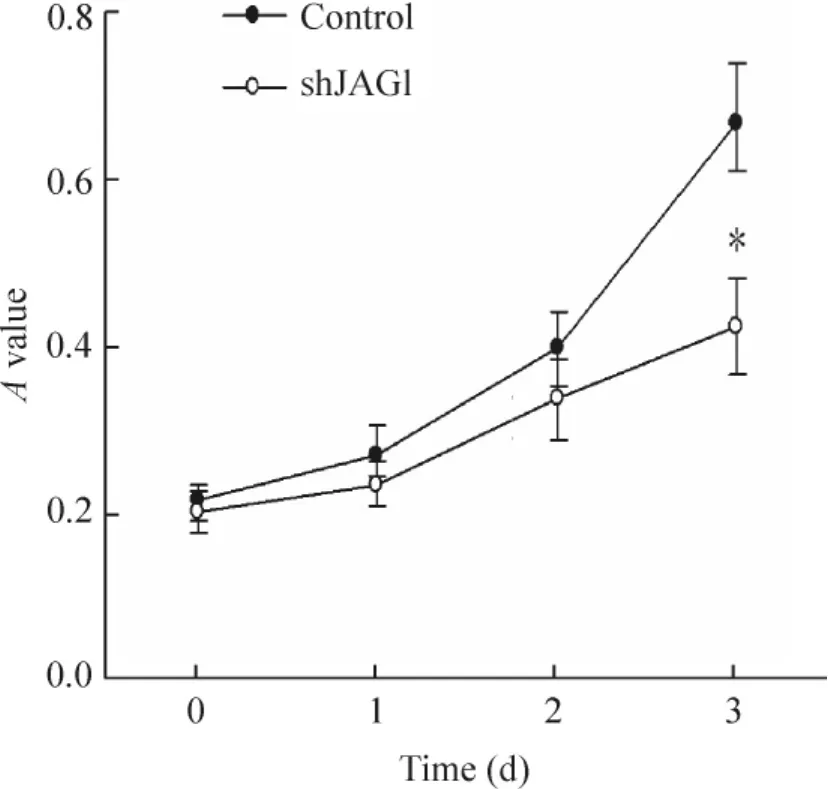
Figure 2.Effect of JAG1 silencing on the growth of MDA-MB-231 cells detected by MTT assay.Mean±SD.n= 5.*P<0.05 vs control group.图2 MTT法检测沉默JAG1对MDA-MB-231细胞生长的影响
3 沉默JAG1对MDA-MB-231细胞周期的影响
流式细胞术结果显示,shJAG1组G0/G1期细胞比例为(80.47%±2.02)%,显著高于control组(P<0.05),S期和G2/M细胞比例分别为(8.51% ±1.15)%和(11.01%±0.88)%,均显著低于control组(P<0.05),见图3。

Figure 3.Effect of JAG1 silencing on cell cycle of MDA-MB-231 cells detected by flow cytometry.Mean±SD.n=3.*P<0.05 vs control group.图3 流式细胞术检测沉默JAG1对MDA-MB-231细胞周期的影响
4 沉默JAG1对MDA-MB-231细胞凋亡的影响
流式细胞术结果显示,shJAG1组MDA-MB-231细胞凋亡率为(17.45%±2.21)%,显著高于control 组(P<0.05),见图4。
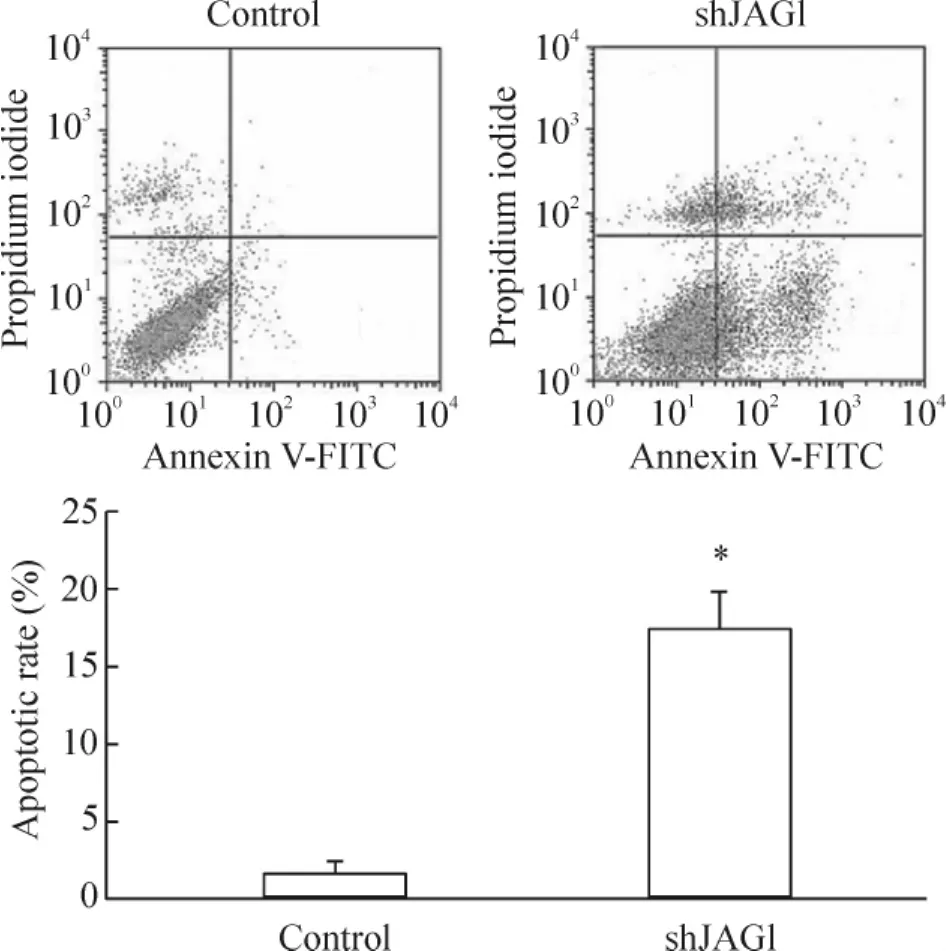
Figure 4.Effect of JAG1 silencing on apoptosis of MDA-MB-231 cells detected by flow cytometry.Mean±SD.n=3.*P<0.05 vs control group.图4 流式细胞术检测沉默JAG1对MDA-MB-231细胞凋亡的影响
5 沉默JAG1对cyclin D1、p21CIP1/WAF1、p27KIP1和p-Rb蛋白水平的影响
shJAG1组p21CIP1/WAF1/β-actin和p27KIP1/β-actin的灰度比分别为0.5396±0.0516和0.8092± 0.0762,均显著高于control组(P<0.05),而cyclin D1/β-actin和p-Rb/β-actin的灰度比分别为0.2801 ±0.0309和0.4439±0.0472,均显著低于control组(P<0.05),见图5。

Figure 5.Effects of JAG1 silencing on the protein levels of cyclin D1,p21CIP1/WAF1,p27KIP1and p-Rb in MDA-MB-231 cells.Mean± SD.n=3.*P<0.05 vs control group.图5 沉默JAG1对cyclin D1、p21CIP1/WAF1、p27KIP1和p-Rb蛋白水平的影响
6 沉默JAG1对Bcl-2、Bax、Bcl-xL和cleaved caspase-3蛋白水平的影响
shJAG1组Bcl-2/β-actin和Bcl-xL/β-actin的灰度比分别为0.3434±0.0325和0.4041±0.0527,均显著低于control组(P<0.05),而Bax/β-actin和cleaved caspase-3/β-actin的灰度比分别为0.7790± 0.0623和0.7994±0.0887,均显著高于control组(P<0.05),见图6。

Figure 6.Effects of JAG1 silencing on phosphorylation of Bcl-2,Bax,Bcl-xL and cleaved caspase-3 in MDA-MB-231 cells.Mean± SD.n=3.*P<0.05 vs control group.图6 沉默JAG1对Bcl-2、bax、Bcl-xL和cleaved caspase-3蛋白水平的影响
讨论
三阴乳腺癌(triple-negative breast cancer,TNBC)是以雌激素受体α(estrogen receptorα,ERα)、孕酮受体2(progesterone receptor 2,PR)和人表皮生长因子受体(human epidermal growth factor receptor,HER-2)均不表达为特点的乳腺癌细胞[11],占所有乳腺癌细胞的10%~15%[12-14],由于缺乏针对这些受体的有效治疗靶点,无法采用内分泌治疗和曲妥单抗治疗,导致预后较差[15]。于是化疗就成为治疗此类乳腺癌的主要方法,但存在疗效不稳定,副作用大以及多药耐药等问题,因此,急需找到针对TNBC的有效的分子治疗靶点。
Notch信号通路与TNBC关系密切[16],以Notch信号通路为靶向的γ分泌酶抑制剂(γ secretase inhibitors,GSI)将有可能改善TNBC患者的预后,但其所带来的各种副作用会限制GSI的使用[17]。本研究选取人乳腺癌MDA-MB-231细胞作为TNBC的代表,以Notch配体JAG1为靶点,采用shRAN干扰技术沉默JAG1,发现沉默JAG1可有效抑制MDA-MB-231细胞生长。
细胞生长是细胞增殖和细胞凋亡相互协调的结果,而细胞增殖是通过细胞周期来完成的。细胞周期是多因子参与的高度精确和有组织的时序调控过程。细胞周期素、细胞周期素依赖性激酶(cyclin-dependent kinases,CDKs)和细胞周期素依赖性激酶抑制剂(cyclin-dependent kinase inhibitors,CDKIs)是细胞周期调控中的关键组分。细胞周期素D1(cyclin D1)和细胞周期素E(cyclin E)属细胞周期素家族成员,可分别与CDK4和CDK2结合并激活其活性,调控细胞由G1期至S期的转变。视网膜母细胞瘤蛋白(retinoblastoma protein,Rb)是cyclin D/CDK4和cyclin E/CDK2激酶的一种重要底物。高度磷酸化的Rb与E2F转录因子解离,使E2F得以活化,从而激活一系列下游事件,其中包括DNA的复制,使细胞从G1期进入S期。p27KIP1和p21CIP1/WAF1等是CDKIs中的重要成员,可与G1期激酶复合物如cyclin D/CDK4和cyclin E/CDK2等紧密结合,抑制这些激酶复合物对Rb的磷酸化,阻止细胞从G1期进入S期。
本研究发现,沉默JAG1可显著抑制人乳腺癌MDA-MB-231细胞cyclin D1的表达,同时促进人乳腺癌MDA-MB-231细胞p21CIP1/WAF1和p27KIP1蛋白表达,从而抑制Rb磷酸化,进而阻止人乳腺癌MDAMB-231细胞从G1期进入S期。
在细胞凋亡过程中,Bcl-2家族成员起着至关重要的作用。Bcl-2家族可以分为两大类,一类是抗凋亡的,主要有Bcl-2、Bcl-xL、Bcl-w、Mcl-1等,另一类是促细胞死亡的,主要包括Bax、Bak、Bad、Bid等。本研究发现,沉默JAG1可显著下调人乳腺癌MDAMB-231细胞Bcl-2和Bcl-xL蛋白表达,上调Bax蛋白表达。Bax可插入线粒体外膜并寡聚成孔道,也可与线粒体外膜中的电压依赖性阴离子通道(voltagedependent anion channel,VDAC)结合引起线粒体通透性转变孔(mitochondrial permeability transition pore,MPTP)的持续开放,进而引起线粒体外膜通透化(mitochondrial outer membrane permeabilization,MOMP)和线粒体膜电位消散,释放线粒体膜间腔中的促凋亡蛋白,激活半胱氨酸天冬氨酸蛋白酶(caspase),最终导致细胞凋亡[18-19]。
综上所诉,由于Notch1和Notch2在人乳腺癌MDA-MB-231细胞发挥着相反的作用[9,20],高表达的Notch配体JAG1可能通过与Notch1结合,促进MDA-MB-231细胞增殖并抑制细胞凋亡。因此,JAG1-Notch1信号通路有望成为针对TNBC的有效的分子治疗靶点。
[1]DeSantis C,Siegel R,Bandi P,et al.Breast cancer statistics,2011[J].CA Cancer J Clin,2011,61(6):409-418.
[2]Fernandez-Valdivia R,Takeuchi H,Samarghandi A,et al.Regulation of mammalian Notch signaling and embryonic development by the protein O-glucosyltransferase Rumi[J].Development,2011,138(10):1925-1934.
[3]Gianni-Barrera R,Trani M,Reginato S,et al.To sprout or to split?VEGF,Notch and vascular morphogenesis[J].Biochem Soc Trans,2011,39(6):1644-1648.
[4]Yalcin-Ozuysal Ö,Fiche M,Guitierrez M,et al.Antagonistic roles of Notch and p63 in controlling mammary epithelial cell fates[J].Cell Death Differ,2010,17(10): 1600-1612.
[5]Monahan P,Rybak S,Raetzman LT.The Notch target gene Hes1 regulates cell cycle inhibitor expression in the developing pituitary[J].Endocrinology,2009,150(9): 4386-4394.
[6]Garcia A,Kandel JJ.Notch:a key regulator of tumor angiogenesis and metastasis[J].Histol Histopathol,2012,27(2):151-156.
[7]Wang Z,Li Y,Banerjee S,et al.Down-regulation of Notch-1 and Jagged-1 inhibits prostate cancer cell growth,migration and invasion,and induces apoptosis via inactivation of Akt,mTOR,and NF-kappaB signaling pathways [J].J Cell Biochem,2010,109(4):726-736.
[8]Chen J,Imanaka N,Chen J,et al.Hypoxia potentiates Notch signaling in breast cancer leading to decreased E-cadherin expression and increased cell migration and invasion[J].Br J Cancer,2010,102(2):351-360.
[9]O'Neill CF,Urs S,Cinelli C,et al.Notch2 signaling induces apoptosis and inhibits human MDA-MB-231 xenograft growth[J].Am J Pathol,2007,171(3):1023-1036.
[10]袁磊,陈旭东,范文娟,等.沉默Notch1基因促进人乳腺癌MCF-7细胞JNK1和p53磷酸化[J].中国病理生理杂志,2013,29(6):1014-1020.
[11]S∅rlie T,Perou CM,Tibshirani R,et al.Gene expressionpatterns of breast carcinomas distinguish tumor subclasses with clinical implications[J].Proc Natl Acad Sci U S A,2001,98(19):10869-10874.
[12]Carey L,Winer E,Viale G,et al.Triple-negative breast cancer:disease entity or title of convenience[J].Nat Rev Clin Oncol,2010,7(12):683-692.
[13]Dent R,Trudeau M,Pritchard KI,et al.Triple-negative breast cancer:clinical features and patterns of recurrence [J].Clin Cancer Res,2007,13(15 Pt 1):4429-4434.
[14]Rakha EA,El-Sayed ME,Green AR,et al.Prognostic markers in triple-negative breast cancer[J].Cancer,2007,109(1):25-32.
[15]van't Veer LJ,Dai H,van de Vijver MJ,et al.Gene expression profiling predicts clinical outcome of breast cancer [J].Nature,2002,415(6871):530-536.
[16]Speiser J,Foreman K,Drinka E,et al.Notch-1 and Notch-4 biomarker expression in triple-negative breast cancer[J].Int J Surg Pathol,2012,20(2):139-145.
[17]Shih IeM,Wang TL.Notch signaling,gamma-secretase inhibitors,and cancer therapy[J].Cancer Res,2007,67 (5):1879-1882.
[18]Chipuk JE,Moldoveanu T,Llambi F,et al.The BCL-2 family reunion[J].Mol Cell,2010,37(3):299-310.
[19]Whelan RS,Konstantinidis K,Wei AC,et al.Bax regulates primary necrosis through mitochondrial dynamics[J].Proc Natl Acad Sci U S A,2012,109(17):6566-6571.
[20]Zang S,Chen F,Dai J,et al.RNAi-mediated knockdown of Notch-1 leads to cell growth inhibition and enhanced chemosensitivity in human breast cancer[J].Oncol Rep,2010,23(4): 893-899.
Effects of JAG1 gene silencing on proliferation and apoptosis of human breast cancer MDA-MB-231 cells
YUAN Lei,LI Bo-he,SHI Ran-ran,GAO Li,SONG Jin-ling,WANG Jian-guo
(Laboratory of Molecular Biology,Luohe Medical College,Luohe 462002,China.E-mail:wr0395@sina.com)
AIM:To investigate the effects of Jagged 1(JAG1)gene silencing on the proliferation and apoptosis of human breast cancer MDA-MB-231 cells.METHODS:The specific recombinant vector pRS-JAG1 was transfected into MDA-MB-231 cells with lipofectamine.The protein expression of JAG1 was observed by Western blotting after transfection.MTT assay was used to detect the effect of JAG1 gene silencing on the growth of the cells.The apoptosis and cell cycle were analyzed by flow cytometry.The protein levels of cyclin D1,p21CIP1/WAF1,p27KIP1,p-Rb,Bcl-2,Bax,Bcl-xL and cleaved caspase-3 were determined by Western blotting.RESULTS:Compared with control group,the expression level of JAG1 was reduced by pRS-JAG1 transfection for 72 h(P<0.05).The growth of MDA-MB-231 cells in shJAG1 group was significantly inhibited(P<0.05).The percentages of G0/G1-phase cells and early apoptotic rate were obviously higher in shJAG1 group than those in control group(P<0.05).The shRNA-mediated JAG1 silencing decreased the protein levels of cyclin D1,p-Rb,Bcl-2 and Bax,and increased the protein levels of p21CIP1/WAF1,p27KIP1,Bax and cleaved caspase-3(P<0.05).CONCLUSION:JAG1 silencing effectively inhibits the proliferation and induces the apoptosis of human breast cancer cells,suggesting that JAG1 might serve as a therapeutic target for triple-negative breast cancer.
JAG1 protein;Short hairpin RNA;Cell cycle;Apoptosis;MDA-MB-231 cells
R737.9
A
10.3969/j.issn.1000-4718.2014.02.012
1000-4718(2014)02-0262-06
2013-10-31
2013-12-20
河南省基础与前沿技术研究计划项目(No.122300410277);漯河医学高等专科学校科研基金资助项目(No.2010-S10)
△通讯作者Tel:0395-2112681;E-mail:wr0395@sina.com

