KIR基因多态性影响肾移植受者微量巨细胞病毒和BK病毒DNA的研究*
吴琦,陈孝倩,王天阳,陈景锋,潘晓东,吴存造,夏鹏,陈必成△,杨亦荣△
(1温州医科大学附属第一医院器官移植中心,浙江温州 325000;2丽水市人民医院泌尿外科,浙江丽水 323000)
KIR基因多态性影响肾移植受者微量巨细胞病毒和BK病毒DNA的研究*
吴琦1,2,陈孝倩1,王天阳1,陈景锋1,潘晓东1,吴存造1,夏鹏1,陈必成1△,杨亦荣1△
(1温州医科大学附属第一医院器官移植中心,浙江温州 325000;2丽水市人民医院泌尿外科,浙江丽水 323000)
目的:探讨肾移植受者杀伤细胞免疫球蛋白样受体(KIR)基因多态性对肾移植术后微量巨细胞病毒(CMV)和BK病毒(BKV)DNA的影响。方法:采用序列特异性引物聚合酶链反应(PCR-SSP)法检测48例肾移植受者KIR基因多态性。依照不同功能的KIR单倍体,将KIR基因组合型分为抑制型KIR基因组合型(AA型)和非抑制型KIR基因组合型(BX型,包括BB型和AA型)。采用实时荧光定量PCR法检测肾移植术的受者血清DNA中CMV和BKV的载量。分析AA和BX KIR基因型对肾移植术后1年内CMV和BKV DNA血症累积阳性率及血肌酐的影响。结果:不同KIR基因型间,免疫抑制剂浓度无明显差异(P>0.05)。相较KIR-BX基因型,KIRAA基因型的BKV累积阳性率明显增加(P<0.05);而KIR两型间,CMV病毒血症的发生率没有明显差异(P>0.05)。KIR-AA型术后1~12月平均血肌酐水平较BX型低,差别有统计学意义(P<0.05);经3年随访,KIR-AA型受者血肌酐水平低于BX型(P<0.05),而2组间血尿素氮和尿酸水平无统计学意义。结论:KIR-AA基因型肾移植受者术后1年内BKV DNA血症增加,而不影响CMV DNA血症。
杀伤细胞免疫球蛋白样受体;基因多态性;肾移植;巨细胞病毒;BK病毒
杀伤细胞免疫球蛋白样受体(killer cell immunoglobin-like receptor,KIR)是一类存在于自然杀伤细胞(natural killer cell,NK)和某些T细胞表面上,其进化快速并呈高度多态性的受体家族[1]。KIR特异性识别人白细胞抗原I类分子(human leukocyte antigen class I antigen,HLA-I),进而调节NK细胞的活性。已发表少量文献认为KIR在移植后病人潜伏病毒的再次感染中起重要作用。巨细胞病毒(cytomegalovirus,CMV)与BK病毒(BK virus,BKV)是在正常人以潜伏感染存在、但对肾移植受者预后有重要影响的DNA病毒。免疫抑制不足可以导致移植物排斥反应的发生,而免疫抑制过度却会导致CMV和BKV再感染或复燃。条件感染病毒其活跃状态与个体免疫状态密切相关,不同个体的遗传背景对免疫抑制治疗反应不同。为深入了解个体化医疗在免疫抑制治疗与病毒感染关系中的意义,我们探讨了KIR基因多态性对CMV-BKV感染的影响。
材料和方法
1 实验对象
48例于2009年12月~2010年6月间在温州医科大学附属第一医院本院行尸体肾移植术的受者,在肾移植术后10 d起至术后3个月均口服万赛维片(缬更昔洛韦片,上海罗氏制药),剂量为900 mg (qd),未有因出现急性排斥反应、肝功能受损及其它药物副作用而停药的受者,服药依从性佳,CMV-pp65检测结果均为阴性,以他克莫司(tacrolimus, FK506)、吗替麦考酚酯(mycophenolate mofetil,MMF)和甲基强的松龙(methylprednisolone,MP)为主要免疫抑制方案,随访时间1年,均未发生急性排斥反应。其中男35例,女13例,平均年龄(42.30± 10.17)岁,性别差异无统计学意义(P>0.05),共采集血液标本数257份,予实时定量PCR(real-time PCR)检测CMV-BKV的DNA拷贝以及KIR基因多态性。
2 方法
2.1 基因组DNA提取抽取患者外周血2 mL,用EDTA·K2抗凝,采用核酸提取试剂盒提取外周血总DNA(上海飞捷公司),并将提取的DNA置于-20℃保存,备用。
2.2 KIR基因检测采用KIR基因分型检测试剂盒(天津秀鹏公司)提供的序列特异性引物聚合酶链式反应(PCR with sequence-specific primers,PCR-SSP)方法进行基因分型。本实验检测的KIR基因包括KIR2DL1~5、2DS1~5、3DL1~3、3DS1、3DP1和2DP1。根据GenBank的16个KIR基因序列设计上、下游引物,并行BLAST验证。根据人类生长激素基因的保守片段设计内参照引物进行扩增。取试剂盒配套浓缩Buffer 70 μL,加去离子水90 μL,Taq DNA酶6U和10 mL DNA。再向16个孔中各加入10 μL上述混合液。PCR反应条件:96℃2 min;96 ℃20 s,62℃60 s,72℃45 s,35个循环;72℃5 min。PCR产物用2%琼脂糖凝胶电泳进行鉴定,见图1。

Figure 1.Electrophoretogram of PCR product of KIR gene.图1 KIR基因PCR扩增产物电泳图
2.3KIR基因型分型参照WHO-KIR命名委员会2002年的报告[2],将14个KIR功能基因组合划定为抑制型(AA型)和非抑制型(BB和AB型)。抑制型是由多个抑制型KIR基因(2DL1,2DL3~4,3DL1~3)和单个活化型基因(2DS4)组成。非抑制型BB型由上述多个抑制型KIR基因与除2DS4外的多个活化型KIR基因(2DS1~3,2DS5,3DS1)组成;而AB型则由上述多个抑制型KIR基因和含有2DS4的多个活化型KIR基因(2DS1~5,3DS1)组成。此外,可将KIR基因型进行编序,以基因型ID来归纳。KIR基因型ID的判断可通过对照分析国际等位基因网站(http://www.allelefrequencies.net)公布的KIR基因型ID数据。
2.4 Real-time PCR技术同时检测移植患者全血CMV和BKV的DNA载量采用的实时荧光定量试剂盒由本院外科实验室提供,已申请专利(专利号为201010244873.9)[3],选择最为保守性序列作为靶检测序列,上、下游引物和探针由上海基康公司合成。Real-time PCR最适反应体系(10 μL):25 mmol/L MgCl21.5 μL,10 μmol/L上、下游引物以及探针混合液1.0 μL,25 mmol/L dNTP的混合液0.2 μL,10×EasyTaq缓冲液1.2 μL,5×106U/L EasyTaq DNA聚合酶0.2 μL,DNA模板1.0 μL。最佳反应条件为:95℃2 min,95℃10 s,62℃40 s,共45个循环,荧光值在62℃检测。通过荧光定量PCR仪的分析软件,记录不同标准品的Ct值并绘制标准曲线,通过标准曲线计算各样本的CMV和BKV的DNA拷贝数。根据试剂盒说明书,将BKV或CMV病毒载量大于1×106copies/L定义为阳性结果。
3 统计学处理
使用SPSS 13.0软件分析,服从正态分布的计量资料数据以均数±标准差(mean±SD)表示,采用Kaplan-Meier法估计累积风险函数及log-rank检验分析CMV和BKV DNA血症肾移植术后1年内的累积阳性率在不同KIR基因型中的差异,以P<0.05为差异有统计学意义。
结果
1 免疫抑制药物浓度检测结果
受者移植术后的免疫抑制强度是影响条件性病原体感染的最主要因素,而移植术后第1年的免疫抑制剂用量最大。对同个肾移植受者1~12月的平均FK506药物浓度比较后发现,2组受者药物浓度差异并无统计学意义:AA型FK506平均浓度为(6.071±1.113)μg/L和BX型(包括AB和BB亚型)PK506平均浓度为(6.444±1.050)μg/L。
2 CMV-BKV检测结果
在48例肾移植受者中,根据KIR基因组合型分为AA型和BX型,其中AA型17例,BX型31例,48例受者中共涉及257份血液标本。CMV和BKV DNA阳性结果见表1。肾移植术后1年内CMV和BKV出现病毒血症的累积阳性率分别为40.1%和11.3%,见表2。
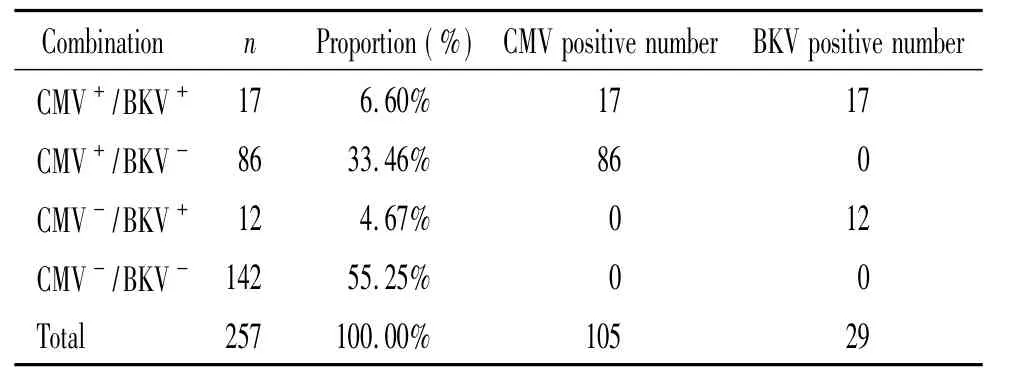
表1257 份肾移植受者CMV-BKV阳性结果Table 1.CMV-BKV DNA results of 257 blood samples from transplant recipients

表2 不同KIR基因型肾移植术后1年内累积CMV-BKV阳性数(率)Table 2.The cumulative positive incidence of CMV-BK DNA in the first year after renal transplantation
3 KIR基因型与CMV-BKV累积阳性率
肾移植术后病毒血症发生有波动性,单一时点病毒血症阳性率进行比较容易产生偏倚。因此以肾移植术后1年内患者血清中出现病毒DNA复制作为事件,采用Kaplan-Meier法来分析不同的KIR基因型对CMV-BKV病毒血症发生率的影响,并采用log-rank检验2组差异。本实验中,不同KIR基因型对CMV病毒血症的发生无明显差异(P>0.05),而BX型BKV累积阳性率低于AA型,差异有统计学意义(P<0.05);见图2、3。
4 肾功能检测结果
48例肾移植受者肾移植术后1年内与3年内随访手册所记录的肾功能数据,包括血尿素氮、肌酐和尿酸,比较1~12月平均值,不同KIR基因型比较后发现,AA型术后1~12月平均血肌酐水平较BX型低,差异有统计学意义(P<0.05),而血尿素氮和尿酸水平2组间差异无统计学意义。在移植后第3年,比较2组受者的血肌酐平均值,不同KIR基因型间存在显著的差别,AA型术后3年平均血肌酐水平较BX型低,差异有统计学意义(P<0.05),而血尿素氮和尿酸水平2组间差异无统计学意义,见表3。
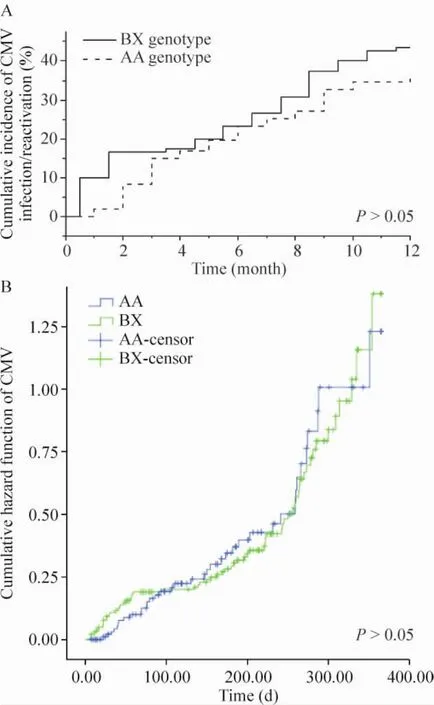
Figure 2.The scatter diagram(A)and hazard function(B)of the cumulative positive incidence of CMV DNA of different KIR genotypes.图2 KIR基因型与CMV DNA累积阳性率散点图及危险函数
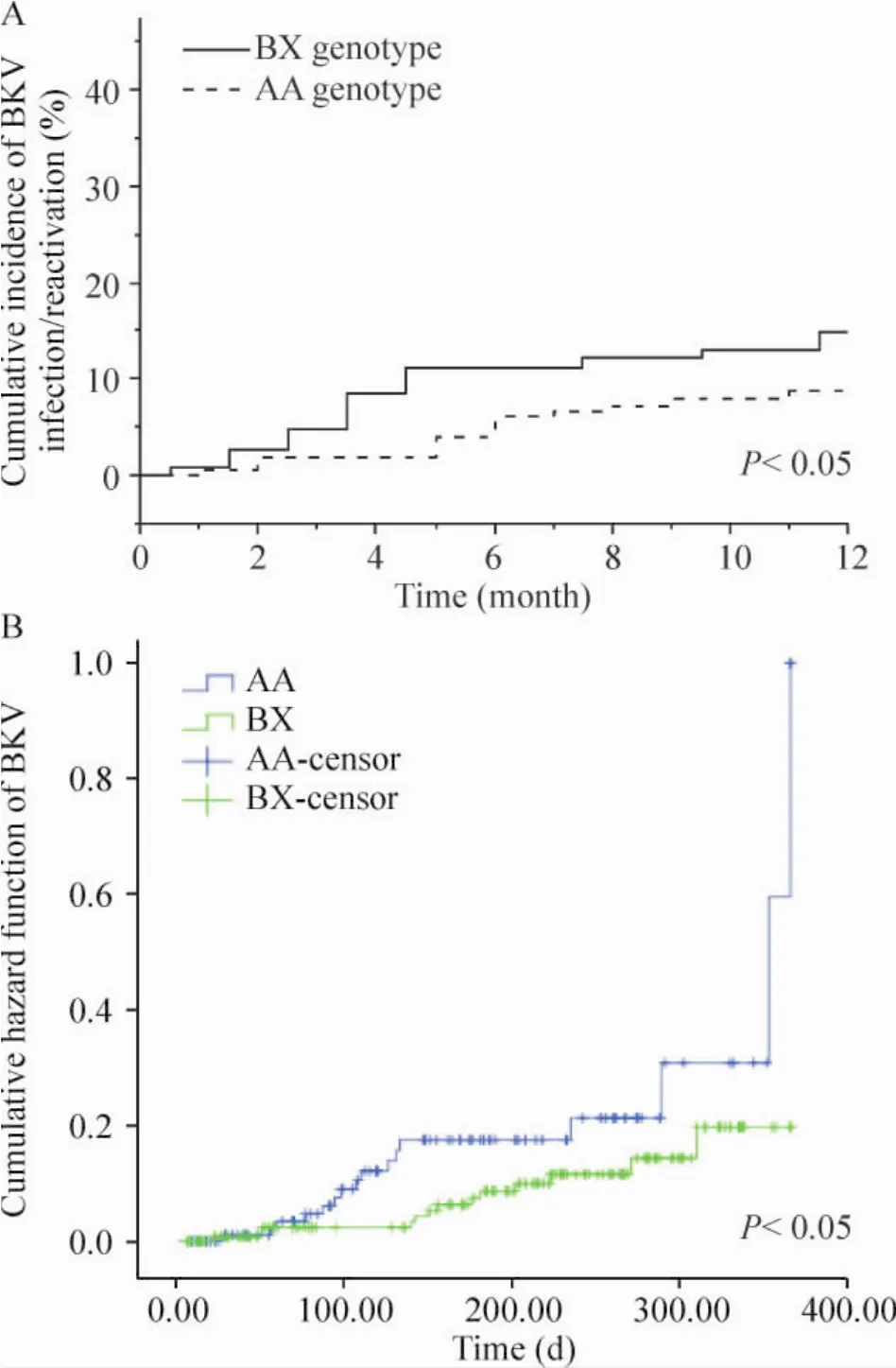
Figure 3.The scatter diagram(A)and hazard function(B)of the cumulative positive incidence of BK DNA of different KIR genotypes.图3 KIR基因型与BKV DNA累积阳性率散点图及危险函数
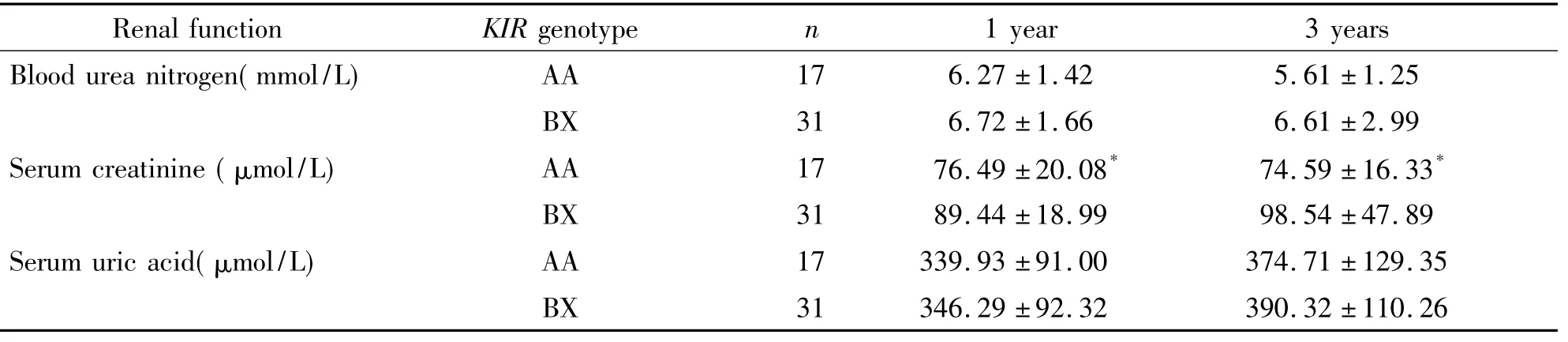
表3 KIR基因型与肾移植术后1年和3年内肾功能指标的比较Table 3.Parameters of renal function in the first year and three years after renal transplantation(Mean±SD)
讨论
巨细胞病毒和BK病毒在初次感染产生免疫应答后,处于潜伏状态,健康人群外周血中无微量病毒DNA复制。个体的免疫状态是决定复燃的主要因素[4],肾移植术后由于难以评估免疫状态,常因免疫抑制剂的过度应用,导致免疫功能过度下降,继而引发潜伏病毒的DNA复制,引起严重的感染,危及移植肾功能及肾移植受者生命。CMV是导致肾移植受者死亡和移植肾失功的主要病原体之一,而多瘤病毒属的BKV病毒因其泌尿系毒性和易致BKV肾病造成移植肾失功。
我们前期发现某些低免疫抑制个人也会发现微量CMV-DNA,可见个体的遗传背景影响免疫抑制状态。细胞因子可显著影响免疫功能,但肿瘤坏死因子α(tumor necrosis factor α,TNF-α)和白细胞介素2 (interleukin-2,IL-2)、IL-10、IL-12多态性均未发现与CMV感染有关[5-6]。免疫细胞中,NK细胞不需预先致敏就能对病毒感染细胞发挥直接杀伤作用,这一反应虽然快速但其中涉及的调节机制非常复杂。KIR作为NK细胞上重要的受体之一,是机体抗病毒的重要因素[7-8],针对其调控的方式有NK细胞杀伤功能发挥的“missing-self”假说[9]和自身细胞耐受NK细胞杀伤的“licensing”假说[10]。NK细胞的杀伤功能通过KIR的抑制性和活化性信号的平衡来实现,根据假说推定:越多的KIR活化性基因,更有利于对病毒感染的细胞产生杀伤作用。因此本实验将KIR基因型分为抑制性KIR-AA基因型和非抑制性KIR-BX型,分析不同KIR型别是否影响肾移植受者外周血出现CMV/BKV微量DNA[11]。
由于CMV和BKV感染早期缺乏特异性,临床常用CMV-pp65和CMV-DNA检测作为早期诊断的指标,而实时荧光定量PCR检测病毒微量DNA更易进行定量检测。高拷贝血浆CMV-DNA载量与CMV发病有关,血浆中BKV-DNA载量和BKV肾病的损害程度密切相关[12],我们采用同时检测血液中此2种病毒DNA载量来评价受者免疫抑制状态。基于荧光定量PCR的高敏感性,为了进一步减少实验干扰因素,我们纳入术前CMV-pp65检测阴性的肾移植受者,并筛除发生急性排斥反应的受者,所有实验对象均采用FK506+MMF+MP免疫抑制方案,且采用肾移植术后1年内累积感染率来研究KIR基因和CMV-BKV DNA病毒载量动态变化的关系,我们研究发现了KIR-BX基因型在肾移植术后BKV感染中存在“剂量依赖”式的作用,即拥有越多的活化KIR基因的受者,其移植术后发生BKV感染的可能性越低,此前国外关于KIR和BKV的研究未发现两者有明显相关,这可能和样本数量和实验设计方面差异有关。
KIR与CMV的初期研究主要集中在造血干细胞移植中,Gallez-Hawkins等[13]发现CMV的感染率和KIR2DS2和2DS4基因表达相关。近年来在肾移植领域,类似研究逐渐成为热点,CMV和KIR基因的研究中发现活性化KIR基因的数量和肾移植术后CMV感染和复燃发生率负相关[14-15],Stern等[16]关于KIR基因与着丝粒位置的进一步研究也发现,着丝粒近端的KIR活化基因比着丝粒远端的活化性KIR基因与CMV病毒血症发生的关系更为密切,这些都为本实验奠定了基础,但在本实验中血CMVDNA的出现与KIR基因无明显相关,原因可能与前3个月采用了CMV预防性治疗、样本量较少及本中心免疫抑制药物用量较少有关。
KIR基因在慢性肾衰竭尿毒症的发生和发展过程中的报道尚少,其具体机制也尚未明确。国内外研究表明,HLA配体结合KIR受体对NK细胞的调节,推测在终末期肾病的病理生理过程中可能起到一定的作用,但单纯从KIR基因多态性角度分析并未发现相关性[17]。在肾移植后,当受者有较多的活化型KIR与供者的HLA-I类分子相匹配时,相对于抑制性KIR受者的NK细胞对供肾的杀伤作用更强,导致术后发生急性排斥反应的概率增加[18]。本研究对未出现急性排斥反应的受者进行研究也发现,随访1年AA型(抑制型)受者的血肌酐浓度低于BX型受者。随访3年也得出相同结果。此研究证实虽然KIR抑制型受者外周血更易出现微量BK病毒DNA,但并不显著影响移植肾的的功能,反而可能因较弱的NK细胞作用而对移植肾有保护作用。
总而言之,我们的实验发现了KIR-BX基因型对肾移植术后1年内BKV病毒的感染发生率呈负相关,此结果与Trydzenskaya等[19]报道一致。支持了KIR作为遗传背景之一影响了抗病毒免疫[20],提示KIR-AA基因型受者需加强病毒检测及相对减弱免疫抑制治疗强度。同时,KIR-BX受者具较弱的NK细胞排斥反应可能使这些受者获益。
[1]Khakoo SI,Rajalingam R,Shum BP,et al.Rapid evolution of NK cell receptor systems demonstrated by comparison of chimpanzees and humans[J].Immunity,2000,12 (6):687-698.
[2]Marsh SG,Parham P,Dupont B,et al.Killer-cell immunoglobulin-like receptor(KIR)nomenclature report,2002 [J].Hum Immunol,2003,64(6):648-654.
[3]张纯武,陈孝倩,白永恒,等.同时检测人多瘤病毒和巨细胞病毒PCR技术的建立及在肾移植受者中的初步应用[J].病毒学报,2013,29(4):410-414.
[4]Navalpotro D,Gimeno C,Navarro D.PCR detection of viral DNA in serum as an ancillary analysis for the diagnosis of acute mononucleosis-like syndrome due to human cytomega-lovirus(HCMV)in immunocompetent patients[J].J Clin Virol,2006,35(2):193-196.
[5]王晓红,郭红梅,朱启镕.肿瘤坏死因子-α和干扰素-γ多态性与婴儿巨细胞病毒肝炎的关系[J].实用儿科临床杂志,2006,21(7):408-409.
[6]傅晶,郑建建,潘晓东,等.器官移植受者微量CMV DNA与IL-10基因单核苷酸多态性的相关性研究[J].浙江临床医学,2008,10(4):443-444.
[7]Martin MP,Gao X,Lee JH,et al.Epistatic interactionbetween KIR3DS1 and HLA-B delays the progression to AIDS[J].Nat Genet,2002,31(4):429-434.
[8]Lu Z,Jiao Y,Feng Z,et al.Polymorphisms of killer cell immunoglobulin-like receptor gene:possible association with susceptibility to or clearance of hepatitis B virus infection in Chinese Han population[J].Croat Med J,2007,48(6):800-806.
[9]Kärre K,Ljunggren HG,Piontek G,et al.Selective rejection of H-2-deficient lymphoma variants suggests alternative immune defence strategy[J].Nature,1986,319 (6055):675-678.
[10]Yokoyama WM,Kim S.How do natural killer cells find self to achieve tolerance?[J].Immunity,2006,24(3): 249-257.
[11]Hsu KC,Chida S,Geraghty DE,et al.The killer cell immunoglobulin-like receptor(KIR)genomic region:geneorder,haplotypes and allelic polymorphism[J].Immunol Rev,2002,190(1):40-52.
[12]Nickeleit V,Klimkait T,Binet IF,et al.Testing for polyomavirus type BK DNA in plasma to identify renal-allograft recipients with viral nephropathy[J].N Engl J Med,2000,342(18):1309-1315.
[13]Gallez-Hawkins GM,Franck AE,Li X,et al.Expression of activating KIR2DS2 and KIR2DS4 genes after hematopoietic cell transplantation:relevance to cytomegalovirus infection[J].Biol Blood Marrow Transplant,2011,17 (11):1662-1672.
[14]Hadaya K,de Rham C,Bandelier C,et al.Natural killer cell receptor repertoire and their ligands,and the risk of CMV infection after kidney transplantation[J].Am J Transplant,2008,8(12):2674-2683.
[15]Stern M,Elsasser H,Hönger G,et al.The number of activating KIR genes inversely correlates with the rate of CMV infection/reactivation in kidney transplant recipients [J].Am J Transplant,2008,8(6):1312-1317.
[16]Stern M,Hadaya K,Hönger G,et al.Telomeric rather than centromeric activating KIR genes protect from cytomegalovirus infection after kidney transplantation[J].Am J Transplant,2011,11(6):1302-1307.
[17]Prakash S,Alam S,Sharma RK,et al.Distribution of Killer cell immunoglobulin like receptor genes in end stage renal disease among North Indian population[J].Hum Immunol,2013,74(10):1339-1345.
[18]Nowak I.Magott-Procelewska M,Kowal A,et al.Killer immunoglobulin-like receptor(KIR)and HLA genotypes affect the outcome of allogeneic kidney transplantation[J].PLoS One,2012.7(9):e44718.
[19]Trydzenskaya H,Juerchott K,Lachmann N,et al.The genetic predisposition of natural killer cell to BK virus-associated nephropathy in renal transplant patients[J].Kidney Int,2013,84(2):359-365.
[20]张彤,曾宪成,方天翎,等.肝癌Bel7402细胞HLA-E基因上调对NK细胞体外杀伤作用的影响[J].中国病理生理杂志,2010,26(11):2081-2085.
Polymorphisms of KIR gene and CMV-BKV DNA quantification in renal transplant recipients
WU Qi1,2,CHEN Xiao-qian1,WANG Tian-yang1,CHEN Jing-feng1,PAN Xiao-dong1,WU Cun-zao1,XIA Peng1,CHEN Bi-cheng1,YANG Yi-rong1
(1Transplantation Centre,The First Affiliated Hospital of Wenzhou Medical University,Wenzhou 325000,China;2Department of Urology,People’s Hospital of Lishui City,Lishui 323000,China.E-mail:chenbicheng@hotmail.com)
AIM:To investigate the association of killer cell immunoglobulin-like receptor(KIR)genotype and cytomegalovirus(CMV)-BK virus(BKV)reactivation/infection in the first year after renal transplantation.METHODS:KIR genotypes were analyzed by PCR with sequence-specific primers(PCR-SSP)in 48 renal transplant recipients and KIR genotypes were grouped into AA if they contained only the canonical group A haplotype genes.The genotype containing additional KIR genes was referred to BX,as it contained at least 1 group B haplotype.Real-time quantitative PCR for CMVBKV DNA was performed to test the viral load.The association of KIR genotype and CMV-BKV infection and the effect of KIR genotype on renal function were analyzed.RESULTS:No obvious difference in the concentration of immunosuppressant and the occurrence of CMV infection/reactivation in the first year after renal transportation was observed between KIRAA and KIR-BX genotype groups.However,there was a significantly negative correlation between KIR-BX genotype and the cumulative incidence of BKV infection/reactivation.The average concentration of serum creatinine over 1~12 months after operation in KIR-AA genotype group was lower than that in KIR-BX genotype group.The levels of blood urea nitrogen and uric acid showed no obvious difference between the 2 groups.CONCLUSION:There is a significantly negative correlation between KIR-BX genotype and the cumulative incidence of BKV infection/reactivation,but not CMV infection/reactivation in the first year after renal transplantation.
Killer cell immunoglobulin-like receptor;Genetic polymorphism;Renal transplantation;Cyto-megalovirus;BK virus
R363
A
10.3969/j.issn.1000-4718.2014.02.019
1000-4718(2014)02-0302-06
2013-10-15
2013-12-30
温州市科技计划(No.H20110019;No.H20100070);浙江省自然科学基金资助项目(No.Y2110944;No.LY12H1004);浙江省教育厅重中之重学科外科学基金资助项目
△通讯作者Tel:0577-55579220;E-mail:chenbicheng@hotmail.com

