丁苯酞可减轻缺氧缺糖条件下血管内皮细胞的线粒体损伤*
解龙昌,张波,高庆春,傅贤,李又福,刘红英,魏欢
(1广州医科大学附属第二医院神经内科,广东广州 510260;2昆明市延安医院,云南昆明 650051)
丁苯酞可减轻缺氧缺糖条件下血管内皮细胞的线粒体损伤*
解龙昌1△,张波1,高庆春1,傅贤1,李又福1,刘红英1,魏欢2
(1广州医科大学附属第二医院神经内科,广东广州 510260;2昆明市延安医院,云南昆明 650051)
目的:探讨丁苯酞(DL-3-n-butylphthalide,NBP)对缺氧缺糖(oxygen-glucose deprivation,OGD)条件下内皮细胞中线粒体的保护作用及相关机制。方法:对人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)予以OGD损伤,使用MitoTracker Green对线粒体进行定位并观察线粒体形态的变化。使用MitoSOX Red标记线粒体内的活性氧簇(reactive oxygen species,ROS),免疫荧光法观察NBP对OGD条件下细胞线粒体内ROS产生的影响。使用SOD活性试剂盒检测NBP对OGD条件下HUVECs内SOD活性的影响。结果:NBP明显减少了OGD诱导后内皮细胞中线粒体的断裂,抑制了线粒体内ROS的生成,提高了OGD诱导后细胞内SOD的活性。结论:NBP可能是通过保护OGD条件下内皮细胞线粒体的功能和增加细胞内ROS清除,减少线粒体内ROS生成,最终减轻了线粒体损伤。
丁苯酞;血管内皮细胞;缺氧缺糖;线粒体;活性氧簇
左旋丁基苯酞又名芹菜甲素,是从芹菜种籽中分离出的有效成分,根据它的结构式,其异构体右旋丁基苯酞被合成出来。之后它们的混合物消旋丁基苯酞(DL-3-n-butylphthalide,NBP)作为临床药物被广泛应用,也称为丁苯酞[1]。
我们前期的研究发现NBP可以增加内皮细胞在缺氧缺糖(oxygen-glucose deprivation,OGD)条件下缺氧诱导因子1α(hypoxia inducible factor 1α,HIF-1α)的表达和在细胞核内的聚集,从而促进下游血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)的表达增多,最终保护内皮细胞免受OGD损伤[2]。NBP对OGD条件下的内皮细胞是否还存在其它保护机制,我们仍不甚清楚。线粒体是细胞内能量生成和储存的主要场所,缺血缺氧后线粒体呼吸链复合酶活性急剧降低,呼吸链电子传递受抑制,可产生大量的氧自由基[3],而继发性氧自由基增加是造成血管内皮细胞和神经元损伤的重要因素。既往研究发现NBP可以抑制黄嘌呤-黄嘌呤氧化酶反应系统中超氧阴离子自由基的形成,还可升高脑皮质总超氧化物歧化酶(superoxide dismutase,SOD)的活性和升高谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)的活性,从而发挥抗自由基的作用[4],但目前仍无相关研究直接观察NBP对OGD条件下线粒体中自由基和线粒体形态的影响。
既往的研究证实NBP有改善线粒体功能失调等作用[5]。我们猜测NBP可能会通过影响OGD条件下内皮细胞线粒体活性氧簇(reactive oxygen species,ROS)的生成,从而保护线粒体,最终达到保护内皮细胞的作用。我们希望通过本实验具体研究NBP对内皮细胞线粒体所产生的保护作用,从而深入探索NBP保护缺血性脑卒中状态下的血管内皮细胞的机制。在未来的研究中以此为基础,对NBP进行改进和发展,使此药能够更加有效和确切地发挥治疗脑卒中的作用。
材料和方法
1 细胞培养和试剂
人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)(购自上海晶赛公司)培养于含10%胎牛血清(Gibco)的高糖DMEM培养基中,置于37℃、90%湿度、含5%CO2和95%空气(V/ V)的培养箱中。
NBP(石家庄恩必普药业有限公司赠送,99.9%)临用前使用DMSO溶解,再使用细胞培养基稀释至所需浓度。NBP的最终浓度采用具有最佳保护作用的10 μmol/L[2]。在溶剂对照组中只单独加入DMSO。
2 OGD细胞模型
OGD模型按照既往发表的方法进行。将内皮细胞种植于各种规格的培养皿,共24 h。在NBP处理组将培养液换成含有不同浓度NBP的无糖DMEM培养液(其中含0.2%DMSO的溶媒),在溶剂处理组换为仅含有0.2%DMSO的无糖DMEM培养液,各培养30 min。之后细胞被放置于持续充以95%N2+ 5%CO2混合气体的密封低氧槽中,根据不同实验所需,在37℃条件下的细胞培养箱中温育所需时间。当OGD结束,在移入正常氧压条件前,将培养液换成含有相同浓度的NBP或者单纯DMSO溶剂的正常培养基。在正常对照组,细胞接受除了无糖培养基或者缺氧处理之外的所有实验操作步骤。
3 检测线粒体内ROS
MitoSOX Red是一种对活细胞线粒体中ROS具有高度选择性的荧光染料,可快速和选择性地被线粒体中的ROS氧化,从而显示出红色荧光,荧光亮度的强弱可代表线粒体内ROS量的多少。MitoTracker Green是一种线粒体绿色荧光染料,其定位于线粒体的能力不受线粒体膜电位影响,可以用来对固定细胞的线粒体进行染色,荧光的位置和形态代表了线粒体所在的位置和形态。本实验中,为进一步确定MitoSOX Red所染色的是线粒体内的ROS,我们使用MitoTracker Green染色线粒体来进行复染定位,如果MitoSOX Red与Mitoraker Green的荧光可以高度重合,就进一步说明我们发现的ROS是存在于线粒体中的。
将已用DMSO溶解的不同浓度的MitoTracker Green和MitoSOX Red各取1 μL,共同溶解到1 mL Hank's液,得到终浓度为1 mmol/L MitoTracker Green溶液和5 mmol/L MitoSOX Red溶液。内皮细胞种植于24孔细胞培养板,完成预处理后,缺氧1 h,用PBS洗涤各孔。加入上述的MitoTracker Green和MitoSOX Red溶液,置于5%CO2细胞培养箱中,37℃条件下温育20 min后,小心吸弃MitoTracker Green 和MitoSOX Red溶液,使用Hanks液清洗3次,在荧光显微镜下拍摄荧光照片(在5 min内拍摄完毕,选择手动曝光,保持各组相同的曝光时间),采用美国Image-Pro Plus图像分析系统进行分析,测定荧光图片的平均吸光度值。
4 线粒体形态分析
为观察线粒体形态的变化,按照方法3中所述的方法,对处理后的内皮细胞进行MitoTracker Green染色,然后在荧光显微镜下拍摄荧光照片(在5 min内拍摄完毕,选择手动曝光,保持各组相同的曝光时间,放大倍数×40)。根据既往报道的研究方法[6],如细胞中显示为融合的长条状线粒体则被标记为“fusion”,如细胞中显示为分散的小而圆形的线粒体占总线粒体的90%以上则被标记为“fission”。为定量分析线粒体的形态,每组随机抽取10幅显微镜拍摄的荧光照片,人工计数标记为“fission”的细胞数,并计算其所占的比例。所有结果来自5次独立实验,每次实验中设3个平行组。
5 SOD活性检测
超氧阴离子自由基可以氧化羟胺形成亚硝酸盐,在显色剂的作用下呈现紫红色。当被测定样品中含有SOD时,则对超氧阴离子自由基有专一性的抑制作用,使形成的亚硝酸盐减少,通过比色法可以测定被测样品具有的SOD活性[7]。具体操作按照试剂盒说明书进行,试剂盒购自南京建成生物工程研究所。
6 统计学处理
数据用均数±标准差(mean±SD)表示。独立样本之间的差异显著性通过ANOVA方法进行比较,以P<0.05为差异有统计学意义。
结果
1 NBP抑制了OGD诱发的线粒体断裂
在正常的细胞中,线粒体表现为典型的融合长条状(fusion);经过OGD处理后线粒体的形态则转变为分散的小粒状(fission);使用NBP预处理后再进行OGD,可使含有分散小粒状线粒体的内皮细胞数量明显减少,差异有统计学意义(P<0.05),见图1。这说明NBP可抑制OGD诱发的线粒体断裂。
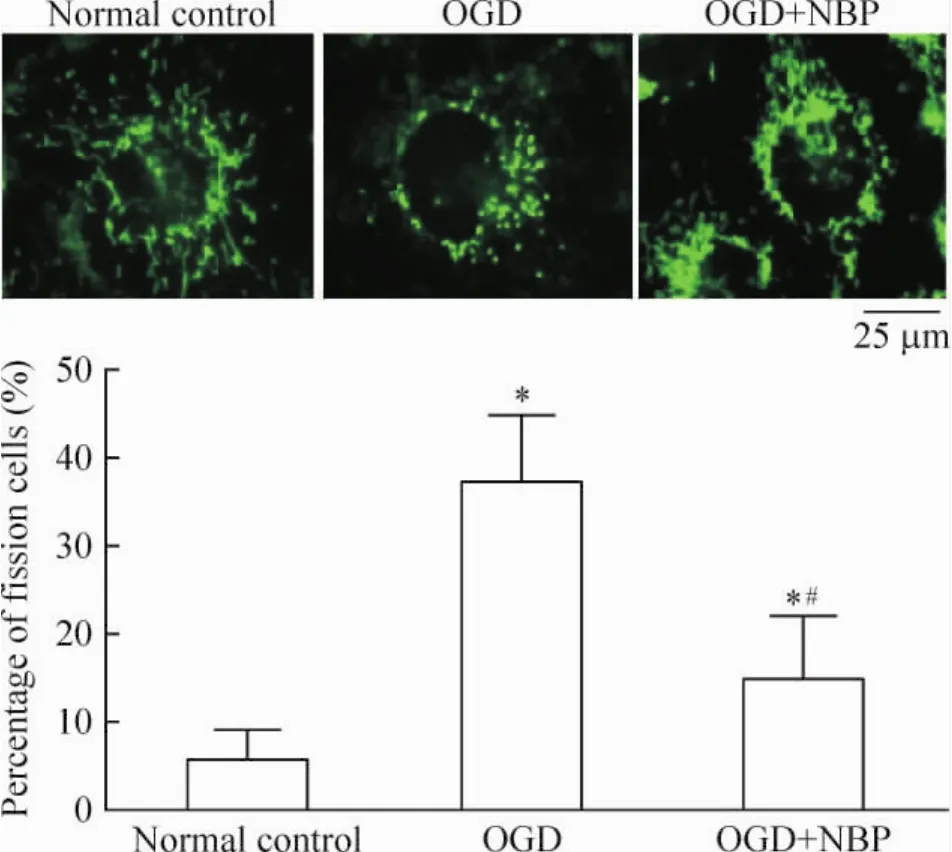
Figure 1.NBP significantly reduced OGD-induced mitochondrial fragmentation(fission).Mean±SD.n=15.*P<0.05 vs normal control;#P<0.05 vs OGD.图1 NBP显著抑制OGD导致的HUVECs内线粒体形态改变
2 NBP减轻OGD诱导的细胞SOD活性下降
正常对照组、OGD组和OGD+NBP组中SOD的活性分别为38.64×103U/L、18.98×103U/L和36.82×103U/L。OGD显著降低了内皮细胞中SOD的活性。而使用NBP预处理后再进行OGD,可明显减轻OGD诱导的内皮细胞SOD活性下降(P<0.05),见图2。

Figure 2.NBP significantly inhibited OGD-induced decrease in SOD activity.Mean±SD.n=15.*P<0.05 vs normal control;#P<0.05 vs OGD.图2 NBP显著抑制OGD导致的HUVECs SOD活性的下降
3 NBP对OGD诱导的内皮细胞线粒体ROS生成量的影响
正常培养的内皮细胞线粒体内只有微量的ROS生成,从照片上看荧光强度比较弱。OGD后内皮细胞线粒体内ROS的量明显增高,荧光强度显著增强。使用NBP预处理后再进行缺氧,内皮细胞线粒体内ROS的量明显降低,几乎同正常内皮细胞线粒体内ROS量相当。使用图像分析软件进行定量分析,可确定NBP降低OGD后线粒体内ROS的量(P<0.05),见图3。
讨论
氧分子拥有2个不成对电子,属于自由基,但受其特殊结构的限制,不表现出强的自由基活性。1个氧分子接受4个电子被还原成2分子水。如果氧分子没有被完全还原,就可以变成各种自由基,如接受1个电子产生超氧阴离子(),再接受1个电子产生过氧化氢(H2O2),再接受1个电子产生羟自由基(OH·)[8]。由于功能上的相似性,这些物质被统称为ROS,它具有很强的毒性,可导致组织和细胞的损伤[9],ROS的大量增多可造成蛋白质、DNA和脂质损伤,还可导致不可控制的增殖和凋亡[10]。
缺血再灌注损伤时,可通过多种途径导致细胞内自由基生成增多,其中线粒体功能障碍是导致自由基生成增多的重要原因之一。因缺血、缺氧使ATP减少,钙进入线粒体增多,使线粒体功能受损,细胞色素氧化酶系统功能失调,进入细胞的氧经4个电子还原成水减少,而经单电子还原生成氧自由基增多。而钙离子进入线粒体可使锰-超氧化物歧化酶减少,对自由基的清除能力降低,使氧自由基生成进一步增加。自由基可减少ATP生成,导致线粒体的功能抑制,使细胞的能量代谢障碍加重,从而导致恶性循环。

Figure 3.NBP significantly attenuated OGD-induced ROS production in mitochondria.Mean±SD.n=15.*P<0.05 vs normal control;#P<0.05 vs OGD.图3 NBP显著减少了OGD诱发的线粒体内ROS生成
在本实验中我们确实观察到NBP对OGD损伤后线粒体中ROS的含量产生明显影响。正常内皮细胞线粒体内只有微量的ROS生成,OGD损伤后内皮细胞线粒体内ROS的含量明显增高。使用NBP预处理后再进行OGD损伤,内皮细胞线粒体内ROS的含量明显降低,几乎同正常内皮细胞线粒体内ROS量相当。为了保证我们观察到得ROS是产生于线粒体内,我们使用了MitoSOX Red与MitoTracker Green 2种染料来进行复染,2种颜色的荧光高度重合,进一步说明我们发现的ROS是存在于线粒体中的。
NBP通过何种机制达到减少OGD条件下线粒体内ROS?我们进行了深入的研究。首先我们的实验发现NBP可以对OGD后线粒体的形态产生显著的影响。既往的研究证实,线粒体的功能可反映在其结构和形态上。正常情况下,线粒体呈现出相互连结的管状网络样形态,以fusion形态为主,只有少量分裂的颗粒状的fission形态,2种形态保持着平衡[11]。而卒中导致的缺血缺氧可引起相互融合的线粒体持续性分裂,此时以fission形态为主[12]。这与本实验中观察到的线粒体形态变化是一致的,OGD导致了线粒体中fission形态明显增多,而NBP预处理可明显减少这一变化。这说明NBP维持了线粒体结构的完整性和减轻了线粒体功能的丧失,NBP对OGD损伤的线粒体产生了很好的保护作用。线粒体功能受到保护,线粒体呼吸链上的电子得到顺利传递,必然导致线粒体内ROS生成减少。除此以外,我们还观察到NBP可明显改善OGD诱导的SOD活性下降,SOD活性得到保护,可增加ROS的清除。既往研究也表明NBP可显著提高缺氧损伤中降低了的线粒体呼吸链复合物Ⅱ和Ⅳ的活性[13],电子可以顺利通过呼吸链传递,这可导致ROS生成减少。NBP还可以提高线粒体中SOD和GSH-Px的活性[4],这可增加对ROS的清除。这些研究与本实验观察到的结果是一致的。
综上所述,我们认为NBP对OGD条件下内皮细胞线粒体具有明显的保护作用,从而减少了线粒体ROS的生成,进而ROS对线粒体的损伤作用也得到缓解。
[1]Peng Y,Zeng XK,Feng YP,et al.Antiplatelet and antithrombotic activity of L-3-n-butylphthalide in rats[J].J Cardiovasc Pharmacol,2004,43(6):876-881.
[2]殷建瑞,张波,谭丽华,等.丁苯酞对缺氧缺糖条件下血管内皮细胞VEGF和HIF-1α表达的影响[J].中国病理生理杂志,2011,27(4):643-647.
[3]王兴民,赵克森.线粒体功能不全在重症休克发生中的作用[J].中国病理生理杂志,2013,29(4):757-760,768.
[4]董高翔,冯亦璞.丁基苯酞对局部脑缺血再灌注大鼠线粒体ATPase、抗氧化酶活性和脂质过氧化的影响[J].中国医学科学院学报,2002,24(1):93-97.
[5]熊杰,冯亦璞.丁基苯酞对局灶性脑缺血过程中线粒体损伤的保护作用[J].药学学报,2000,35(6): 408-412.
[6]Barsoum MJ,Yuan H,Gerencser AA,et al.Nitric oxide-induced mitochondrial fission is regulated by dynamin-related GTPases in neurons[J].EMBO J,2006,25 (16):3900-3911.
[7]段炼,杨跃进,张海涛,等.猪急性心肌梗死再灌注后氧化应激损伤及通心络的保护作用[J].中国病理生理杂志,2010,26(3):430-434.
[8]孙学军,彭兆云,陈箫莹,等.活性氧对低氧诱导因子的调节[J].第二军医大学学报,2006,27(6):660-664.
[9]Dröge W.Free radicals in the physiological control of cell function[J].Physiol Rev,2002,82(1):47-95.
[10]Cadenas E,Sies H.Oxidative stress-excited oxygen species and enzyme activity[J].Adv Enzyme Regul,1985,23:217-237.
[11]Bereiter-Hahn J,Vöth M.Dynamics of mitochondria in living cells:shape changes,dislocations,fusion,and fission of mitochondria[J].Microsc Res Tech,1994,27(3): 198-219.
[12]Youle RJ,Karbowski M.Mitochondrial fission in apoptosis[J].Nat Rev Mol Cell Biol,2005,6(8):657-663.
[13]熊杰,冯亦璞.丁基苯酞对线粒体呼吸链复合酶活性的影响[J].药学学报,1999,34(4):241-245.
DL-3-n-butylphthalide attenuates mitochondrial damage in vascular endothelial cells under the condition of oxygen-glucose deprivation
XIE Long-chang1,ZHANG Bo1,GAO Qing-chun1,FU Xian1,LI You-fu1,LIU Hongying1,WEI Huan2
(1Department of Neurology,the Second Affiliated Hospital of Guangzhou Medical University,Guangzhou 510260,China;2Yan’an Hospital of Kunming City,Kunming 650051,China.E-mail:longchang3907@163.com)
AIM:To investigate the mechanism in which DL-3-n-butylphthalide(NBP)protects the mitochondria from the damage of oxygen-glucose deprivation(OGD).METHODS:Human umbilical vein endothelial cells(HUVECs)were exposed to OGD to induce endothelial damage.Mitochondrial morphology and mitochondrial reactive oxygen species(ROS)were examined using MitoTracker Green and MitoSOX Red,respectively.The activity of superoxide dismutase(SOD)was evaluated by SOD assay kit.RESULTS:NBP significantly attenuated OGD-induced mitochondrial fragmentation,reduced the content of mitochondrial ROS and increased the activity of SOD.CONCLUSION:NBP alleviates OGD-induced damage in the mitochondria.Reduction of mitochondrial ROS and enhancement of SOD activity may be the mechanism in which NBP protects mitochondria.
Butylphthalide;Vascular endothelial cells;Oxygen-glucose deprivation;Mitochondria;Reactive oxygen species
R363
A
10.3969/j.issn.1000-4718.2014.02.026
1000-4718(2014)02-0339-05
2013-08-12
2013-12-02
广东省自然科学基金资助项目(No.S2012010008808)
△通讯作者Tel:020-34153252;E-mail:longchang3907@163.com

