非晶态合金Ni-Fe-B的制备及其催化活性
李华博,宋帮才,张 军,白孝康,李晶晶
(河南科技大学化工与制药学院,河南 洛阳 471023)
非晶态合金Ni-Fe-B的制备及其催化活性
李华博,宋帮才,张 军,白孝康,李晶晶
(河南科技大学化工与制药学院,河南 洛阳 471023)
采用液相还原法合成了一系列非晶态合金Ni-Fe-B,考察了铁物质的量比、反应温度和表面活性剂对非晶态合金Ni-Fe-B的物相、形貌以及催化活性的影响。借助X射线粉末衍射、透射电镜对产物进行了表征分析。以NaBH4的催化水解制氢作为探针反应,对所得非晶态合金Ni-Fe-B的催化活性进行了评价。研究结果表明:所得产物Ni-Fe-B具有相对稳定的非晶态物相结构,铁物质的量比的升高,促使产物向晶态化转变。当铁物质的量比为0.5,反应温度为333 K时,所得Ni-Fe-B的催化活性最高,产氢速率可达1.70 m L/min。非离子型表面活性剂辅助所得非晶态产物的粒径小、分散度最高,催化活性进一步增强,产氢速率可提高到1.98 m L/m in。
液相还原;Ni-Fe-B;非晶态合金;催化活性
0 引言
非晶态合金具有短程有序、长程无序的微观结构,不存在晶界、位错和偏析等晶体中常见的缺陷,其化学成分可连续调变,且保持较好的均一性。非晶态合金的表面力场不饱和度高,表面能较大,处于热力学亚稳态,因而呈现出与常规晶态合金显著不同的物理化学特性,使其在光学、磁学、电子学和催化等领域获得了广泛应用[1-2]。尤其作为催化剂时,因其表面活性位点较多,非晶态合金表现出更为优异的催化活性和选择性。镍基非晶态合金如Ni-B的加氢催化活性和选择性,已被证明优于传统的加氢催化剂Raney镍[3-4],因而,此类材料有望成为能够取代骨架镍或贵金属的新型催化剂。
在镍基非晶态合金中添加助催化成分,可在一定程度上调控非晶态合金的热稳定性,并有助于改善其催化性能。文献[5]报道通过液相合成法制备了Ni-Fe-B,并将其负载在介孔分子筛上,使得非晶态合金的热稳定性和抗氧化能力均有所提高。文献[6]的研究发现:引入助催化成分能够增加非晶态合金的无序度,改善其分散性能,且使活性中心的电子状态发生改变,进而影响了催化剂的活性和选择性。然而,现有研究尚缺乏完整性和系统化,也没有对其催化活性进行深入探讨。本文通过液相还原工艺,制备出了一系列非晶态合金Ni-Fe-B,并系统地考察了铁(Fe)物质的量比[n(Fe)/n(Fe+Ni)]、反应温度以及不同类型表面活性剂的辅助对非晶态合金Ni-Fe-B的物相、形貌以及催化活性的影响。
1 试验部分
1.1 试剂和仪器
醋酸镍(Ni(CH3COO)2·4H2O),氯化亚铁(FeCl2·4H2O),硼氢化钠(NaBH4),氢氧化钠(NaOH),十六烷基三甲基溴化铵(C19H42NBr,简称CTAB),十二烷基硫酸钠(C12H25SO4Na,简称SDS)均为分析纯试剂,辛基酚聚醚-10(C34H62O11,简称OP-10)为化学纯试剂,用前均未做进一步纯化;试验用水为自制蒸馏水。采用D8-Advanced型X射线衍射仪(Bruker,德国)测定产物的物相组成,Cu Kα射线(0.154 06 nm),电压35 kV,电流35 mA,扫描角度2θ为20°~80°;产物的形貌观测在H-800(Hitachi,日本)电子显微镜上完成。
1.2 试验步骤
1.2.1 非晶态合金Ni-Fe-B的制备
室温下,将2.274 7 g Ni(CH3COO)2·4H2O、0.195 4 g FeCl2·4H2O先后溶于100 m L蒸馏水中,配成混合溶液,移入烧瓶,置于333 K水浴中,通入N2保护,磁力搅拌;另取1.630 8 g NaBH4溶入20 m L蒸馏水中,所得NaBH4溶液缓慢滴至烧瓶中。滴加完毕,继续搅拌、反应90 m in,至不再有气泡产生,结束反应。离心分离,取出固体,用蒸馏水和无水乙醇依次洗涤3~5次,真空干燥,即可得到黑色粉末状产物,标记为Ni-Fe-B(1)。类似地,改变物料配比,可获得其他类型的非晶态合金。
为了研究反应温度对产物的影响,本文控制铁物质的量比[n(Fe)/n(Fe+Ni)]为0.1,调整制备温度分别为273 K、283 K和293 K,采取类似的制法,分别获得了Ni-Fe-B(6)、Ni-Fe-B(7)和Ni-Fe-B(8)产物;当铁物质的量比分别为0和1.0时,所得产物分别为二元结构的Ni-B和Fe-B。不同试验条件下所得产物的编号见表1。

表1 不同反应条件下所得产物的编号
1.2.2 表面活性剂辅助制备非晶态合金Ni-Fe-B
采用相似的制备方法,但在滴加NaBH4溶液之前,先向烧瓶中加入一定量的表面活性剂CTAB,充分溶解,然后再进行液相还原反应,进而制得产物Ni-Fe-B(9)。同样地,维持其他条件不变,将表面活性剂分别改换成SDS和OP-10,由此所得产物记为Ni-Fe-B(10)和Ni-Fe-B(11)。
1.2.3 催化活性评价方法
将制备的Ni-Fe-B用作催化剂,对NaBH4水溶液进行催化水解,以产氢速率和产氢量的大小来评价非晶态合金的催化活性。具体方法为:一定容积的三口烧瓶固定于恒温水浴中,烧瓶两侧口分别安装温度计和排水集气装置。将一定浓度的NaBH4溶液加进三口瓶中,加入适量NaOH以维持碱性,磁力搅拌,待体系温度稳定后加入Ni-Fe-B粉末,开始计时,间隔定时记录集气装置的产氢体积,直至产氢量基本不变时,停止反应,可计算获得出产氢总量及产氢速率。
2 结果与讨论
2.1 产物的表征与分析
2.1.1 产物的物相分析
Fe的加入量,即铁(Fe)物质的量比[n(Fe)/n(Fe+Ni)],对产物的物相影响较大。不同试验条件下所得产物的 X射线衍射(XRD)图谱如图1所示。分析图1可知:Fe物质的量比分别为0、0.1、0.3、0.5、0.7时所对应的产物依次是Ni-B、Ni-Fe-B(1)、Ni-Fe-B(2)、Ni-Fe-B(3)和Ni-Fe-B(4),对应于图1中的1、2、3、4、5这5条衍射曲线。前 4条衍射线具有明显的共同特征,即在衍射角(2θ)位于45°附近出现了宽钝的弥散峰,此峰属于非晶态合金典型的特征衍射峰[7],随着Fe物质的量比的增大,该特征峰逐渐弱化,而且未见其他杂峰出现,表明相应产物具有完整的非晶态物相结构。当Fe物质的量比等于0.7和0.9时,即对应于图1中的5号和6号谱线,两条线均在35°和63°处出现了弱小的衍射峰,且6号谱线在45°还有一个很弱的衍射峰,据此不难推断,Fe元素含量较高时,不利于非晶态合金物相的形成,概因还原出的金属Fe在Ni-B物相表面的沉积、覆盖而致,这一推断得到Fe物质的量比等于1.0时所得产物的XRD谱图(见图1中谱线7)进一步证实。谱线7清晰地表明:在2θ等于46°处形成了较尖锐的衍射峰,经与国际粉末衍射标准联合会(JCPDS)的PDF卡片进行比对,认定该峰对应于Fe的(110)晶面,属于单质Fe的晶态结构,空间群Im-3m(229),晶胞参数0.286 7 nm×0.286 7 nm×0.286 7 nm(90°×90°×90°)。此结果表明,在给定的制备条件下,单一的金属Fe不能与B形成稳定的非晶态合金。
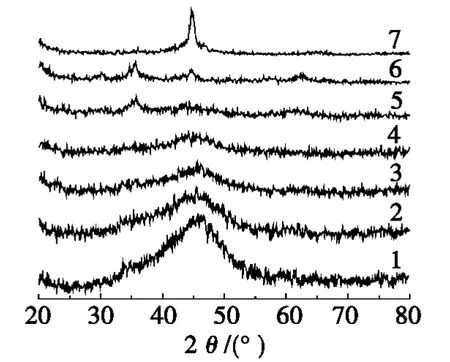
图1 非晶合金产物的XRD图谱
同样的测定表明:不同温度下所制得的Ni-Fe-B(6)、Ni-Fe-B(7)和Ni-Fe-B(8)以及表面活性剂辅助制备的Ni-Fe-B(9)、Ni-Fe-B(10)和Ni-Fe-B(11),其相应的XRD图谱均与图1中的谱线3相似,证明这6种产物均属非晶态合金。
2.1.2 产物的形貌观察
在不加表面活性剂的制备条件下,不同Fe物质的量比所得产物的透射电子显微镜(TEM)形貌图如图2所示。图2a表示Fe物质的量比为0.1,即编号Ni-Fe-B(1)产物的形貌照片。分析图2a发现:产物颗粒呈类球状,粒径约100 nm,颗粒间有相互黏连,但界面可辨。Fe物质的量比升高至0.5时,产物Ni-Fe-B(3)的粒径比较均匀,粒径约为150 nm,微粒间轻度黏连,团聚现象减弱(见图2b)。Fe物质的量比继续增大到0.7时,产物的团聚现象加剧,微粒间相互交联,形成网状结构,颗粒均匀度变差,界面已不甚明晰(见图2c)。当Fe物质的量比达到最大值1.0时,此时的产物已基本失去颗粒形貌,团聚现象严重,形成散乱的絮状结构(见图2d)。结合前述XRD粉末衍射结果,不难分析图2c和图2d的成因。当Fe物质的量比达到0.7以上时,产物出现了晶态化,游离态的金属Fe在反应过程放热[8]的促进下,借助自身的磁性[9]吸引和较高的表面能作用,从而使产物微粒相互靠近,发生团聚。

图2 不同Fe物质的量比所得非晶合金产物的TEM图
表面活性剂对于液相制备中的产物微粒赋型和阻止团聚具有积极作用[10]。通过阳离子、阴离子和中性表面活性剂的辅助,所得产物的TEM图如图3所示。由图3可以看出:阳离子表面活性剂CTAB辅助制备所得的产物呈圆球状(见图3a),粒径约200 nm,虽不均匀,但圆整度较高,微球之间轻度黏连。选用阴离子表面活性剂SDS时,产物已经难以分辨出颗粒,团聚现象非常严重(见图3b)。而非离子表面活性剂OP-10用于辅助制备时,所得产物高度分散,几乎无团聚,而且颗粒细小,粒径比较均匀,大小约为80 nm(见图3c)。由此可见,所选用的3种不同类型的表面活性剂对于Ni-Fe-B产物的形貌形成具有不同的促进作用。

图3 不同表面活性剂辅助制备非晶合金产物的TEM图
2.2 产物的催化活性评价
2.2.1 Fe物质的量比对产物催化活性的影响
为了探求Fe含量对产物催化活性的影响,选取Fe物质的量比分别为0、0.1、0.3、0.5、0.7、0.9、1.0时所得到的7种产物作为催化剂,详细考察了它们对NaBH4水解产氢的催化作用,结果如图4所示。
分析图4发现:Ni-B、Ni-Fe-B(1)、Ni-Fe-B(2)、Ni-Fe-B(3)作为催化剂时,反应10 min时的产氢体积分别为6.1 m L、7.6 m L、20.0 m L和27.2 m L,均表现出较高的催化活性,并且分别于60 min、40 min、25 min和20 m in达到最大产氢量,最大产氢量分别为31.8 m L、32.0 m L、33.0 m L和34.0 m L,相应的产氢速率分别为0.53 m L/min、0.80 m L/min、1.32 m L/m in和1.70 m L/m in。含Fe物质的量比增加到0.7~1.0时,对应产物Ni-Fe-B(4)、Ni-Fe-B(5)、Fe-B的催化水解产氢速率分别为1.07 mL/min、0.64 m L/min、0.36 m L/min。可见,Fe物质的量比由0升至0.5,产氢速率逐步增加,但增速逐渐趋缓;然而,随着Fe物质的量比继续增高,产氢速率不再增加反而呈降低趋势,且Fe物质的量比为1.0时,产物Fe-B的产氢速率最小,明显低于Ni-B。当Fe物质的量比等于0.5时,产物Ni-Fe-B(3)的产氢速率达到最高值1.70 m L/min,与Ni-B和Fe-B相比,产氢速率分别提高了220%和370%。这一现象可作如下解释:Fe元素作为助催化剂的加入,有利于Ni基活性组分的分散,Fe物质的量比为0.5时所得产物的分散度最佳(见图2);但Fe含量过高时,游离Fe的析出,在一定程度上覆盖了Ni-B非晶态合金的活性位点[11],从而导致催化活性降低。
2.2.2 不同制备温度所得产物的催化活性
为了进一步研究制备温度对产物催化活性的影响,固定Fe物质的量比为0.1,选取3个制备温度273 K、283 K、293 K,分别获得了产物Ni-Fe-B(6)、Ni-Fe-B(7)和Ni-Fe-B(8),并由此进行了催化水解产氢试验,结果见图5。

图4 不同Fe物质的量比制备的非晶合金产物的催化水解产氢量
水解反应20 min时,Ni-Fe-B(6)、Ni-Fe-B(7)和Ni-Fe-B(8)催化水解的产氢量分别为3.7 m L、7.5 m L、11.7 m L。3个催化剂分别于105 min、80 min和60 min达到最大产氢量,最大产氢量分别为31.5 m L、32.0 m L和31.8 m L,对应的最终产氢速率分别为0.30 m L/min、0.40 m L/min和0.53 mL/min。不难看出,273 K温度下制得产物的催化活性最低,制备温度越高,所得产物的催化活性相应越大。而且,图5中对比给出的Ni-Fe-B(1)的催化活性明显高于较低温度下所制得的3种催化剂。产生上述现象的主要原因在于:制备温度的升高会导致溶液中分子动能增加过快,不利于形成稳定的非晶结构,相较于较低温度条件下成核速率有所下降[12],易制得粒径小、活性位点多、催化活性较高的非晶合金产物。该结果与文献[13]中报道是一致的。
2.2.3 表面活性剂辅助制备产物的催化活性

图5 不同温度下制备的非晶合金产物的催化水解产氢量
为了探究表面活性剂辅助制备方式对产物Ni-Fe-B催化活性的影响,将非晶态合金Ni-Fe-B(9)、Ni-Fe-B(10)和Ni-Fe-B(11)作为催化剂,用以催化NaBH4的水解产氢,结果如图6所示。由图6可以看出:水解反应起始的10 m in内,Ni-Fe-B(9)、Ni-Fe-B(10)和Ni-Fe-B(11)三者的水解产氢量依次为21.4 m L、7.6 m L和35.6 m L,其中,由OP-10辅助所得的Ni-Fe-B(11)样品的催化活性最高,而且3种催化剂的催化活性均高于无表面活性剂辅助制备的Ni-Fe-B(1)。3种催化剂的最终产氢速率分别为1.95 m L/m in、0.99 m L/m in和1.98 m L/min,即催化活性由大到小的顺序为:Ni-Fe-B(11)(非离子表面活性剂OP-10)>Ni-Fe-B(9)(阳离子表面活性剂CTAB)>Ni-Fe-B(10)(阴离子表面活性剂SDS)>Ni-Fe-B(1)(未加表面活性剂)。
针对表面活性剂辅助制备产物所表现出的较高催化活性,可试作如下解释。表面活性剂是具有双亲端基(亲水和亲油基)的分子,在一定浓度的水溶液中,表面活性剂分子可以定向排列,相互靠拢、聚集而形成胶束或囊泡(见图7),该囊泡能够起到“微反应器”的作用[14]。在微反应器中发生反应而形成的固相,因受到“软壳”的约束而被赋型,而且可以有效地阻止微粒间的相互接触和团聚。不同的表面活性剂,因其电荷及空间结构不一样,形成囊泡的条件以及囊泡的大小、强度等均有所不同[15],因而所制得的Ni-Fe-B产物的形貌有较大差异。
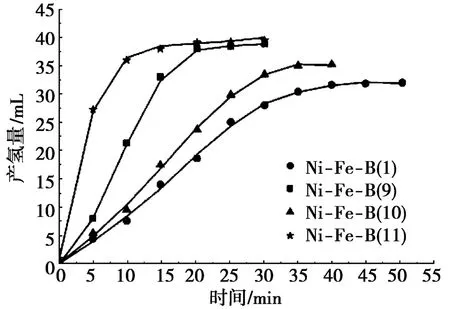
图6 不同表面活性剂辅助制备的非晶合金产物的催化水解产氢量

图7 表面活性剂辅助反应机理示意图
3 结论
通过控制适当的反应条件,制备出了一系列非晶态合金Ni-Fe-B催化剂,并对其催化NaOH4溶液水解制氢的活性进行了评价,得出以下结论:
(1)制得的非晶态合金Ni-Fe-B具有相对稳定的非晶物相结构,铁物质的量比的升高导致合金晶化趋势显著,磁性进一步增强,促使团聚现象发生。
(2)在合成温度条件333 K时,随着铁物质的量比的增高,产物的催化产氢量和产氢速率均呈现先升后降趋势;当铁物质的量比为0.5时催化剂的镍基活性点分散较好,催化产氢速率达到1.70 m L/m in。
(3)相同铁物质的量比时,温度的升高有利于获得更多的活性位点,催化剂表现出较高活性。
(4)表面活性剂辅助制备体系所得非晶态合金Ni-Fe-B的催化活性高于无表面活性剂辅助的体系,其中非离子表面活性剂OP-10制得的催化剂分散性较好,界面清晰,无团聚现象,催化活性最高,以其为催化剂的反应在20 m in内即达到最大产氢量39.6 m L,产氢速率可提高16.5%,达到1.98 m L/m in。
[1] 唐忠.非晶态合金催化剂用于不饱和化合物加氢的研究进展[J].精细石油化工进展,2000,1(2):23-28.
[2] 杨建明,吕剑,安忠维.非晶态合金镍系催化剂研究进展[J].工业催化,2000,8(5):18-24.
[3] Deng J E,Li H X,Wang W J.Progress in Design of New Amorphous Alloy Catalysts[J].Catalysis Today,1999,51(1):113-125.
[4] Wang S T,Lee J F,Chen JM.Preparation and Characterization of MCM-41 and Silica Supported Nickel Boride Catalysts[J].Journal of Molecular Catalysis A:Chemical,2001,165(1):159-167.
[5] 曹新华,詹瑛瑛,郑瑛.Ni-Fe-B/MCM-41非晶态合金的合成与表征[J].合成化学,2005,13(4):349-352.
[6] 马爱增,陆婉珍,闵恩泽.含金属添加剂的负载型NiB非晶态合金催化剂的结构及催化性能[J].石油化工,2000,29(3):179-183.
[7] Yu Z B,Qiao M H,Li H X,et al.Preparation of Amorphous Ni-Co-B Alloys and the Effect of Cobalt on Their Hydrogenation Activity[J].Applied Catalysis A:General,1997,163(1):1-13.
[8] Zhao J Z,Ma H,Chen J.Improved Hydrogen Generation from Alkaline NaBH4Solution Using Carbon-supported Co-B as Catalysts[J].International Journal of Hydrogen Energy,2007,32(18):4711-4716.
[9] Zylsler R D,Ramos C A,Biasi E D,et al.Effect of Interparticle Interactions in(Fe0.26Ni0.74)50B50Magnetic Nanoparticles[J].Journal of Magnetism and Magnetic Materials,2000,221(1):37-44.
[10] 张军,李莉莉,王修才,等.反相微乳液法制备纳米NiB非晶合金及其催化NaBH4水解制氢[J].河南科技大学学报:自然科学版,2013,34(3):91-95.
[11] 任艳平,李伟,韩奕,等.NiFeB非晶态合金催化剂催化麦芽糖加氢反应[J].石油化工,2008,37(1):29-33.
[12] 韩陈.纳米氧化镧和纳米氧化钼的制备及应用[D].上海:华东师范大学,2009.
[13] Nie M,Zou Y C,Huang Y M,et al.Ni-Fe-B Catalysts for NaBH4Hydrolysis[J].International Journal of Hydrogen Energy,2012,37(2):1568-1576.
[14] Li H,Xu Y,Liu J,et al.Hollow Ni-B Amorphous A lloy with Enhanced Catalytic Efficiency Prepared in Emulsion System[J].Journal of Colloid and Interface Science,2009,334(2):176-182.
[15] Hausleitner C,Hafner J.Structural Modeling of Transition-metal-metalloid Glasses by Use of Tight-binding-bond Forces[J].Physical Review B,1993,47(10):5689-5709.
TQ426.82
A
1672-6871(2014)06-0094-06
国家自然科学基金项目(21076063);河南省科技攻关基金项目(102102210170);洛阳市科技攻关基金项目(1101030A);洛阳市矿产资源化工重点实验室建设项目(1003016A)
李华博(1990-),男,河南新乡人,硕士生;张 军(1964-),男,河南漯河人,教授,博士,硕士生导师,研究方向为无机功能材料.
2014-02-22

