谷氨酸损伤体外培养大鼠螺旋神经元中凋亡诱导因子的表达与分布*
丁忠家 唐晓旭 陈鑫 宋勇莉 米文娟 王剑 陈福权 邱建华
现阶段细胞凋亡机制,主要以线粒体为中心,包括半胱氨酸天冬氨酸(caspase)途径及caspase非依赖途径。凋亡诱导因子(apoptosis inducing factor,AIF)在caspase非依赖途径的细胞凋亡中起关键作用[1]。AIF 凋亡途径是一种caspase非依赖凋亡途径,也是现阶段以线粒体为中心的细胞凋亡中的重要途径[2],多发生于神经细胞、特殊类型肿瘤细胞等[3]。AIF作为氧化传递链中一种重要的黄素蛋白,广泛分布于线粒体内膜,成为AIF途径凋亡的发生基础[4]。
螺旋神经元细胞(spiral garglion neurons,SGNs)是耳蜗中重要的感觉细胞,在声信号转换及传导中起重要作用。螺旋神经元的损伤、凋亡,可以直接引起听力减退,内毛细胞向听觉中枢信号传递障碍,甚至可能导致听神经病的发生[5]。螺旋神经元损伤、凋亡过程中,兴奋性神经递质谷氨酸(Glu)发挥着重要作用,是噪声性聋、年龄相关性聋、部分难治性聋等感音神经性聋的重要病因[6]。然而,谷氨酸毒性损伤是否与AIF凋亡因子相关以及是否参与耳聋的发生,仍有待进一步研究。本实验采用体外培养螺旋神经元的方法,观察不同浓度谷氨酸损伤条件下,螺旋神经元中AIF的表达与分布状况,探讨谷氨酸促螺旋神经元凋亡的机制。
1 材料与方法
1.1实验动物及分组 选用40只出生后0~3天SD大鼠螺旋神经元行体外培养,动物由第四军医大学实验动物中心提供,平均分为4组,分别为正常组:仅给予正常SGNs培养液培养;10 mM Glu组:按1:7分别加入80 mM谷氨酸液及SGNs培养液培养;20 mM Glu组:按1:3分别加入80 mM谷氨酸液及SGNs培养液培养;40 mM Glu组:按1:1分别加入80 mM谷氨酸液及SGNs培养液培养。
1.2实验方法
1.2.1细胞培养 SD大鼠仔鼠以75%酒精消毒后,断头,头颅矢状位正中断开后去除周围组织,取出耳蜗,置于消毒超净台中,挑开听泡,去除血管纹、螺旋韧带,沿基底膜底撕除基底膜,保留螺氏管和中轴放置于培养液中,机械法裂解组织后,加入0.125%胰蛋白酶和0.125%胶原酶酶解组织,37 ℃条件下孵育30 min,玻璃管吹打组织,待2次Hanks液漂洗离心后,滤过膜过滤,加入细胞培养液4 ml,置于37 ℃ 5% CO2培养箱孵育,培养1天,第2天换液,加入Glu液和细胞培养液,培养48小时后于倒置显微镜下观察。
1.2.2螺旋神经元细胞的免疫荧光染色 培养48 h后细胞加4% 多聚甲醛固定30 min,0.1 M PBS漂洗3次,每次5 min;后加入0.3% TritonX-100打孔,常温下放置15 min,0.1 M PBS漂洗;加5%牛血清封闭,37 ℃孵育20 min;甩净液体后,标本滴加稀释后一抗(如1:100稀释后的AIF溶液或1:200稀释后的tublin溶液),4 ℃冰箱中静置3天,0.1 M PBS漂洗;再于黑暗环境中滴加稀释后荧光二抗,4 ℃孵育1天,0.1 M PBS漂洗;1:1 000稀释的DAPI液衬核,常温下孵育10 min,0.1 M PBS漂洗,去除多余液体,滴加100 μl 85%甘油,封片,于荧光显微镜下观察,拍照。
1.2.3实时荧光定量PCR
1.2.3.1RNA提取 向培养48 h后的细胞中加300 μl RLTbuffer,匀浆,最大速度离心3 min,取上清液,加入300 μl 70%酒精,混匀;移至RNeasy Mini spin,8 000 r/min离心15 s;向RNeasy Mini spin加700 μl RWI buffer,8 000 r/min离心15 s;再次加入500 μl RPE buffer,8 000 r/min离心15 s,弃废液;重复上步骤,离心2 min;将RNeasy Mini spin置于新管中,全速离心1 min,加入30 μl Rnase free水,8 000 r/min离心2 min;将收集到液体重新加入离心柱重复离心,可提供RNA浓度。
1.2.3.2cDNA逆转录 步骤按QIAGEN逆转录试剂盒步骤,配制模板体系(14 μl),42 ℃孵育2 min,置于冰上,再配制逆转录体系(20 μl),42 ℃孵育30 min,95 ℃孵育3 min得cDNA,于-20 ℃保存。cDNA反应 按QIAGEN反应试剂盒步骤,配制反应体系,上机反应。管家基因(GAPDH)引物序列:R-GAPDH-F: TAGAACTCCAGATGGCAAGACA;R-GAPDH-R: CGCCAGTAGA CTCCACGACA;目的基因引物序列:R-AIF-F:TAGAACTCCAGATGGCAAGACA,R-AIF-R:AAGCCCACAATAAGGACTAACAC;R-caspase3-F:GAATGACTGGGAGTGGGGTAG,R-caspase3-R:GACCTGGAACATCGGATTTGA;R-calpgin-F:AAGCCCACAATAAGGACTAACAC,R-calpain-R: TAAGGGCGTCAGGTGTAAGGT。
1.3统计学方法 实验中的数据均为计量资料,故用均数±标准差来表示,运用SPSS17.0 和Excel软件对数据进行统计分析及图表绘制,组间两两比较采用单因素方差分析SNK-q 检验,α=0.05。
2 结果
2.1不同浓度Glu组SGNs的形态 体外培养SGNs 48 h后,光镜下观察,发现正常组细胞胞体呈梭形,周围可见光晕,双极伸出较长突起,细胞状态良好;10 mM Glu组神经元形态明显,双极突起延长,与正常组形态无明显变化;20 mM Glu组SGNs细胞轴突缩短明显,胞体可见透光点,SGNs形态变化明显;40 mM Glu组轴突消失,胞体皱缩,胞浆中透光明显,可见明显细胞损伤(图1)。
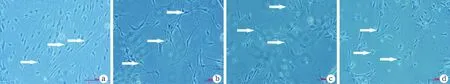
图1 体外培养48 h后各组螺旋神经元细胞形态图(×100)
a~d分别为正常组、10 mM Glu组、20 mM Glu组及40mM Glu组SGNs倒置显微镜下细胞形态,白色箭头示典型SGN细胞
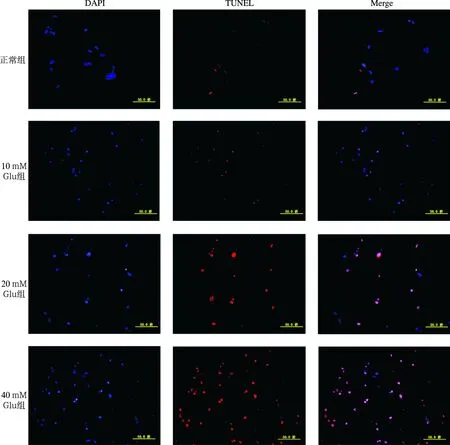
图2 各组螺旋神经元TUNEL免疫荧光染色图(×600) 四组TUNEL染色细胞核,红色为TUNEL染色,蓝色为DAPI染色
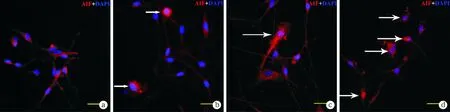
图3 各组AIF免疫荧光分布图(×1 000)
Glu干预后的体外培养SGNs细胞行免疫荧光染色,AIF衬染为红色,DAPI衬核。白色箭头示AIF分布异常的SGNs细胞。a~d分别为正常组、10 mM Glu组、20 mM Glu组及40mM Glu组
2.2不同浓度Glu组SGNS TUNEL染色结果 荧光显微镜下观察发现,正常组中SGNS细胞核呈椭圆形,核质均匀,而TUNEL着色细胞核几乎不可见;10 mM Glu组胞核固缩明显,但TUNEL着色细胞核仍较少:20 mM Glu组可见明显细胞核固缩及明显的TUNEL着色;40 mM Glu组TUNEL着色细胞核进一步增加,细胞凋亡明显(图2)。
2.3免疫荧光观察AIF在SGNs中分布变化 正常组AIF均匀着色于胞浆及轴突,与细胞核界限分明,可见明显双极突起及胞浆着色;10 mM Glu组红色AIF开始与蓝色细胞核重叠,但核转位不明显;20 mM Glu组AIF不仅分布于双极轴突及胞浆,胞核也可见明显着色;40 mM Glu组螺旋神经元胞体皱缩,双极形态不可见, AIF在胞核分布明显(图3)。同一视野计数AIF分布于细胞核的细胞比率,结果发现,正常组未见AIF转位细胞,10 mM Glu、20 mM Glu和40 mM Glu组核转位细胞率分别为11.1%±4.8%、15.1%±1.4%和50.0%±5.6%,与正常组比较差异均有统计学意义(P<0.05),随谷氨酸浓度升高,AIF转位细胞数目增加。
2.4各组SGNs中AIF、calpain和caspase 3的表达变化 PCR结果显示,不同浓度Glu组AIF mRNA表达水平明显高于正常组(P<0.05),从低浓度到高浓度Glu组,AIF mRNA表达水平呈下降趋势;Calpain mRNA表达水平在正常及10 mM Glu组之间无明显差异,在20 mM Glu组和40 mM Glu组中表达明显升高(P<0.05)。各组间caspase 3 mRNA表达水平无明显差异(P>0.05),但随Glu浓度增加其表达量呈下降趋势(表1)。
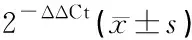
表1 各组体外培养SGNs中AIF、calpain及caspase 3相对表达量
注:*与其他组相比,P<0.05
3 讨论
研究表明,噪声、缺血、缺氧、耳毒性药物等都可导致感音神经性聋,而谷氨酸(Glu)兴奋性毒性在其中发挥着重要作用。Glu兴奋性毒性可导致神经元长时程或短时程突触信号传导障碍[7],可影响神经元的正常传输信号,从而引起神经元细胞的退行性病变或凋亡,这是螺旋神经元损伤的生理机制之一。在损伤条件下,兴奋性Glu可由毛细胞过多释放入突触间隙,与螺旋神经节内的SGNs细胞表面Glu受体结合,激活下游途径,导致氧化损伤或钙超载的发生,从而诱导SGNs的退行性病变或凋亡,导致感音神经性聋。而氧化损伤或钙超载,均可激活体内一系列损伤凋亡途径,与线粒体为中心的calpain-AIF途径相关[8]。本研究结果显示不同浓度Glu干预体外培养SGNs 48 h后,20 mM浓度谷氨酸即可诱导SGNs轴突缩短,胞体出现透亮光点;TUNEL凋亡染色结果提示随Glu浓度升高,细胞核固缩及细胞凋亡现象越来越明显,这与Steinbach等[9]发现高浓度Glu对SGNs有损伤作用一致。
耳蜗感觉细胞的损伤凋亡与caspase 3途径有一定相关性。Schmutzhard等[10]研究认为败血症引起重度听力损失的过程中,Corti器支持细胞caspase途径被激活,影响毛细胞的再生与修复;Abaamrane等[11]研究显示爆震性损伤中,caspase凋亡途径导致毛细胞减少,从而引起听力损伤发生;Steinbach等[9]应用caspase阻断剂z-VAD-FMK[z-Val-Ala-Asp(ome)-fluoromethy-lketone]可有效抑制SGNs轴突的缩短。但是单纯阻断caspase途径并不能有效抑制耳蜗感觉细胞损伤凋亡,说明耳蜗感觉细胞凋亡过程中可能存在其他凋亡途径,如:AIF凋亡途径,因此本研究探讨AIF途径在Glu损伤耳蜗感觉细胞中的作用。
AIF是正常线粒体中的一种黄素蛋白,存在于线粒体内膜上,在氧化传递链中有重要作用。AIF由三部分构成,包括黄素腺嘌呤二核苷酸(flavin adenine dinudeotide,FAD)结合序列、2个核定位序列及烟酰胺腺嘌呤二核苷酸(nicotinanide adenine dinudeotide,NAD)定位序列组成,生理状况下,N端通过特定线粒体定植序列(mitochondrial leading sequence,MLS)序列插入到线粒体内膜中[12]。目前认为,AIF凋亡途径是在凋亡信号诱导下,细胞内信号转导促进钙离子浓度升高,激活calpain蛋白,剪切定位于内膜的AIF,并通过线粒体传输孔道(pereabitily transition pore,PTP)孔释放AIF到胞浆[13],AIF自胞浆转运至胞核可与限制性内切酶EndG等结合,裂解DNA分子成片段,促进细胞凋亡发生[14]。在皮层神经元培养的实验中,DNA修复酶(ploy ADP-ribose polymerase,PAPR-1)介导的兴奋性神经递质毒性,可诱导AIF进入细胞核[8];给予SD大鼠130 dB SPL的白噪声2 h后,在基底膜染色铺片发现AIF核转位,且随AIF表达的上调,EndG表达亦上调,促进外毛细胞的凋亡[15]。本研究发现谷氨酸损伤SGNs作用过程中,有明显核转位的现象,而RT-PCR也发现不同浓度Glu组AIF mRNA表达水平明显高于正常组,说明AIF在Glu损伤SGNs的过程中有重要作用。而caspase 3在免疫荧光染色中未显色,各组mRNA表达水平也无差异,从而说明Glu损伤体外培养SGN过程中不存在caspase途径。
Calpain蛋白属于钙依赖蛋白家族,为非溶酶体性半胱氨酸蛋白酶,广泛存在于哺乳动物及其他物种中[16],主要分布于胞浆,可被Ca2+激活,具有重要蛋白水解作用。有作者认为,calpain是AIF途径上游的主要作用蛋白,其被激活后,可通过线粒体外膜,剪切定位于内膜的AIF,并通过线粒体PTP孔释放AIF到胞浆[13]。本研究PCR结果显示高浓度谷氨酸组的calpain表达明显升高,提示螺旋神经元损伤过程中存在上述过程,说明calpain与AIF协同参与了谷氨酸对体外培养SGN的损伤凋亡,而AIF在细胞核的分布,也进一步验证了calpain-AIF途径主导SGNs的凋亡。
综上所述,本研究发现,Glu损伤体外培养的SGNs与calpain-AIF凋亡途径相关,而非caspase途径;提示可否通过抑制calpain抑制AIF途径,达到减少螺旋神经元凋亡、从而恢复听力的目的,为耳聋的防治提供了新的研究方向。
4 参考文献
1 Delettre C, Yuste VJ, Moubarak RS, et al. Identification and characterization of AIFsh2, a mitochondrial apoptosis-inducing factor (AIF) isoform with NADH oxidase activity[J]. J Biol Chem,2006,281:18507.
2 Cande C, Cohen I, Daugas E, et al. Apoptosis-inducing factor (AIF): a novel caspase-independent death effector released from mitochondria[J]. Biochimie,2002,84:215.
3 Zhu C, Wang X, Deinum J, et al. Cyclophilin A participates in the nuclear translocation of apoptosis-inducing factor in neurons after cerebral hypoxia-ischemia[J]. J Exp Med,2007,204:1741.
4 Vahsen N, Cande C, Briere JJ, et al. AIF deficiency compromises oxidative phosphorylation[J]. EMBO J,2004,23:4679.
5 Berlin CI, Hood LJ, Cecola RP, et al. Does type I afferent neuron dysfunction reveal itself through lack of efferent suppression[J]? Hear Res,1993,65:40.
6 张琰敏,马蓓,高元元,等.谷氨酸受体在噪声致豚鼠螺旋神经节细胞损伤中的作用[J].生理学报,2007,59:103.
7 Cardon G, Campbell J, Sharma A. Plasticity in the developing auditory cortex: evidence from children with sensorineural hearing loss and auditory neuropathy spectrum disorder[J]. J Am Acad Audiol,2012,23:396.
8 Wang H, Yu SW, Koh DW, et al. Apoptosis-inducing factor substitutes for caspase executioners in NMDA-triggered excitotoxic neuronal death[J]. J Neurosci,2004,24:10963.
9 Steinbach S, Lutz J. Glutamate induces apoptosis in cultured spiral ganglion explants[J]. Biochem Biophys Res Commun,2007,357:14.
10 Schmutzhard J, Glueckert R, Pritz C, et al. Sepsis otopathy: experimental sepsis leads to significant hearing impairment due to apoptosis and glutamate excitotoxicity in murine cochlea[J]. Dis Model Mech,2013,6:745.
11 Abaamrane L, Raffin F, Schmerber S, et al. Intracochlear perfusion of leupeptin and z-VAD-FMK: influence of antiapoptotic agents on gunshot-induced hearing loss[J]. Eur Arch Otorhinolaryngol,2011,268:987.
12 Otera H, Ohsakaya S, Nagaura Z, et al. Export of mitochondrial AIF in response to proapoptotic stimuli depends on processing at the intermembrane space[J]. EMBO J,2005,24:1375.
13 Norberg E, Gogvadze V, Ott M, et al. An increase in intracellular Ca2+is required for the activation of mitochondrial calpain to release AIF during cell death[J]. Cell Death Differ,2008,15:1857.
14 Yamashita D, Miller JM, Jiang HY, et al. AIF and EndoG in noise-induced hearing loss[J]. Neuroreport,2004,15:2719.
15 Han W, Shi X, Nuttall AL. AIF and endoG translocation in noise exposure induced hair cell death[J]. Hear Res,2006,211:85.
16 Parameswaran S, Sharma RK. Altered expression of calcineurin, calpain, calpastatin and HMWCaMBP in cardiac cells following ischemia and reperfusion[J]. Biochem Biophys Res Commun,2014,443:604.

