抗磷脂抗体促进ox-LDL诱导U937细胞泡沫化进程及对VEGF分泌的影响
白 玲,刘 平,马爱群,杜 媛,霍建华,范力宏,强 华
(西安交通大学医学院第一附属医院心血管内科,环境与疾病相关基因教育部 重点实验室,陕西省分子心脏病学重点实验室,陕西西安 710061)
抗磷脂抗体(antiphospholipid antibody, APA)的出现伴随着临床高发的心肌梗死和脑血栓形成。有研究表明APA是动脉粥样硬化(atherosclerosis, AS)的独立危险因子[1-2]。近年来的研究主要集中在APA对血管内皮细胞功能、凝血异常方面。目前为止,APA的生理功能以及在AS形成中的确切机制尚不清楚。动脉壁富含脂质的泡沫细胞是AS的重要特征,氧化低密度脂蛋白(oxidized low density lipoprotein, ox-LDL)在细胞内集聚是泡沫细胞得以形成的原因,被自身抗体—抗ox-LDL抗体包被的ox-LDL更易于被单核巨噬细胞吞噬。已有研究[3]显示ox-LDL与APA有交叉反应,但尚未见APA对单核巨噬细胞摄取ox-LDL及血管内皮生长因子(vascular endothelial growth factor, VEGF)分泌的影响的报道。VEGF是一个高度特异的血管内皮促分裂因子,可促进斑块内血管新生,从而与AS斑块生长、破裂、出血、血栓形成密切相关[4-5]。本研究目的在于探讨ox-LDL诱导人髓系单核细胞株U937泡沫化过程中,APA对细胞泡沫化进程和分泌VEGF蛋白的影响,从而探讨APA致AS的机制。
1 材料与方法
1.1材料人髓系白血病单核细胞U937购自中国科学院上海细胞生物所。胎牛血清、RPMI 1640购自Gibco,胆固醇测定酶为Sigma公司产品, VEGF的ELISA试剂盒购于R&D Systems公司,其余试剂为国产分析纯。
1.2APA的亲和纯化、定性及蛋白定量选取6例APA阳性冠心病患者,各留取10 mL枸橼酸抗凝血,用Harris方法制备APA亲和纯化液。对提纯APA用考马斯亮蓝G-250进行定量及ELISA进行定性检测。APA制备液用考马斯亮蓝G-250定量测定蛋白浓度为0.35 mg/mL,ELISA定性实验表现出对心磷脂高度结合活性,抗体滴度>1∶100。
1.3LDL的制备、氧化修饰与鉴定常规分离新鲜健康人空腹血清,序列超速离心分离LDL(d=1.019~1.063 g/mL),经琼脂糖电泳、SDS-聚丙烯酰胺凝胶电泳均显示单一蛋白带,Lowrry法测蛋白浓度。将LDL置于10 μmol/L CuSO4的PBS溶液(pH 7.2)中,37 ℃透析24 h,换200 μmol/L EDTA的PBS终止反应,过滤除菌后4 ℃保存。LDL氧化程度用硫代巴比妥酸反应值(TBARS)反映,新鲜的LDL TBARS为1.5 μmol/g,CuSO4处理的LDL的TBARS为22.3 μmol/g,经证明LDL已被氧化。
1.4实验分组U937为悬浮细胞,用100 mL/L胎牛血清的RPMI 1640培养基在37 ℃、50 mL/L CO2条件下培养,细胞密度为109个/L,每2 d换液1次,为达实验目的分为3组:正常对照组、ox-LDL处理组(ox-LDL为80 mg/L)、ox-LDL与APA处理组(ox-LDL为80 mg/L、APA为100 mg/L),均于处理48 h后收集细胞。
1.5电镜下细胞形态的变化将实验获取的细胞用戊二醛固定,1 000 r/min离心10 min,去上清制备细胞团块,送西安交通大学医学院电镜室,透射电镜下观察胞浆内脂质空泡及细胞染色质的变化。
1.6细胞内胆固醇及胆固醇酯的测定收集的细胞用PBS清洗3次,0.7 mL的已烷∶异丙醇(V/V=3∶2)抽提细胞脂质2次,N2气流下吹干,细胞内游离胆固醇和总胆固醇含量测定参照修饰的酶荧光法进行,测定荧光强度的激发波长为320 nm,发射波长为407 nm,胆固醇酯为总胆固醇与游离胆固醇之差。
1.7细胞群染色体DNA片段(DNALadder)的观察用酚-氯仿-异丙醇抽提细胞总DNA,15 g/L琼制糖凝胶电泳,溴化乙啶染色,紫外灯下观察DNA片段。
1.8ELISA检测VEGF蛋白分泌采用ELISA双抗夹心法,收集培养细胞上清液,按说明书步骤操作,492 nm处测定细胞上清液中VEGF蛋白浓度。

2 结 果
2.1细胞内胆固醇和胆固醇酯含量的比较正常对照组、ox-LDL处理组、ox-LDL与APA处理组细胞内胆固醇和胆固醇酯的含量见表1。结果显示,ox-LDL促使细胞内脂质含量增加,但胆固醇酯与总胆固醇之比小于50%,细胞整体生化指标尚未达到泡沫化的程度;而APA存在下细胞摄取ox-LDL增加,该组细胞内胆固醇酯与总胆固醇之比大于50%,达到泡沫细胞的程度。
2.2U937细胞的形态学改变透射电镜下,正常对照组U937细胞内无脂质空泡(图1A)。而ox-LDL处理组细胞体积增大,细胞胞质内出现大量空泡(图1B),但染色质无明显变化。Ox-LDL与APA共同处理组,细胞体积变小,胞质内脂质空泡进一步增加,有些脂质融合成空泡,细胞转变为泡沫细胞。细胞染色后脂质浓缩、靠边、呈新月形改变,部分细胞核裂解,出现调亡小体(图1C),说明APA不仅促使细胞内ox-LDL堆积,而且导致细胞出现凋亡现象,加速ox-LDL诱导下U937细胞的泡沫化进程。
表13组细胞内胆固醇和胆固醇酯含量的比较


组 别例数胆固醇(mg/g)胆固醇酯(mg/g)总胆固醇(mg/g)胆固醇酯/总胆固醇(%)正常对照组6215±1087±10302±1328.81ox-LDL组6243±7226±12469±1348.18*ox-LDL+APA组6276±10384±13660±1458.18*△
与正常对照组相比,*P<0.05;与ox-LDL组相比,△P<0.05;APA:抗磷脂抗体。
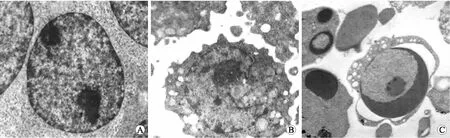
图13组细胞电镜下的形态学变化
Fig.1 Morphological changes of three group cells under electron microscope (×5 000)
A:正常U937细胞表面光滑,胞质内无脂质颗粒;B:电镜下80 mg/L ox-LDL作用后的U937细胞,形态多边形,形似巨噬细胞,胞质内可见到脂质空泡;C:电镜下80 mg/L ox-LDL+APA作用后的U937细胞,部分细胞核固缩、靠边,形成新月形改变,可见典型凋亡小体,同时细胞呈现泡沫化;APA:抗磷脂抗体。
2.3经APA处理后的细胞出现凋亡现象APA处理组的细胞提取DNA,经18 g/L琼制糖凝胶电泳后出现阶梯状(Ladder)条带,进一步证明电镜观察到的APA作用后的细胞样品有凋亡细胞存在(图2)。

图2C组DNA“梯形条带”的琼脂糖电泳图
Fig.2 Agarose gel electrophoresis of DNA“ladder” in Group C
M2:λ-Hind ⅢDNA marker;C组:APA处理组;M1:100 bp DNA Ladder;APA:抗磷脂抗体。
2.4细胞分泌VEGF蛋白含量的比较U937细胞在ox-LDL单独作用下,细胞分泌VEGF较正常细胞明显增加;APA与ox-LDL共同作用下,VEGF的分泌进一步增加(表2)。
表23组细胞分泌VEGF蛋白含量的比较
Tab.2 Comparison of the levels of VEGF protein secreted in U937 cells in the three groups

组 别例数VEGF蛋白的含量(pg/mL)正常对照组61515±134ox-LDL组62334±178*ox-LDL+APA组62716±145*△
与正常对照组相比,*P<0.05;与ox-LDL组相比,△P<0.05;APA:抗磷脂抗体。
3 讨 论
抗磷脂抗体像同型半胱氨酸一样也是近年来被人们意识到的新型致AS因子,它的出现伴随着临床高发的缺血性心脑血管事件[6-7]。我们既往的研究也表明冠心病患者血清APA的阳性率明显高于正常健康人群[8]。APA通过与带负电荷磷脂的靶物质结合而发挥其致病作用,由于作用的靶抗原广泛存在于体内,目前APA致AS的机制并不清楚。大多学者认为APA与内皮细胞膜上磷脂结合后使内皮细胞释放PGI2、NO、细胞粘附分子、IL-1改变及抗血栓能力减弱是APA致AS的重要机制。
巨噬细胞通过清道夫受体无反馈性的大量摄取ox-LDL后衍变成富含胆固醇酯的泡沫细胞是AS的标志,而被自身抗体—抗ox-LDL包被的ox-LDL更易于被巨噬细胞吞噬。有研究显示APA与ox-LDL有交叉反应,APA不能与LDL结合,却能与ox-LDL反应,可能系LDL被氧化修饰时暴露出APA作用的靶物质[9],但APA对ox-LDL的致泡沫细胞的形成作用并不清楚。本研究结果表明U937细胞受ox-LDL作用后细胞由圆形转变为巨噬细胞特有的多角形,表明细胞由单核细胞分化为巨噬细胞,而且生化及形态学也显示胞浆内有大量脂质沉积,证明ox-LDL是细胞内脂质的主要来源。虽然整体生化水平上细胞尚未达泡沫化程度,可能与ox-LDL作用的剂量及时间有关。而在有APA共同存在条件下,透射电镜可见大量脂滴融合形成脂质空泡,胞浆内胆固醇酯的含量也超过总胆固醇的50%,APA处理后的细胞无论在形态上还是生化指标均符合泡沫细胞的定义,说明APA有明显的促ox-LDL诱导下U937细胞泡沫化进程。
此外,当APA与ox-LDL共同存在时,透射电镜下观察到U037细胞染色质固缩、靠边、形成新月体,甚至出现凋亡小体;凝胶电泳DNA也出现“梯状谱带”,说明APA在促使ox-LDL被摄取的同时也加速了细胞的凋亡。AS斑块中有大量的凋亡细胞,主要来源于吞噬脂质的巨噬细胞及平滑肌细胞[10]。在早期,血管壁主要是巨噬细胞吞噬ox-LDL以消除对血管的损害。随危险因素持续存在,脂质大量堆积的同时细胞出现凋亡,而凋亡使细胞崩解脂质沉积于血管壁,加速AS的进展[11],也是斑块不稳定因素。本研究发现APA有促ox-LDL致巨噬细胞凋亡的作用,说明APA有加速血管壁脂质沉积作用,从而加速AS形成。
VEGF是一个高度特异的强血管内皮促分裂因子和血管生成因子[12-13]。VEGF作用于内皮细胞,促进内皮细胞增殖、生理性和病理性血管增生及血管通透性增加。已有研究表明体内斑块中VEGF表达增加,诱使AS斑块内血管生成,同时使粘附分子等炎症因子产生。促进炎症细胞对血管壁的粘附,从而加速AS的进展及斑块的不稳定性[14-15]。本研究发现ox-LDL诱导单核-巨噬细胞泡沫化进程中,VEGF分泌增加,当APA存在时,不仅细胞脂质沉积明显,凋亡细胞出现,同时细胞分泌VEGF增加也较ox-LDL单独存在时更为明显。说明APA从多个环节参与AS的发生和发展过程。
参考文献:
[1] AMES PR, MARGARITA A, ALVES JD. Antiphospholipid antibodies and atherosclerosis: insights from systemic lupus erythematosus and primary antiphospholipid syndrome[J]. Clin Rev Allergy Immunol, 2009, 37(1):29-35.
[2] MAJKA DS, LIU K, POPE RM, et al. Antiphospholipid antibodies and sub-clinical atherosclerosis in the coronary artery risk development in young adults (CARDIA) cohort[J]. Inflamm Res, 2013, 62(10):919-927.
[3] HASUNUMA Y, MATSUURA E, MAKITA Z, et al. Involvement of beta 2-glycoprotein I and anticardiolipin antibodies in oxidatively modified low-density lipoprotein uptake by macrophages[J]. Clin Exp Immunol, 1997, 107(3):569-573.
[4] HOLM PW, SLART P, ZEEBREGTS CJ, et al. Atherosclerotic plaque development and instability: a dual role for VEGF[J]. Ann Med, 2009, 41(4):257-264.
[5] KIMURA A, HASHIGUCHI T, DEGUCHI T, et al. Serum VEGF as a prognostic factor of atherosclerosis[J]. Atherosclerosis, 2006, 194(1):182-188.
[6] AMES PR, MARGARITA A, ALVES JD. Antiphospholipid antibodies and atherosclerosis: insights from systemic lupus erythematosus and primary antiphospholipid syndrome[J]. Clin Rev Allergy Immunol, 2009, 37(1):29-35.
[7] NICOLO D, VARADHACHARY AS, MONESTIER M. Atherosclerosis, antiphospholipid syndrome, and antiphospholipid antibodies[J]. Front Biosci, 2007, 1(12):2171-2182.
[8] BAI L, MA AQ, ZHANG Y, et al. The study of production and mechanism of antiphospholipid antibody in patients with coronary heart disease[J]. J Xi’an Med Univ, 2001, 13(2):142-144.
[9] MIZUTANI H, KURATA Y, KOSUGI S, et al. Monoclonal anticardiolipin autoantibodies established from the (New Zealand white x BXSB) F1 mouse model of antiphospholipid syndrome cross-react with oxidized low-density lipoprotein[J]. Arthr Rheum, 1995, 38(10):1382-1388.
[10] 王智昊,吴扬,王英凯. 血管平滑肌细胞的增殖因素及机制[J]. 吉林大学学报:医学版,2011,37(3):561-566.
[11] STONEMAN VEA, BENNETT MB. Role of apoptosis in atherosclerosis and its therapeutic implication [J]. Clin Sci, 2004, 107(4):343-354.
[12] 杨书强,张振秀,法宪恩,等. VEFG诱导人骨髓间充质干细胞分化为内皮细胞的可行性[J]. 郑州大学学报:医学版,2008, 43(3): 503-506.
[13] 吕凤华,高健生,崔佳佳,等. 叶酸对冠心病大鼠血清同型半胱氨酸和血管内皮生长因子的影响[J]. 西安交通大学学报:医学版,2011, 32(4):449-452.
[14] SANDHOFER A, TATARCZYK T, KICHMAIR R, et al. VEGF and atherosclerosis[J]. J Atheroscler, 2009, 206(1):265-269.
[15] DESIDERIO M, SHRIKANTHAM S, CERQUEIRA M, et al. VEGF inhibition attenuates atherosclerotic plaque inflammation detected by 18fdg-PET/CT[J]. Cardiovascular, 2013, 54(s2):1733-1739.

