尿激酶减轻草酸诱导的MDCK细胞脂质过氧化损伤的实验研究
明 星,朱 娇,辛文虎,岳中瑾
(1.兰州大学第二医院泌尿外科,甘肃兰州 730030;2.西安交通大学医学院第一附属医院,陕西西安 710061)
肾结石是泌尿系统疾病中的常见病、多发病,以草酸钙(CaOxa)结石多见。一般认为,肾结石的形成是一系列生理的、化学的、生化的及分子调节等因素共同作用的结果[1]。肾小管上皮细胞受损被认为是促进CaOxa结石形成的重要诱因[2]。尿液中草酸含量增高被认为是促进结石形成的一个重要原因[3]。草酸作为尿液中一种物质,当其过饱和时,可通过产生氧自由基等多种途径损伤肾小管上皮细胞,细胞受损后,基底膜直接暴露于尿液环境中,有利于微晶体的滞留,为晶体成核提供了有效位点;同时,损伤的细胞膜增加了晶体的粘附,甚至阻塞肾小管,造成肾小管细胞发生适应性改变,影响结晶粘附与聚集[4]。草酸与肾小管上皮细胞之间的相互作用是一个极其复杂的过程,大量的分子和活性蛋白参与,其中包括肾小管上皮细胞分泌的尿激酶(UK)。然而对于UK在结石形成过程中是否有促进或者抑制的作用,尚缺乏细胞及分子水平的研究。我们采用原代细胞培养技术,研究UK能否减轻草酸对体外培养的MDCK细胞造成的脂质过氧化损伤及细胞表面结晶的粘附与聚集,探讨UK在尿路结石防治中的作用及其机制。
1 材料与方法
1.1细胞株及试剂正常狗的肾小管上皮细胞株MDCK(兰州大学泌尿研究所提供);培养液DMEM-F12(HyClone,美国);新生牛血清(Gibco,美国);青霉素(华北制药股份有限公司);链霉素(大连美罗大药厂);丙二醛(MDA)试剂盒(南京建成生物工程研究所);乳酸脱氢酶(1actate dehydro-genase,LDH)测试盒(美国GBD公司);细胞增生分析试剂盒(CCK-8,日本同仁化学研究所);尿激酶(丽珠集团丽珠制药厂);其他常规试剂均为分析纯。
1.2主要仪器Forma CO2孵箱(HW0301T-VBA型,Forma Scientific,USA);医用超净工作台(YG-875型,苏州长桥净化设备厂);倒置荧光显微镜(IXSI,奥林巴斯公司);电热恒温水浴箱(DK-600型,上海精密实验设备有限公司)。
1.3方法
1.3.1细胞培养 MDCK用含100 mL/L新生牛血清的DMEM-F12培养液培养,同时加入100 mg/L青霉素、100 mg/L链霉素,培养条件为37 ℃、50 mL/L CO2、饱和湿度。MDCK传代采用胰蛋白酶消化法,细胞达90%融合后用D-Hanks平衡液洗涤2次,加入1 mL 2.5 g/L胰酶消化液,轻轻摇动培养瓶,置37 ℃孵育箱,2~3 min,在倒置显微镜下观察消化程度。当细胞变圆、细胞之间出现孔隙且不再连接成片,表明此时细胞消化适度,中止消化。加入100 mL/L新生牛血清的DMEM-F12培养液,吹打细胞脱离瓶壁并形成单细胞悬液,将细胞悬液分别分装入12孔板中,每孔3 mL,置孵育箱(37 ℃、50 mL/L CO2)内培养。
1.3.2MDA及LDH含量的检测 将MDCK悬液接种于12孔板中,每孔3 mL,孵育24 h后加入无血清的DMEM-F12孵育12 h,使细胞同步化。将孔板上的细胞分为3组,空白组只加入无血清培养液;对照组在无血清培养基中同时加入5 mmol/L的草酸;尿激酶组在无血清培养基中同时加入5 mmol/L的草酸和10万U的UK。培育2 h后将细胞悬浮液移入EP管内,在4 ℃离心10 min取上清液,严格按照试剂盒说明操作,测定MDA和LDH的含量。
1.3.4细胞损伤的检测 采用CCK-8法检测各组对细胞增殖的抑制作用,细胞分组同上。将MDCK细胞悬液按1×107个/mL、0.1 mL/孔接种于96孔板,作用一定时间(0.5、1、1.5、2 h),更换无血清培养液,每孔加入10 μL的CCK-8,37 ℃孵育4 h后,检测细胞活性,以细胞活性反映细胞的损伤程度。用酶标仪在450 nm处测量上述细胞A值,各个条件下的细胞平行测定3个复孔,求A值的平均值。细胞活性=A(实验组)/A(对照组)×100。

2 结 果
2.1细胞的生长情况各组细胞生长状态良好,均于24~36 h开始贴壁,48~72 h后开始生长,96 h后呈指数性增长,120 h左右基本铺满孔板。
2.2细胞表面的晶体粘附情况实验进行2 h后,在倒置显微镜下观察到各组细胞表面有不同程度的晶体粘附(图1)。空白组细胞生长相对良好,未见细胞肿胀,表面未见晶体形成。草酸组可见细胞肿胀,失去原有的细胞形态,变成类椭圆形或不规则形状,部分出现破裂,胞核模糊,胞质溶解消失,可见大量晶体粘附于细胞表面。尿激酶组形态和草酸组基本相同,但细胞损伤程度明显减轻,细胞死亡减少,细胞表面晶体粘附明显减少。
2.2LDH及MDA含量的测定结果实验进行2 h后,测定各组培养基中LDH及MDA含量,结果见表1。各组数据结果比较显示:①草酸组和UK组细胞培养基中LDH及MDA含量均明显升高,与对照组相比差异有统计学意义(P<0.05);②与UK组相比,草酸组细胞培养基中LDH及MDA含量更高,两者之间比较差异有统计学意义(P<0.05)。
表1实验2h后各组细胞培养基中MDA及LDH含量的比较
Tab.1 Content of MDA and LDH in culture media 2 h after the experiment
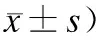
(mmol/mL,
与对照组比较,△P<0.05;与草酸组比较,*P<0.05。

图1实验2h后草酸钙晶体不同程度粘附于各组细胞表面
Fig.1 Calcium oxalate crystals adhering to each cell surface 2 h after the experiment(×200)
A:空白组;B:草酸组;C:尿激酶组。
2.3细胞活力的测定通过检测各组细胞的细胞活力,确定各组细胞的损伤程度。随着时间的推移,各组细胞的活力均有所下降,UK组相对于草酸组细胞活力下降相对缓慢,1 h后草酸组细胞活力下降到(46.2±3.4)%,并逐渐趋于平稳(图2)。
3 讨 论
肾结石的发病机制尚不清楚。肾小管上皮细胞损伤学说一直是被研究的热点,该学说认为体内活性氧增多,导致细胞膜脂质过氧化,肾小管上皮细胞损伤,成石物质的粘附与聚集,最终形成结石[5]。正常细胞之间的紧密连接有利于信号传导和抵御不利因素,细胞受损后,膜丧失极性,磷脂失去非对称性[6],细胞形态发生变化,细胞间的紧密连接消失,细胞防御机制被破坏,从而有利于晶体在细胞表面的成核和生长。机体内,肾小管上皮细胞病理情况下能够产生大量氧自由基,氧自由基对生物膜的主要成分磷脂中不饱和脂肪酸的不饱和键具有很高的亲和力,从而产生过氧化反应,导致细胞损伤。本研究中采用狗肾小管上皮细胞建立细胞损伤模型,经过反复实验最终确立了草酸(5 mmol/L)和尿激酶(UK,10万U)的最佳浓度。

图2各组MDCK在作用不同时间后细胞活力的变化
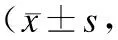
P<0.05vs. 0 h。
草酸和肾结石的关系密切,可促进自由基的生成,引发生物膜的脂质过氧化反应,导致细胞膜的超微结构发生变化,甚至渗入细胞内部,破坏线粒体和DNA结构,引起细胞坏死和凋亡[7]。草酸经肾脏的排泄时,肾小管内草酸浓度增加了10~50倍,高浓度的草酸对肾小管上皮细胞具有直接的毒性作用,使细胞产生氧化性损伤,可造成肾小管上皮细胞的损伤,导致细胞活性下降,引起肾小管上皮细胞的凋亡和坏死,产生的细胞碎片促进草酸钙结晶的核化和聚集。有研究表明,肾小管上皮细胞损伤后,COM晶体的粘附最大可增加20倍[8]。本研究经过反复试验,认为5 mmol/L的草酸为最适损伤浓度。研究结果显示,草酸组对MDCK细胞的损伤比较明显,表现为细胞的增殖受到影响,细胞活力下降,标志细胞损伤的LDH和反映脂质过氧化反应水平的MDA的释放量都显著提高,细胞变得皱缩、表面粗糙,部分细胞脱落,脱落的细胞碎片成为CaOxa晶体成核的理想基质,细胞表面晶体粘附及聚集显著。
UK是一种主要由肾脏细胞分泌的蛋白质,能降解纤维蛋白凝块、血循环中的纤维蛋白原凝血因子V和凝血因子Ⅷ,抑制血小板聚集,因此常用于急性发作的血栓性疾病的治疗。早期有研究证明,尿激酶在肾结石形成过程中起重要的作用,生理状态下可以抑制肾结石的形成,当其浓度降低时,可能促进肾结石形成[9];近年来主要通过基因多态性的方法研究尿激酶与结石的关系。TSAI等[10]用单核苷酸多态性作为工具证明尿激酶3’-UTRT等位基因与结石形成有很高的相关性。我们前期研究表明,肾结石患者血清中UK含量较健康人群低,因此在本实验中,我们于细胞液中加入UK。结果显示,相对于UK组MDCK细胞损伤相对较轻,细胞活性下降幅度降低;LDH及MDA含量升高幅度不及草酸组;细胞表面晶体粘附及聚集也不及草酸组显著。这表明外源性UK能够减轻草酸对肾小管上皮细胞的损伤作用,防止晶体的聚集。
肾小管上皮细胞损伤是肾结石形成的重要前提。尿液中高浓度的草酸能够损伤肾小管上皮细胞,而肾脏所分泌的尿激酶能减轻草酸对肾小管上皮细胞的损伤, 降低晶体在细胞表面的粘附与聚集。通过以上实验结果,我们推测UK可能通过抑制草酸引起的脂质过氧化反应,从而减轻肾小管上皮细胞的损伤。因此,增加肾脏以及尿液中UK的浓度,有助于肾结石的防治,为肾结石的治疗提供了一条新的思路。然而如何提高UK的浓度及UK和草酸的相互作用,本研究尚未涉及,今后将重点研究。
参考文献:
[1] BIGELOW MW, WIESSNER JH, KLEINMAN JG, et al. Calcium oxalate crystal attachment to cultured kidney epithelial cell lines[J]. J Urol, 1998,160(4):1528-32.
[2] VERVAET BA, VERHULST A, DAUWE SE, et al. An active renal crystal clearance mechanism in rat and man[J]. Kidney Int, 2009, 75(1):41-51.
[3] LAUBE N, JANSEN B, HESSE A. Citric acid or citrates in urine: which should we focus on in the prevention of calcium oxalate crystals and stones?[J]. Urol Res, 2002, 30(5):336-41.
[4] 关晓峰,邓耀良,黎承扬,等. 巨噬细胞在高草酸尿症大鼠肾内结石晶体形成过程中的作用[J]. 中华泌尿外科杂志, 2010, 31(2):88-91.
[5] FERRARO PM, GAMBARO G. Ischemic preconditioning and the risk of acute kidney injury[J]. Kidney Int, 2012, 82(2):243.
[6] KHAN SR, MASLAMANI SA, ATMANI F, et al. Membranes and their constituents as promoters of calcium oxalate crystal formation in human urine[J]. Calcif Tissue Int, 2000, 66(2):90-96.
[7] LI CY, DENG YL, SUN BH. Taurine protected kidney from oxidative injury through mitochondrial-linked pathway in a rat model of nephrolithiasis[J]. Urol Res, 2009,37(4):211-20.
[8] 何家扬,周任远,王文章,等. 防石多糖对受损膀胱黏膜的保护作用[J]. 临床泌尿外科杂志,2000,15(11):511-513.
[9] DU TOIT PJ, VAN ASWEGEN CH, STEINMANN CM, et al. Does urokinase play a role in renal stone formation?[J]. Med Hypotheses, 1997, 49(1):57-59.
[10] TSAI FJ, LIN CC, LU HF, et al. Urokinase gene 3’-UTR T/C polymorphism is associated with urolithiasis[J]. Urology, 2002, 59(3):458-461.

