人永生化表皮细胞HaCaT电转染条件的优化
徐 珊,杜 冲,马艳民,谢宏俊,高 杨, 石 琦,王新阳,贺大林,郭 鹏
(西安交通大学医学院:1. 第一附属医院泌尿外科,陕西西安 710061; 2. 环境和疾病相关基因教育部重点实验室, 陕西西安 710061)
HaCaT细胞是一种人永生化表皮细胞系,具有表皮基底层细胞的分化特性,与原代角质形成细胞相同,遗传特性稳定,不具有肿瘤特性[1]。HaCaT细胞可代替人正常角质形成细胞,是皮肤疾病研究中理想的细胞模型,可用于检测各种药物和理化因素对人正常角质形成细胞的影响,是研究上皮性器质病变以及基因功能的理想体外模型[2-3]。
对于上皮性器质病变以及基因功能的研究,大多数实验方法是进行基因治疗,即细胞转染,以达到治疗疾病的目的或者得到目的基因与疾病表现的关系[4]。但是,HaCaT细胞是公认的难转染细胞,我们对已报道有关HaCaT细胞转染的文献进行统计,发现大多实验研究中均使用了病毒介导法[5-6]。
细胞转染方法大致分为两种类型:病毒介导法和非病毒介导法。病毒介导法的优点是具有很好的转染效率,但是存在易发生插入突变、病毒构建时间长、生物安全和经费消耗大等问题。相比较病毒介导法,非病毒介导法虽然转染效率不是很理想,但是费用低,也易操作[7]。
非病毒介导法分为两大类,化学转染方法(DEAE-葡聚糖法、磷酸钙法、人工脂质体法等)和物理转染方法(显微镜注射、基因枪和电转染等)[7-8]。理想的细胞转染技术是可获得高效的转染效率,同时对细胞毒性作用小,可获得较好的细胞存活率。目前,人工脂质体转染虽然应用比较普遍,但是该方法还是存在很多不足,如对细胞毒性大、脂质体会参与调节细胞某些基因的表达、细胞特异性强等缺点[9-11]。电转染法是通过高脉冲电压电击细胞,使细胞膜形成微孔,外源基因能够通过可逆孔洞进入细胞得以表达[12]。电转染方法与脂质体转染法以及病毒介导法相比,有转染效率高、一次可转染大量细胞、残余毒性小、无试剂费用、安全、适用范围广等优点,但电转染需高电压脉冲刺激,会降低细胞的存活率[4,8-9]。
为了获得较好的转染效率和细胞存活率,本研究对电转染技术进行优化,通过改变脉冲电压、脉冲时间、脉冲周期以及电转染前孵育温度,确定人永生化表皮细胞系HaCaT的最佳电转染条件,为该细胞系后续相关研究提供参考依据。
1 材料与方法
1.1细胞培养人永生化表皮细胞系HaCaT购自美国种质保藏中心(American Type Culture Collection)。用含100 mL/L胎牛血清(美国HyClone公司)的RPMI-1640培养基(美国Gibco公司)在37 ℃、50 mL/L CO2培养箱内培养,2.5 g/L胰酶(美国Sigma公司)消化及传代。
1.2质粒及其制备质粒pGPU6/GFP/nev购自上海吉玛制药技术有限公司,将pGPU6/GFP/nev转入DH5α感受态细胞,37 ℃、250 r/min、LB液体培养基培养过夜,QIAGEN质粒提取试剂盒提取质粒,BioTek Epoch超微量微孔板分光光度计测定质粒浓度及质粒纯度,质粒纯度要求达到A260/A280≥1.8。用质粒pGPU6/GFP/nev转染HaCaT细胞,借助绿色荧光蛋白的表达,判断转染效率。
1.3HaCaT细胞最低低渗缓冲液耐受力检测以及细胞直径大小的测量首先,配制90、150、200、250、280 mOsmol/kg的电击缓冲液,配方为KCl 25 mmol/L,KH2PO40.3 mmol/L,K2HPO40.85 mmol/L,肌醇(90、150、200、250、280)mOsmol/kg,pH 7.2。
其次,取对数生长期细胞HaCaT,2.5 g/L胰酶消化细胞,分别用90、150、200、250、280 mOsmol/kg的电击缓冲液悬浮细胞,取一半细胞悬液室温孵育15 min,用细胞计数器(Vi-cellTMXR,Beckman公司)测量细胞直径大小。根据细胞直径大小确定细胞最小脉冲电压,细胞电转染最小脉冲电压表见表1。另一半细胞悬液室温孵育30 min,用细胞计数器统计活细胞数目,选择室温孵育30 min后细胞存活率大于90%的最低等渗溶液作为细胞电击缓冲液。
表1细胞电转染最小脉冲电压表
Tab.1 Minimum pulse voltage of cell electrotransfection

细胞直径(μm)电压(V)2-mm电转杯(室温)电压(V)2-mm电转杯(4℃) 553011001027054015180360201302602511022030901803580160407014045601205050100604080803060
1.4细胞转染电转染仪为Multiporator(德国eppendorf),取对数生长期细胞,用100 mL/L胎牛血清的RPMI-1640悬浮稀释细胞,1 000 r/min离心,弃上清,用1.3最适细胞电转液悬浮细胞,加入质粒,使细胞数为1.5×106cell/mL,质粒浓度为20 μg/mL,轻轻吹打混匀,取400 μL加入到eppendorf 2-mm电转杯中,勿产生气泡,选择不同的电压、脉冲时间、电击次数、脉冲周期等条件组合后电击细胞。电击完毕,室温放置10 min,将细胞悬液加入到60 mm培养皿中,同时加入37 ℃预热的100 mL/L胎牛血清的RPMI-1640培养基4 mL,将细胞放在37 ℃、50 mL/L CO2细胞培养箱内培养,24 h后利用荧光显微镜观察绿色荧光,随机取3个视野做平均值,细胞转染效率=发出绿色荧光的细胞数/可见光下总细胞数×100%。
1.5电转染细胞存活率的统计按照1.5实验方法,选择不同电压、脉冲时间、电击次数、脉冲周期等条件电击HaCaT细胞,未进行任何电击处理的HaCaT细胞作为对照组,不同条件电击处理的HaCaT细胞作为实验组,每组重复5孔,8 000 cell/well,37 ℃、50 mL/L CO2细胞培养箱内培养24 h,MTT法检测细胞存活率。
1.6统计学处理每组实验在相同条件下重复3次,所得组间数据结果用SPSS 16.0统计软件进行数据分析,采用单因素方差分析(ANOVA)进行组间差异比较,P<0.05表示差异有统计学意义。
2 结 果
2.1HaCaT细胞电转液及电转染最低脉冲电压的确定细胞电击缓冲液是细胞电击时使用的液体,不同细胞对电击缓冲液的要求也不一样。电击缓冲液的选择原则一般是:选择细胞存活率大于90%的最低渗透压缓冲液,这是因为低渗缓冲液可降低电导并限制Joule作用,同时使细胞达到最大肿胀程度(达到最大细胞直径),有利于质粒进入细胞,从而获得较高的转染率。
从实验结果表2可见,在90 mOsmol/kg渗透压缓冲液下,HaCaT细胞存活率大于90%,符合电击缓冲液的选择原则,故实验选择90 mOsmol/kg为细胞的电击缓冲液。HaCaT细胞在90 mOsmol/kg缓冲液中细胞直径膨胀为16.44 μm,根据实验表1,可以确定细胞的最小脉冲电压为180 V。
表2不同渗透压缓冲液下HaCaT细胞的存活率和细胞直径
Tab.2 The survival rate and diameter of HaCaT cell in different osmotic pressure buffer

电击缓冲液细胞存活率(%)细胞直径(μm)90mOsmol/kg90.516.44150mOsmol/kg93.816.02200mOsmol/kg95.515.50250mOsmol/kg96.214.86280mOsmol/kg98.614.44
2.2脉冲电压对HaCaT电转率和细胞存活率的影响根据实验结果2.1,在90 mOsmol/kg电击缓冲液下,选择180、360、540、720 V不同电压,40 μs脉冲时间,1个脉冲周期,细胞浓度1.5×106/mL,室温下对细胞进行电转染,细胞培养24 h后统计不同脉冲时间下细胞的转染效率和存活率。
不同电压强度下HaCaT细胞电转效率和细胞存活率见图1。180、360、540、720 V四组不同脉冲电压的转染效率分别为(3.83±0.44)%、(9.87±0.41)%、(20.27±2.17)%、(33.00±1.33)%,并且不同组间电转染效率均有统计学差异(P<0.05)。MTT法检测四组细胞的存活率分别为88.08%、83.38%、47.99%、23.02%。从实验结果可以得到如下结论,随着脉冲电压的不断增加,细胞转染效率不断提高,但细胞存活率却显著下降,而且720 V脉冲电压下,HaCaT细胞生长状态极差。故在其它电转条件一样的前提下,依据电转染效率、细胞存活率和细胞生长状态,540 V的脉冲电压是比较理想的电转染电压。

图1脉冲电压对HaCaT细胞电转染效率和细胞存活率的影响
Fig.1 Effects of electric voltage on HaCaT cell electrotransfection efficiency and survival rate
*P<0.05vs. 180 V;△P<0.05vs. 360 V;▲P<0.05vs. 540 V。
2.3脉冲时间对HaCaT电转率和细胞存活率的影响电转染效率同样受到脉冲时间的影响,这是因为在一定的脉冲电压下,脉冲时间过短,则目的基因不能够有效进入细胞,但是脉冲时间过长,又会导致细胞内外离子交换时间过长,从而引起细胞死亡。
根据实验2.2结果,选择90 mOsmol/kg电击缓冲液,540 V电压,设定40、60、80、100、120 μs不同脉冲时间,1个脉冲周期,细胞浓度1.5×106/mL,室温下对细胞进行电转染,细胞培养24 h后统计不同脉冲时间下细胞的转染效率和存活率。实验结果为40、60、80、100、120 μs五组不同脉冲时间的电转染效率分别为(17.77±0.83)%、(27.60±1.97)%、(30.53±2.48)%、(33.73±4.88)%、(36.07±2.10)%,细胞存活率分别为61.58%、52.36%、34.77%、33.03%、23.22%。实验结果提示,虽然增加脉冲时间可以提高电转染效率,但却使细胞存活率显著下降(图2)。综上所述,在保证细胞存活率的前提下,选择60 μs作为HaCaT细胞电转的最佳脉冲时间。
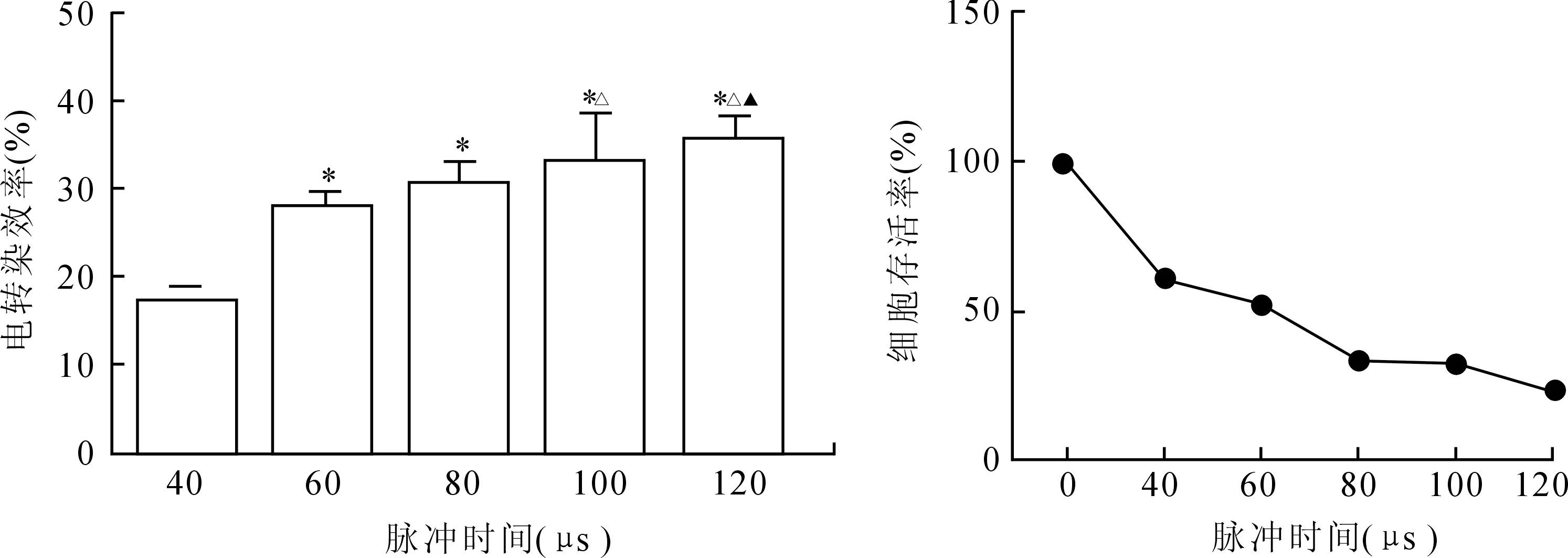
图2脉冲时间对HaCaT细胞电转染效率和细胞存活率的影响
Fig.2 Effects of pulse time on HaCaT cell electrotransfection efficiency and survival rate
*P<0.05vs. 40 μs;△P<0.05vs. 60 μs;▲P<0.05vs. 80 μs。
2.4脉冲周期对HaCaT电转率和细胞存活率的影响增加电转染脉冲周期次数,可以增加细胞膜上的穿孔,从而提高转染率。根据实验2.3结果,选择90 mOsmol/kg电击缓冲液,540 V电压,60 μs脉冲时间,设置1次、2次、3次、4次和5次脉冲周期,1个脉冲周期,细胞浓度1.5×106/mL,室温下对细胞进行电转染,细胞培养24 h后统计不同脉冲周期下细胞的转染效率和存活率。从实验结果可以看出,脉冲周期为2时,转染效率由30.95%提高到32.88%,但无统计学差异(P>0.05),脉冲周期为3次、4次和5次时非但没有增加转染效率,反而导致大量HaCaT细胞死亡(图3)。根据电转染效率和细胞的生存率,选择1次脉冲周期为HaCaT细胞电转染的最佳条件。

图3脉冲周期对HaCaT细胞电转染效率和细胞存活率的影响
Fig.3 Effects of electronic shock cycle on HaCaT cell electrotransfection efficiency and survival rate
*P<0.05vs. 1 T.
2.5脉冲温度对HaCaT电转率和细胞存活率的影响温度对于电转染效率的影响在于低温可使细胞电击后细胞膜修复变慢,延长外源性基因进入细胞的时间,提高外源性基因的摄入量。根据实验2.4结果,选择90 mOsmol/kg电击缓冲液,540 V电压,60 μs脉冲时间,1个脉冲周期,细胞浓度1.5×106/mL,设置室温和4 ℃分别对细胞进行电转染,细胞培养24 h后统计不同脉冲温度下细胞的转染效率和存活率。实验结果见图4。室温和4 ℃电转染效率分别为33.23%和31.93%,统计学显示无统计学差异(P>0.05),故选择室温为HaCaT细胞的电转染温度。

图4脉冲前孵育温度对HaCaT细胞电转染效率和细胞存活率的影响
Fig.4 Effects of pre-pulse incubation temperature on HaCaT cell electrotransfection efficiency and survival rate
A:温度对HaCaT细胞电转染效率和细胞存活率的影响;B:HaCaT细胞电转染后的生长状态。
3 讨 论
本实验为了寻找适合HaCaT细胞电转染的最佳转染条件,我们选择了脉冲电压、脉冲时间、脉冲周期以及电转染前孵育温度等关键条件进行优化以获得目的基因希望的表达水平,为后续基因功能研究奠定基础。
电转染效率受很多因素的影响,外界因素如脉冲电压、孵育温度、脉冲时间和培养基的成分等,还有细胞本身的因素。例如:细胞膜的流动性和细胞生长状态(贴壁生长或者悬浮生长)[13]。脉冲电压是影响电转染效率的一个关键因素。这是因为脉冲电压影响细胞膜通透作用,从而影响细胞膜与目的基因的结合以及吸收[13-15]。本实验结果发现,在其它转染条件不变的情况下,随着脉冲电压的不断升高(180~720 V),HaCaT细胞电转染效率由3.83%提高到33.00%。
研究表明,长时间的脉冲时间比较短脉冲时间更有利于提高细胞电转染效率[16-17]。所以,本实验比较了不同脉冲时间(40~120 μs)对HaCaT细胞电转染效率的影响。实验结果显示,40 μs到120 μs的脉冲时间,HaCaT细胞电转染率可增加大约20%。同时,我们还比较了HaCaT细胞60 μs/Pulse1、60 μs/Pulse2、60 μs/Pulse3、60 μs/Pulse4和60 μs/Pulse5之间的电转染效率,发现60 μs/Pulse2比60 μs/Pulse1电转染效率有所增加。这与LIU等[16]报道第1次脉冲可促使细胞膜形成穿孔,第2次脉冲更有利于目的基因进入细胞,从而提高细胞电转染效率的文献相符合。但是,HaCaT细胞每增加1次脉冲周期,细胞死亡率会直线上升,死亡原因可能为多次脉冲可大大提高细胞通透性,导致细胞内外离子交换过多,引发细胞死亡[9,14]。死亡原因可能为细胞电击之后,由于受到外界环境物理因素的刺激,细胞对环境条件的变化产生应答,启动有序变化的死亡过程,引发细胞死亡[16]。本实验还未对HaCaT细胞电转染细胞死亡的原因进行分析,但是电转染实验中我们发现,高电压、长时间脉冲或多次脉冲周期均会导致HaCaT细胞形态变小变圆,并且贴壁不牢,继续培养后发现,发生形态改变的细胞最终走向了死亡,死亡原因有待进一步验证。所以,本实验在选择最佳HaCaT细胞电转染条件的依据之一是:细胞存活率大于50%,且细胞大小及生长状态未发生明显改变。
电转染与逆转录病毒载体系统相比较,具有操作简单、适用范围广、安全等优点。本实验根据电转染效率和细胞存活率两个因素,最终确定540V/60 μs/Pulse1/RT为HaCaT细胞电转染的最佳条件组合,细胞电转染效率可达到33.23%,细胞存活率为61.22%。应用电转染技术使疾病相关基因在HaCaT细胞中表达,再结合相应抗生素进行阳性细胞筛选,得到稳定表达体系,进而进行目的基因功能分析,可以发现目的基因与疾病表型之间的关系。
参考文献:
[1] SCHOOP VM, MIRANCEA N, FUSENIG NE. Epidermal organization and differentiation of HaCaT keratinocytes in organotypic coculture with human dermal fibroblasts[J]. J Invest Dermatol, 1999, 112(3):343-353.
[2] LEHMANN B. HaCaT cell line as a model system for vitamin D3 metabolism in human skin[J]. J Invest Dermatol, 1997, 108(1):78-82.
[3] SCHURER N, KOHNE A, SCHLIEP V, et al. Lipid composition and synthesis of HaCaT cells, an immortalized human keratinocyte line, in comparison with normal human adult keratinocytes[J]. Exp Dermatol, 1993, 2(4):179-185.
[4] ESCOFFRE JM, PORTET T, WASUNGU L, et al. What is (still not) known of the mechanism by which electroporation mediates gene transfer and expression in cells and tissues[J]. Mol Biotechnol, 2009, 41(3):286-295.
[5] KOIVISTO L, JIANG G, HAKKINEN L, et al. HaCaT keratinocyte migration is dependent on epidermal growth factor receptor signaling and glycogen synthase kinase-3alpha[J]. Exp Cell Res, 2006, 312(15):2791-2805.
[6] YANG Y, TETREAULT MP, YERMOLINA YA, et al. Kruppel-like factor 5 controls keratinocyte migration via the integrin-linked kinase[J]. J Biol Chem, 2008, 283(27):18812-18820.
[7] SONG L, CHAU L, SAKAMOTO Y, et al. Electric field-induced molecular vibration for noninvasive, high-efficiency DNA transfection[J]. Mol Ther, 2004, 9(4):607-616.
[8] SALIMZADEH L, JABERIPOUR M, HOSSEINI A, et al. Non-viral transfection methods optimized for gene delivery to a lung cancer cell line[J]. Avicenna J Med Biotechnol, 2013, 5(2):68-77.
[9] GUO H, HAO R, WEI Y, et al. Optimization of electrotransfection conditions of mammalian cells with different biological features[J]. J Membr Biol, 2012, 245(12):789-795.
[10] GHARTEY-TAGOE EB, BABBIN BA, NUSRAT A, et al. Plasmid DNA and siRNA transfection of intestinal epithelial monolayers by electroporation[J]. Int J Pharm, 2006, 315(1-2):122-133.
[11] KANEDA Y, TABATA Y. Non-viral vectors for cancer therapy[J]. Cancer Sci, 2006, 97(5):348-354.
[12] WU M, YUAN F. Membrane binding of plasmid DNA and endocytic pathways are involved in electrotransfection of mammalian cells[J]. PLoS One, 2011, 6(6):e20923.
[13] MARIJANOVIC I, HABERL S, MIKLAVCIC D, et al. Analysis and comparison of electrical pulse parameters for gene electrotransfer of two different cell lines[J]. J Membr Biol, 2010, 236(1): 97-105.
[14] WOLF H, ROLS M P, BOLDT E, et al. Control by pulse parameters of electric field-mediated gene transfer in mammalian cells[J]. Biophys J, 1994, 66(2 Pt 1): 524-531.
[15] PHEZ E, FAURIE C, GOLZIO M, et al. New insights in the visualization of membrane permeabilization and DNA/membrane interaction of cells submitted to electric pulses[J]. Biochim Biophys Acta, 2005, 1724(3):248-254.
[16] LIU L, JOHNSON C, FUJIMURA S, et al. Transfection optimization for primary human CD8+ cells[J]. J Immunol Methods, 2011, 372(1-2):22-29.
[17] CHOPINET L, BATISTA-NAPOTNIK T, MONTIGNY A, et al. Nanosecond electric pulse effects on gene expression[J]. J Membr Biol, 2013,

