JAK2-STAT3信号通路在舒芬太尼预处理诱导大鼠心肌保护效应中的作用
高燕凤,刘 翔,白 娟,袁 慧,景桂霞
(1.西安交通大学医学院第一附属医院麻醉科,陕西西安 710061; 2.江苏省盐城市第一人民医院麻醉科,江苏盐城 224000)
自MURRY等[1]1986年首次报道了心肌缺血预适应(ischemia preconditioning, IPC)现象,IPC仍是目前证实的最为有效的内源性保护机制。尽管缺血预处理在多种动物模型和人离体心肌细胞实验中都获得了良好效果,但受限于安全及不可操作性等问题,无法进行严格的临床实验,至今仍未发挥令人满意的临床效应。近年来不少研究发现有些药物,如阿片肽、腺苷、缓激肽等,也可以模拟缺血预处理的心肌保护作用,即药物预处理(PPC),对心肌缺血再灌注损伤具有保护效应。舒芬太尼是人工合成阿片类药物,镇痛强度大,可以维持患者手术期间血流动力学稳定,已广泛应用于心脏外科手术。既往研究表明,舒芬太尼预处理可以模拟缺血预处理减轻心肌缺血再灌注损伤,但对其保护机制尚不清楚[2]。近年来Janus激酶2-信号转导与转录激活子3(JAK2-STAT3)通路因在心脏疾病发病机制中的作用而倍受关注,其在缺血预处理的心肌保护机制中发挥重要作用[3],而该通路是否参与了舒芬太尼预处理减轻心肌缺血再灌注损伤,还有待进一步研究。本研究通过观察舒芬太尼预处理对血流动力学、心肌酶、心肌梗死面积以及心肌组织磷酸化STAT3表达的影响,探讨JAK2-STAT3信号通路在舒芬太尼预处理诱导大鼠心肌保护效应中的作用。
1 材料与方法
1.1实验动物健康雄性SD大鼠60只,体质量250~300 g,由西安交通大学医学院实验动物中心提供,许可证号:SCXK(陕2007-001)。
1.2心肌缺血再灌注模型的制备与分组大鼠术前禁食12 h,可自由饮水,腹腔注射200 g/L乌拉坦5 mL/kg 麻醉。将大鼠固定在实验台上,呈仰卧位,四肢皮下连接电极,记录Ⅱ导联心电图。颈部去毛消毒皮肤,行颈动脉穿刺置管,监测动脉压。行气管切开插管,接小动物呼吸机辅助呼吸,呼吸次数60~80次/min,6~7 mL/次,呼吸比1∶3,按照大鼠呼吸频率及胸廓起伏程度调整呼吸参数。使用加热毯将体温维持在(37±1)℃。于左胸第3~5肋间打开大鼠胸腔后,剪开心包膜充分暴露心脏,找到左冠状动脉前降支,用6-0无损伤缝线穿过心脏表层,以橡皮筋垫底,双线结扎前降支,造成心肌缺血30 min后,松开结扎线,恢复血流120 min。以心电图显示ST段抬高、QRS波变高变宽和心肌变为青紫色为结扎成功的标准。
采用随机数字表法,将大鼠分为5组(n=12)。假手术组(S组)只穿线,不结扎左冠状动脉前降支,持续150 min;缺血再灌注组(I/R组)结扎左冠状动脉前降支缺血30 min,恢复灌注120 min;舒太尼预处理组(SPC组):缺血前采用股静脉泵注舒芬太尼(批号060337,DGSWRodleben公司,德国)1 μg/kg,泵注5 min,间隔5 min,重复处理3次,总量共3 μg/kg,缺血30 min,恢复灌注120 min;舒芬太尼预处理联合JAK2激酶抑制剂组(S+A组)在舒芬太尼预处理前5 min给予JAK2激酶抑制剂AG490(1 mg/kg),缺血前30 min给予舒芬太尼预处理,缺血30 min,恢复灌注120 min;JAK2激酶抑制剂组(A组)则缺血前35 min给予JAK2激酶抑制剂AG490(1 mg/kg),缺血30 min,恢复灌注120 min。除S+A组,其余各组大鼠缺血前经股静脉泵注与舒芬太尼溶剂和抑制剂溶剂等量的生理盐水,分别为0.5 mL和0.3 mL。
1.3血流动力学监测于心肌缺血前30 min(T0)、缺血前即刻(T1)、缺血30 min(T2)、再灌注30 min(T3)和再灌注120 min(T4)时记录各组大鼠心率(HR)和平均动脉压(MAP)。
1.4血清肌酸激酶同工酶(CK-MB)和乳酸脱氢酶(LDH)浓度的测定于大鼠再灌注120 min时,快速解剖大鼠腹腔,取腹主动脉血3 mL,4 ℃、4 000 r/min离心10 min,取上清液分装,-80 ℃ 保存。ELISA法测定血清CK-MB和LDH活性。
1.5心肌梗死面积的测定除假手术组(即A组)外,各组取6只大鼠,于心肌缺血再灌注末,再次结扎左冠状动脉前降支,从主动脉内注入50 g/L伊文氏蓝1 mL,非缺血区心肌呈深蓝色。剪取心脏,滤纸吸干后分离出左心室,置-20 ℃冰箱备用。将速冻后的心脏从心尖到心基部平行于房室沟方向将心脏切成5~6片,厚约2 mm。置于2 mL 1%氧化三苯基四氨唑(pH 7.4)中,在37 ℃孵育20 min,置于100 mL/L甲醛溶液中固定15 min,拍照,红色为危险区,白色为梗死区。采用Image-Pro Plus 6.0图像分析软件(Media Cybernetics公司,美国)测量危险区(area at risk, AAR)和梗死区(infarct size, IS)的面积,并以心肌重量校正心肌组织缺血危险区和梗死区面积。各心肌切片与心肌重量乘积的总和为左室面积(LV)。心肌梗死面积(IS)为每一片心肌梗死面积与心肌重量乘积的总和;心肌缺血危险区范围(AAR)为每一片心肌缺血区域面积与心肌重量乘积的总和。心肌缺血危险区范围用AAR与LV比值(AAR/LV,%)表示,心肌梗死的严重程度以IS与AAR比值 (IS/AAR,%)表示。
1.6Westernblot法检测心肌磷酸化STAT3(P-STAT3)的表达取100 mg心肌组织,用1 mL RIPA裂解液+蛋白酶抑制剂PMSF提取心肌总蛋白,核蛋白提取参考试剂盒说明。然后用BCA蛋白定量试剂盒测定蛋白浓度。取80 μg蛋白样品加入5×上样缓冲液加热煮沸5 min,样品变性后,进行SDS-PAGE电泳(100 g/L分离胶,30 g/L浓缩胶)分离,然后将蛋白转移至NC膜上,用50 g/L脱脂牛奶室温封闭2 h,加入1∶800稀释的兔抗P-STAT3抗体
(Cell Signaling公司,美国),4 ℃孵育过夜;TBST 3×10 min洗膜后,分别加入1∶4 000稀释的兔源二抗(Santa Cruz公司,美国),室温孵育2 h;再次TBST 3×10 min洗膜,用化学发光检测试剂盒检测,Quantity One凝胶分析软件分析图像,以目的蛋白条带灰度值与内参GAPDH灰度值的比值反映目的蛋白的表达水平。

2 结 果
2.1血流动力学指标各组HR之间差异无统计学意义。与T0时相比,除S组外,其余各组T2~T4时MAP降低(P<0.05);与S组相比,其余各组T2~T4时MAP降低(P<0.05或P<0.01);T2~T4时SPC组MAP数值较I/R组稍高,但差异无统计学意义(图1、表1)。
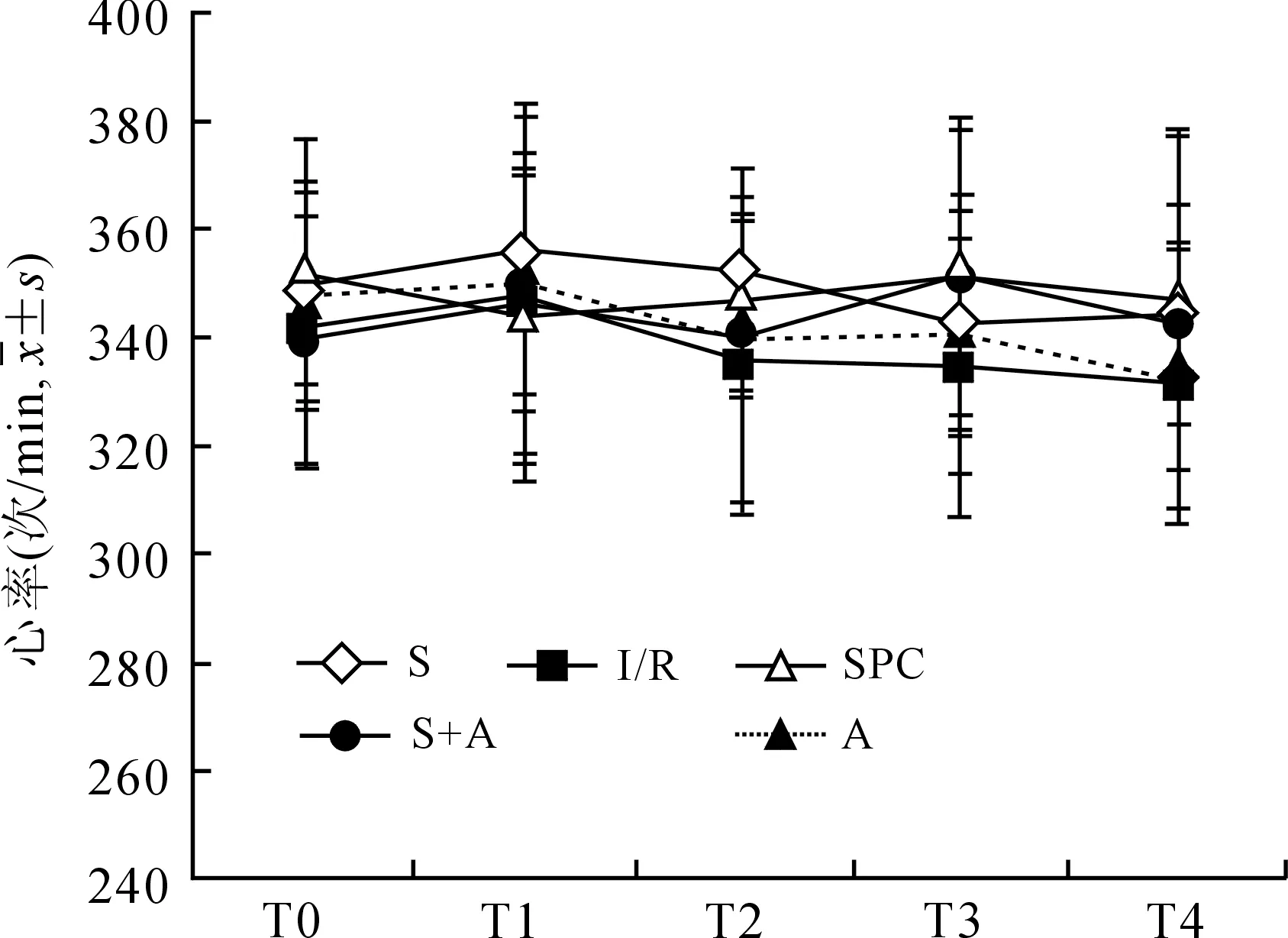
图1各组大鼠不同时间点心率(次/min)变化
Fig.1 HR changes at different time points in each group
表1各组大鼠不同时间点MAP变化
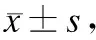
与T0比较,#P<0.05;与S组比较,*P<0.05,**P<0.01。
2.2血清CK-MB和LDH活性与S组相比,其余各组大鼠血清CK-MB和LDH活性明显增高(P<0.01);与I/R组相比,SPC组CK-MB和LDH活性降低(P<0.01,图2)。
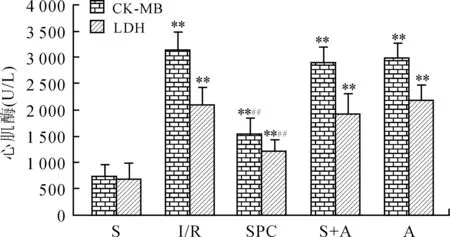
图2各组大鼠心肌缺血再灌注后CK-MB和LDH的变化
Fig.2 CK-MB and LDH changes after myocardial ischemia-reperfusion in each group
与S组比较,**P<0.01;与I/R组比较,##P<0.01。
2.3心肌梗死面积测定各组大鼠心肌缺血范围差异无统计学意义,SPC组心肌梗死范围小于I/R组(P<0.01),I/R组、S+A组和A组之间心肌梗死范围差异无统计学意义(P>0.05,表2)。
表2各组大鼠心肌梗死范围比较
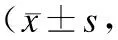

与I/R组比较,##P<0.01。
2.4心肌组织磷酸化STAT3表达与S组比较,I/R组和SPC组P-STAT3表达上调(P<0.01),S+A组和A组差异无统计学意义(P>0.05);SPC组P-STAT3表达上调高于I/R组(P<0.01,图3)。
3 讨 论
研究心肌缺血再灌注时常采用全心缺血再灌注模型和左心室局部心肌缺血再灌注模型,制备左心室局部心肌缺血再灌注模型时多采用阻断冠状动脉左前降支实现[4]。由于大鼠冠状动脉侧支循环少,模型制备成功率高,可重复性好,左心室局部心肌缺血再灌注模型被认为是制备心肌缺血再灌注的首选模型。本研究结果显示,缺血再灌注组血清CK-MB和LDH活性增高,缺血危险区占左室的50%左右,梗死区占缺血危险区的46%左右,表明大鼠在体心肌缺血再灌注模型制备成功。
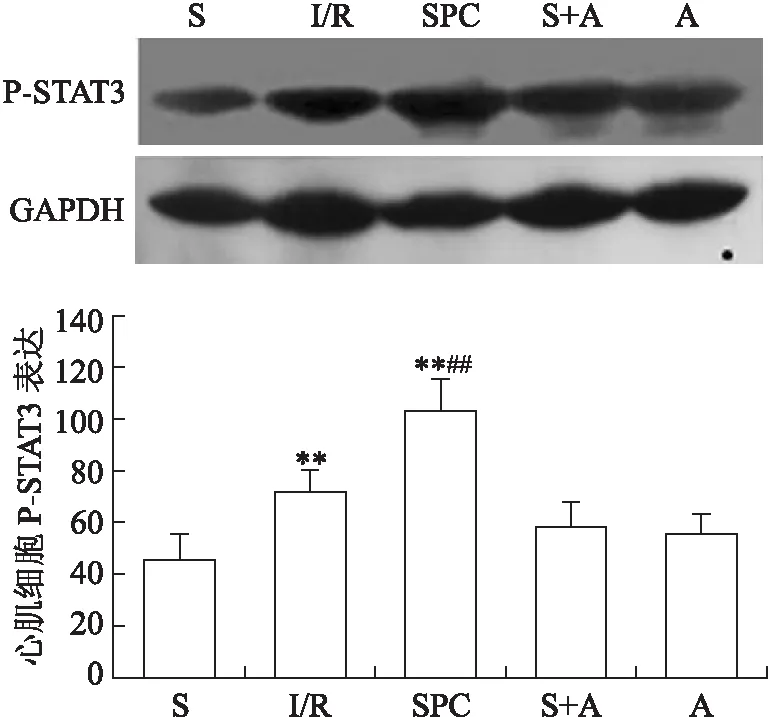
图3各组大鼠心肌组织磷酸化STAT3表达水平比较
Fig.3 Comparison of myocardial phosphorylated STAT3 expression of rats in different groups
与S组比较,**P<0.01;与I/R组比较,##P<0.01。
既往研究表明缺血前给予舒芬太尼间隔5 min,重复处理3次同样能够减少心肌缺血再灌注损伤[5-6]。临床中采用舒芬太尼8~50 μg/kg大剂量维持心血管等大型手术;复合麻醉中如“快通道”心脏麻醉手术中舒芬太尼的诱导剂量为1~4 μg/kg[7];普外手术中常给予舒芬太尼0.1~2 μg/kg诱导插管。本实验参照临床手术中舒芬太尼的最小诱导剂量0.1~2 μg/kg和药理研究中剂量的选择方法,并根据人与大鼠药物等效剂量换算公式,模拟既往实验中舒芬太尼预处理方式,选择缺血前泵注舒芬太尼(1 μg/kg)5 min,间隔5 min,反复处理3次,总量3 μg/kg的预处理方式。本研究依据文献[8],选择JAK2激酶抑制剂AG490的给药时间、给药剂量及给药途径。
CK-MB和LDH的心肌特异性高,分子质量大,半衰期长,是判断心肌损伤的常用生化指标。本研究结果表明,缺血再灌注后心肌细胞损伤导致大量心肌酶释放入血,血清CK-MB和LDH活性明显增高;给予舒芬太尼预处理后,血清中CK-MB和LDH活性明显降低,表明舒芬太尼能够减少缺血再灌注引发的心肌细胞损伤,产生心肌保护作用。此外,减少心肌梗死面积是衡量一种保护措施有效的金指标,既往大量实验都采用此指标。本研究采用Even’S Blue-TTC染色法测定再灌注120 min后心肌梗死面积,严格按照心电图和心肌颜色变化判断冠脉是否恢复灌注,结果显示舒芬太尼预处理组心肌梗死范围明显较缺血再灌注组减少,提示可减少缺血再灌注损伤。
JAK-STAT通路主要由JAKs蛋白家族和STATs蛋白家族组成,其中JAK是STAT的上游共有激酶,接受细胞外细胞因子的信号刺激并通过调控基因转录,转化为各种生物反应,JAK-STAT通路广泛参与了细胞应激、生长、增殖、分化和凋亡等。有研究表明,心肌组织在缺血再灌注的损伤后可诱发多种细胞炎性介质及因子的产生,可进一步激活JAK2,启动JAK2/STAT3信号转导通路,使STAT3磷酸化并转入细胞核内,诱导目的基因进一步表达,转录合成Bcl-2等多种抗凋亡蛋白发挥心肌保护作用[9]。STAT3是JAK2的靶蛋白,通常情况下存在于细胞质内,在JAK2被活化后,信号通过JAK2/STAT3通路传导,使STAT3磷酸化而被激活,使P-STAT3表达增强,然后转入细胞核内,诱导目的基因的进一步表达,通过转录合成多种效应蛋白发挥作用。既往研究证实JAK2- STAT3信号通路在缺血预处理和多种药物预处理中发挥了重要作用[10-13]。本研究发现舒芬太尼预处理组和缺血再灌注组心肌磷酸化STAT3表达水平均较假手术组明显增加;与缺血再灌注组相比,舒芬太尼预处理组磷酸化STAT3表达水平增加更为显著,且两者之间差异存在统计学意义;在舒芬太尼预处理前给予JAK2激酶抑制剂AG490 1 mg/kg后,心肌组织磷酸化STAT3表达水平下调,舒芬太尼的心肌保护效应也被抑制;单独应用AG490,心肌磷酸化STAT3表达水平与假手术组的差异无统计学意义,对心肌缺血再灌注损伤没有影响。这表明舒芬太尼预处理可能通过上调磷酸化STAT3的表达,产生了心肌保护作用,单独应用AG490未增加缺血再灌注损伤。
JAK2-STAT3信号通路通过下游众多靶点发挥作用,如GSK-3β、mTOR、NF-κB、eNOS以及Bcl-2家族等[14]。缺血预处理可以激活JAK2-STAT3通路,上调24 h后COX-2及iNOS等保护蛋白,发挥延期保护作用[10]。舒芬太尼预处理激活JAK2-STAT3信号通路的下游具体保护机制仍需进一步研究。
参考文献:
[1] MURRY CE, JENNINGS DB, REIMER KA. Precondition with ischemia, a delay of lethal cell injury in ischemia myocardium[J]. Circulation, 1986, 74(5):1124-1136.
[2] LEMOINE S, ZHU L, MASSETTI M, et al. Continuous administration of remifentanil and sufentanil induces cardioprotection in human myocardium,invitro[J]. Acta Anaesthesiol Scand, 2011, 55(6):758-764.
[3] ZHANG M, WANG X, WANG X, et al. Oxymatrine protects against myocardial injury via inhibition of JAK2/STAT3 signaling in rat septic shock[J]. Mol Med Rep, 2013, 7(4):1293-1299.
[4] JIANG X, SHI E, NAKAJINM Y, et al. COX-2 mediates morphine-induced delayed cardioprotection via all iNOS-dependent mechanism[J]. Life Sci, 2006, 78(22):2543-2549.
[5] 孙海涛,薛富善,刘鲲鹏,等. COX-2和mito-KATP通道在舒芬太尼预处理对心肌缺血再灌注大鼠延迟性心肌保护中的作用[J]. 中华麻醉学杂志, 2010, 30(4):456-460.
[6] 张冬梅,侯春丽,常业恬,等.舒芬太尼预处理对缺血再灌注大鼠心肌梗死范围及心肌酶的影响[J]. 实用医学杂志, 2009, 25(15):2430-2433.
[7] ENGOREN M, LUTHER G, FENN-BUDERER N. A comparison of fentanyl, sufentanil, and remifentanil for fast-track cardiac anesthesia[J]. Anesth Analg, 2001, 93(4):859-864.
[8] LEMOINE S, ZHU L, LEGALLOIS D, et al. Atorvastatin-induced cardioprotection of human myocardium is mediated by the inhibition of mitochondrial permeability transition pore opening via tumor necrosis factor-α and Janus kinase/signal transducers and activators of transcription pathway[J]. Anesthesiology, 2013, 118(6):1373-1384.
[9] TIAN Y, ZHANG W, XIA D, et al. Postconditioning inhibits myocardial apoptosis during prolonged reperfusion via a JAK2-STAT3-Bcl-2 pathway[J]. J Biomed Sci, 2011, 18(1):53-53.
[10] BARRY SP, TOWNSEND PA, LATCHMAN DS, et al. Role of the JAK-STAT pathway in myocardial injury[J]. Trends Mol Med, 2007, 13(2):82-89.
[11] DUAN W, YANG Y, YAN J, et al. The effects of curcumin post-treatment against myocardial ischemia and reperfusion by activation of the JAK2/STAT3 signaling pathway[J]. Basic Res Cardiol, 2012, 107(3):263-263.
[12] DAS A, SALLOUM FN, DURRANT D, et al. Rapamycin protects against myocardial ischemia-reperfusion injury through JAK2-STAT3 signaling pathway[J]. J Mol Cell Cardiol, 2012, 53(6):858-869.
[13] LUAN HF, ZHAO ZB, ZHAO QH, et al. Hydrogen sulfide postconditioning protects isolated rat hearts against ischemia and reperfusion injury mediated by the JAK2/STAT3 survival pathway[J]. Braz J Med Biol Res, 2012, 45(10):898-905.
[14] GROSS ER, HSU AK, GROSS GJ. The JAK/STAT pathway is essential for opioid-induced cardioprotection: JAK2 as a mediator of STAT3, Akt, and GSK-3 beta[J]. Am J Physiol Heart Circ Physiol, 2006, 291(2):H1827-H1834.

