CXCR7-shRNA靶向抑制结肠癌SW620细胞的体外实验研究
王 鑫,陈 玲,孙 飞,陆 航
(辽宁医学院附属第一医院:1.急诊科;2.胃肠外科,辽宁锦州 121001)
结直肠癌是目前我国最常见的恶性肿瘤之一,死亡率高于世界平均水平。早期发生的侵袭转移是影响结直肠癌患者预后及生存的主要因素,治疗效果和临床预后不是十分理想[1-2]。随着基因治疗的发展,从分子水平来阻断侵袭转移的基础和环境是目前肿瘤治疗研究的前沿。因此,我们需要深入地了解结直肠癌的转移机制并寻找有效的诊断标志物和新的治疗位点[3-4]。
趋化因子(chemokines)是一类最先发现表达于免疫细胞、控制其定向炎症区域迁移的细胞因子[5]。研究显示,趋化因子及其受体在肿瘤的增殖、转移过程中扮演着重要的角色[6]。有研究发现,CXC趋化因子12(CXC chemokine ligand 12, CXCL12)和CXC趋化因子受体4(CXC chemokine receptor 4, CXCR4)之间的相互作用是肿瘤侵袭转移和增殖的关键生物学行为。然而,最近的研究表明,在前列腺癌或乳腺癌中发现了CXCL12的另一个趋化因子受体CXCR7(CXC chemokine receptor 7, CXCR7)也可以提高肿瘤细胞的增殖和侵袭转移能力[7-8]。在前期研究中,我们发现从人结直肠癌组织中可检测到大量的CXCR7蛋白的表达,相比于正常组织及癌旁组织有显著的提高,由此可以推测CXCR7可能在结直肠癌的发生发展过程中发挥重要的生物学作用。
RNA干扰(RNA interference, RNAi)技术联合慢病毒载体(lentiviral vector)为内源性功能基因研究和治疗提供了新的策略[9-10]。本研究将构建人CXCR7的慢病毒小发卡或短发卡RNA(small hairpin RNA or short hairpin RNA, shRNA)沉默表达载体,检测转染SW620细胞后对其增殖与转移功能的影响,为后续研究以CXCR7/CXCL12生物学轴为靶点的肿瘤基因治疗打下良好基础。
1 材料与方法
1.1实验试剂pSilencerTM4.1慢病毒载体系统、Lipofectamine 2000试剂购自Invitrogen公司;HEK293T细胞株、人结肠癌细胞株SW620购自中科院细胞库;1640细胞培养基、胎牛血清购自Gibco公司;限制性核酸内切酶、DNA连接酶、质粒小提试剂盒、RT-PCR一步法试剂盒、凝胶回收试剂盒等购自TaKaRa公司;兔抗人CXCR7单克隆抗体、二抗、内参照等购自Santa Cruz公司;其他常规试剂由辽宁医学院附属第一医院中心实验室提供。
1.2引物设计与合成根据GenBank(NM_020311)显示的人CXCR7序列设计3对shRNA沉默序列引物及1对阴性对照序列,经美国国立生物技术信息中心(NCBI)的数据库进行序列检索,结果其他基因序列无同源性,引物的设计与合成由TaKaRa公司完成(表1)。
表1CXCR7-shRNA引物序列
Tab.1 CXCR7-shRNA primer sequence

名 称序列(5'~3')CXCR7-shRNA-1-FTCCCGACTTCATCTTTGCTCGACCXCR7-shRNA-1-RTCATCTTTGCTCGAGCAAAGATGCXCR7-shRNA-2-FTAGATAACTACACCGAGGAAATCCXCR7-shRNA-2-RTGCATTACTCGAGTAATGCAATAGCXCR7-shRNA-3-FTGTCCTGCTATTGCATTACTCGCACXCR7-shRNA-3-RTCCTGCTATTGCATTACTCGAGTGNegative-FTGCGCGCTTTGTAGGATTCGCTCTANegative-RTCGAGAAAAAGCGCGCTTTGTAGA
1.3CXCR7-shRNA重组慢病毒表达载体的构建与包装构建如下反应体系合成CXCR7-shRNA-1:10×Taqbuffer 2 μL,上下游引物各5 μL,TaqDNA聚合酶1 μL,超纯水7 μL,合成双链oligo片段;根据慢病毒载体系统试剂盒说明,将pSilencerTM4.1载体线性化后纯化回收,与上述构建完成的CXCR7-shRNA-1片段连接后转化大肠杆菌DH5α,挑取阳性克隆后扩增提取DNA片段,线性化后利用Lipofectamine 2000试剂转染HEK293T细胞进行慢病毒包装并进行滴度测定。同理构建另外两组CXCR7-shRNA慢病毒载体及阴性对照。
1.4慢病毒表达载体的效率测定常规培养人结肠癌细胞SW620,将上述3组实验病毒液及1组对照病毒液分别以最佳感染指数(MOI=50)转染后,培养48~72 h,待到细胞发生细胞病变效应(cytopathic effect, CPE)后分别提取各组细胞的总RNA,按照RT-PCR一步法试剂盒说明书操作,10 g/L琼脂糖凝胶电泳后,使用凝胶成像系统分析条带吸光度值(A值)。重复上述实验3次,选取沉默效率最高的一组病毒液作为转染SW620的实验组病毒液。
1.5转染慢病毒后SW620细胞增殖的检测常规培养人结肠癌细胞SW620,传至第3代对数生长期,于96孔板上接种,转染上述沉默效率最高的慢病毒液(实验组),同时选取空白对照,每孔加入MTT溶液(5 mg/mL)20 μL,37 ℃温箱孵育4 h后,弃上清,每孔加入150 μL DMSO;在酶标仪上以波长490 nm测定各孔光吸收值,绘制细胞增殖曲线。
1.6SW620细胞划痕实验将生长状态良好的第3代SW620细胞接种于6孔板中培养24 h,用1 000 μL枪头在培养板中划一直线,形成无细胞区域,再加入含沉默效率最高的慢病毒液(实验组)和不加慢病毒液的培养基(空白对照组)分别培养细胞,在孵育0、24、48 h分别采集图像。在图像中划痕的上、中、下3个位置,测量细胞“裸露”区域的宽度,并计算其平均值。用细胞迁移指数(migration index, MI)表示细胞迁移的快慢。
1.7转染慢病毒后SW620细胞中CXCR7蛋白表达的检测将沉默效率最高的一组慢病毒液作为实验组(A),与空病毒载体组(B)、空白组(C)分别转染第3代SW620细胞后培养72 h,提取各组细胞总蛋白并定量;配制80 g/L分离胶与50 g/L浓缩胶,加样后以60V-30 min,100V-1.5 h进行电泳;转膜后丽春红复染,洗脱3次孵育一抗(1∶1 000,兔抗人单克隆抗体)4 ℃过夜;孵育二抗(1∶1 500,羊抗兔多克隆抗体)室温1h;用BCIP/NBT染色工作液避光室温孵育3 h,凝胶成像系统分析膜上目的条带和内参照条带。重复3次测A值,计算净吸光度值。

2 结 果
2.1CXCR7-shRNA慢病毒载体的构建及包装结果构建成功的3组慢病毒载体pSilencerTM 4.1-CXCR7-shRNA及1组阴性对照序列经测序检测显示无碱基突变,4组序列与预期DNA序列相符,说明合成的CXCR7-shRNA沉默序列插入正确,DNA重组成功,可进行后续实验。测序由TaKaRa公司完成。慢病毒包装系统转染HEK293T细胞后72 h,荧光显微镜下可见绿色荧光表达,同时出现CPE现象:细胞触角回收、肿胀变圆,一部分细胞脱落,悬浮于视野中(图1、图2)。病毒滴度测定为:CXCR7-shRNA-1,3.16×108pfu/mL;CXCR7-shRNA-2,4.27×108pfu/mL;CXCR7-shRNA-3,3.93×108pfu/mL;阴性对照2.95×108pfu/mL,均符合慢病毒RNAi实验要求,可进行后续转染实验。
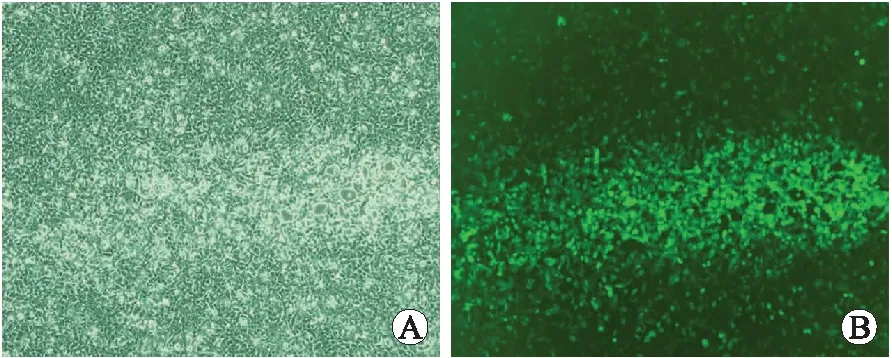
图1慢病毒载体转染HEK293T细胞后72h病毒包装的观察
Fig.1 Virus package of lentivirus vector transfection into HEK293T cell 72 hours later observed under common and fluorescence inverted microscopes (×40)
A:普通倒置显微镜观察转染效果;B:荧光倒置显微镜观察转染效果。
2.2慢病毒载体干扰效率的测定结果RT-PCR结果显示,SW620细胞转染3组CXCR7-shRNA及1组阴性对照后,A、B、C 3个实验组的CXCR7 mRNA表达量相对于对照组(D组)明显减少,差异有统计学意义(P<0.05)。其中CXCR7-shRNA-1转染组(A组)的CXCR7 mRNA表达量明显低于其他2实验组(B、C组),差异同样具有统计学意义(P<0.05),说明CXCR7-shRNA-1组(A组)对于结肠癌细胞SW620的CXCR7 mRNA的抑制率高于另外2组。因此,我们将选择CXCR7-shRNA-1作为后续实验的实验组(图2)。
2.3转染慢病毒后SW620细胞增殖的检测结果两组SW620细胞分别在培养24、48、72、96、120 h后用MTT法检测细胞密度(A值),并根据酶标仪检测的A值绘制细胞增殖曲线。结果表明,空白对照组(B组)SW620细胞生长迅速,实验组(A组)经慢病毒液转染后细胞增殖程度显著减少,与B组相比有统计学差异(P<0.05),说明慢病毒载体抑制CXCR7基因表达后可显著抑制结肠癌细胞SW620的增殖(图3)。
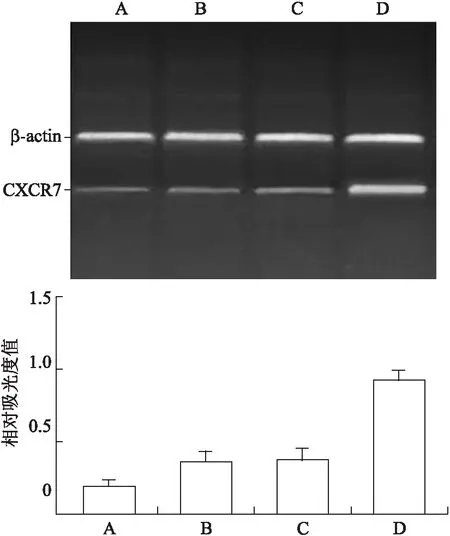
图2RT-PCR检测CXCR7mRNA的表达
Fig.2 CXCR7 mRNA expression detected by RT-PCR
A:CXCR7-shRNA-1;B:CXCR7-shRNA-2;C:CXCR7-shRNA-3;D:Negative-Control。
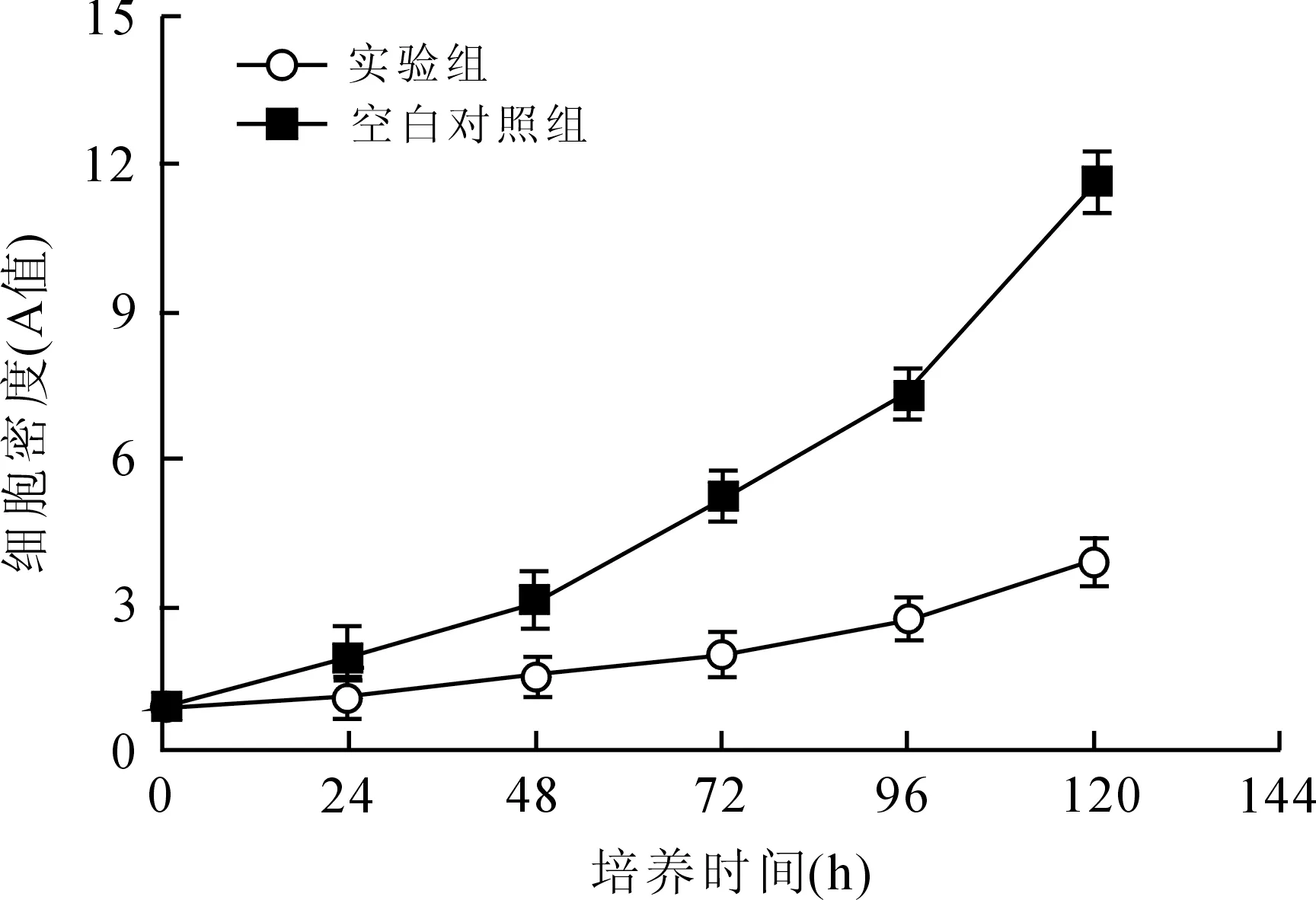
图3转染病毒后各时间段SW620细胞增殖生长曲线
Fig.3 SW620 cell proliferation and growth curve after virus transfection
2.4转染慢病毒后SW620细胞迁移的检测结果SW620细胞在划痕24 h后,空白对照组和实验组的细胞迁移指数(MI)分别为(49.92±6.41)%和(29.13±5.38)%,两者相比有统计学意义(P<0.05),划痕48 h后,空白对照组与实验组的MI分别为(96.52±7.44)%和(72.03±8.29)%,两者相比有统计学意义(P<0.05)。提示,慢病毒液CXCR7-shRNA可以使SW620细胞的远处迁移指数降低,进一步降低结肠癌细胞的细胞迁移能力(图4)。
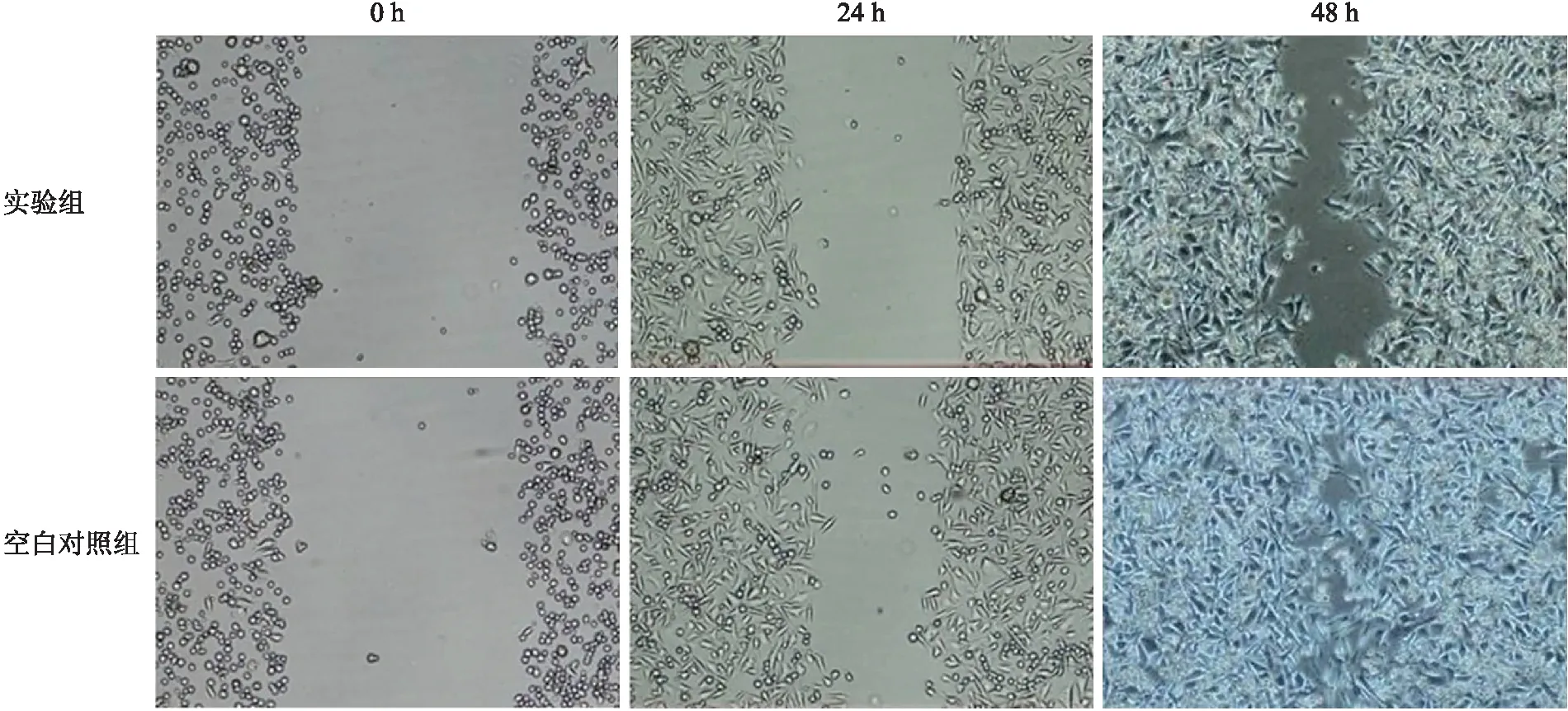
图4CXCR7-shRNA对结肠癌细胞SW620迁移的影响
Fig.4 Effects on CXCR7-shRNA on SW620 cell migration of colon cancer(×40)
MI=100%(g0-gt)/g0,g0是指划痕后立即采集图像(0 h)时划痕处“裸露”区测量的宽度,gt是指从划痕细胞培养t h后采集图像时划痕处“裸露”区测量的宽度。
2.5转染慢病毒后SW620细胞CXCR7蛋白的表达结果Western blot检测结果可见,空病毒载体组(B)与空白组(C)CXCR7蛋白表达量明显高于实验组(A),具有统计学意义(P<0.05),而B、C两组之间相比无统计学差异(P>0.05,图5)。

图5Westernblot检测CXCR7蛋白表达
Fig.5 CXCR7 protein expression detected by Western blot
A:基因沉默实验组;B:空病毒载体组;C:空白组。
3 讨 论
恶性肿瘤的生长和转移是一个极其复杂的过程,肿瘤细胞的异常增殖和远处侵袭是结直肠癌发生发展的关键步骤,其关键因子可以用来作为临床靶向治疗的研究目标[11]。趋化因子及其受体在多种肿瘤的增殖和远处转移中发挥了关键的作用,尤其是CXCL12-CXCR4/CXCR7生物学轴。与CXCR4类似,CXCR7也是人类免疫缺陷病毒(human immunodeficiency virus, HIV)感染CD4+淋巴细胞的协同受体[12]。目前的研究发现,配体活化的CXCR7可以极大的提高肿瘤细胞的生长增殖、粘附和转移侵袭能力[13]。有研究表明,在高侵袭性的前列腺癌组织中CXCR7表达上调,而在采用CXCR7因子拮抗剂之后也可以抑制乳腺癌与肺癌的生长和转移[14-15]。
shRNA是具有紧密发卡环结构的RNA序列,常被应用于RNAi技术特异性沉默靶基因的表达[16]。本实验充分考虑了shRNA转染成本低廉、转染持久性及稳定性好等特点,选择其构建慢病毒载体介导的CXCR7-shRNA进行基因沉默实验。在载体构建成功后,以载体中含有的增强型绿色荧光蛋白(enhanced green fluorescence protein, EGFP)作为示踪因子,在病毒包装后能够很方便的通过荧光显微镜检测包装效果。实验结果表明,3组CXCR7-shRNA慢病毒载体与阴性对照组在荧光显微镜下均有大量绿色荧光表达,表明携带有EGFP的慢病毒表达载体包装成功,且转染效率均可达80%以上。
RT-PCR检测结果说明,实验组的3种重组慢病毒载体CXCR7-shRNA转染至结肠癌SW620细胞后,不同程度上使细胞内CXCR7的mRNA表达量降低,相对于阴性对照组有明显的统计学意义,说明实验组转染SW620细胞成功,并成功抑制了该细胞中的CXCR7 mRNA的表达。从3组实验组的CXCR7 mRNA表达量比较来看,CXCR7-shRNA-1组的抑制率比其他两组略高,差异具有统计学意义,说明CXCR7-shRNA-1组的沉默效果最好,可用于后续转染实验。
在对SW620增殖抑制方面,我们通过MTT的方法发现转染病毒后的24、48、72、96、120 h这5个时间段内,空白组(B组)癌细胞生长增殖迅速,呈现出对数上升的趋势,而将实验组(A组)转染后肿瘤细胞增殖程度显著减少,与B组相比有统计学差异,说明重组慢病毒载体CXCR7-shRNA-1通过抑制CXCR7基因表达后可进一步抑制结肠癌细胞SW620的增殖,证明了CXCR7基因在结肠癌的生长增殖过程中起到一定作用。
肿瘤细胞的侵袭和迁移是肿瘤进展的一个十分重要的环节[17]。我们通过细胞划痕实验研究发现,重组慢病毒载体CXCR7-shRNA-1能够使SW620细胞的MI降低超过20%,能够抑制SW620细胞划痕的愈合的能力,即抑制结肠癌细胞的远处侵袭和迁移能力,这是对于重组慢病毒载体CXCR7-shRNA-1对肿瘤细胞迁移能力影响的十分重要的结论。
对于CXCR7蛋白表达检测结果来说,Western blot实验证实,实验组(A)转染至结肠癌细胞SW620后,可以使细胞中的CXCR7蛋白表达量降低,相对于空病毒载体组(B)和空白组(C)有明显的统计学意义;而空病毒载体组和空白组比较,CXCR7的蛋白表达量没有明显的变化,两者之间差别没有统计学的意义。结果证明,我们成功将shRNA片段转染进SW620细胞,并成功抑制了细胞内部CXCR7蛋白的表达。由此可以推断,CXCR7基因在结肠癌的增殖与侵袭转移的机制中可能起到重要的作用,而通过慢病毒载体抑制CXCR7基因的表达对于我们下一步研究以CXCR7/CXCL12生物学轴为靶点的结直肠癌基因治疗打下了良好的基础,为该病毒载体的抗肿瘤效应提供了新的证据,为结直肠癌的基因治疗提供了新的治疗选择。
参考文献:
[1] LI FY, LAI MD. Colorectal cancer, one entity or three[J]. J Zhejiang Univ Sci B, 2009, 10(3):219-229.
[2] SZAJDA SD, JANKOWSKA A, ZWIERZ K. Carbohydrate markers in colon carcinoma[J]. Dis Markers, 2008, 25(4-5):233-242.
[3] LU H, SUN HZ, LI H, et al. The clinicopathological significance of Bmi-1 expressionin pathogenesisand progression of gastric carcinomas[J]. Asian Pac J Cancer Prev, 2012, 13(7):3437-3441.
[4] FRIEDEN TR, MYERS JE, KRAUSKOPF MS, et al. A public health approach to winning the war against cancer[J]. Oncologist, 2008, 13(12):1306-1313.
[5] WANG Y, Li G, STANCO A, et al. CXCR4 and CXCR7 have distinct functions in regulating interneuron migration[J]. Neuron, 2011, 69(1):61-76.
[6] LIU L, ZHAO X, ZHU X, et al. Decreased expression of miR-430 promotes the development of bladder cancer via the upregulation of CXCR7[J]. Mol Med Rep, 2013, 8(1):140-146.
[7] SCHANZ A, BASTON-BUST D, KRUSSEL JS, et al. CXCR7and syndecan-4 are potential receptors for CXCL12 in human cytotrophoblasts[J]. J Reprod Immunol, 2011, 89(1):18-25.
[8] XUE TC, CHEN RX, REN ZG, et al. Transmembrane receptor CXCR7 increases the risk of extrahepatic metastasis of relatively well-differentiated hepatocellular carcinoma through upregulation of osteopontin[J]. Oncol Rep, 2013, 30(1):105-110.
[9] ZENG Z, ZHANG C, CHEN J. Lentivirus-mediated RNA interference of DC-STAMP expression inhibits the fusion and resorptive activity of human osteoclasts[J]. J Bone Miner Metab, 2013, 31(4):409-416.
[10] LIU L, ZHANG N, LIU J, et al. Lentivirus-mediated siRNA interference targeting SGO-1 inhibits human NSCLC cell growth[J]. Tumour Biol, 2012, 33(2):515-521.
[11] YING J, XU Q, ZHANG G, et al. The expression of CXCL12 and CXCR4 in gastric cancer and their correlation to lymph node metastasis[J]. Med Oncol, 2012, 29(3):1716-1722.
[12] BALABANIAN K, LAGANE B, INFANTINO S, et al. The chemokine SDF-1/CXCL12 binds to and signals through the orphan receptor RDC1 in T lymphocytes[J]. J Biol Chem, 2005, 280(42):35760-35766.
[13] WANG J, SHIOZAWA Y, WANG J, et al. The role of CXCR7/RDC1 as a chemokine receptor for CXCL12/SDF-1 in prostate cancer[J]. J Biol Chem, 2008, 283(7):4283-4294.
[14] MIAO Z, LUKER KE, SUMMERS BC, et al. CXCR7 (RDC1) promotes breast and lung tumor growthinvivoand is expressed on tumor-associated vasculature[J]. Proc Natl Acad Sci USA, 2007, 104(40):15735-15740.
[15] RAGGO C, RUHL R, MCALLISTER S, et al. Novel cellular genes essential for transformation of endothelial cells by Kaposi’s sarcoma-associated herpesvirus[J]. Cancer Res, 2005, 65(12):5084-5095.
[16] ELBASHIR SM, LENDECKEL W, TUSCHL T. RNA interference is mediated by 21- and 22-nucleotide RNAs[J]. Genes Dev, 2001, 15(2):188-200.
[17] MIYATA Y, IWATA T, OHBA K, et al. Expression of matrix metalloproteinase-7 on cancer cells and tissue endothelial cells in renal cell carcinoma: prognostic implications and clinical significance for invasion and metastasis[J]. Clin Cancer Res, 2006, 12(23):6998-7003.

