青少年抑郁症患者前额叶磁共振波谱与记忆功能的相关性
毛 宁,崔明湖,姜兴岳,刘新疆,王 静,狄宁宁,房俊芳,王 滨
(滨州医学院附属医院放射科,山东滨州 256603)
抑郁症是最常见的精神疾病之一。近年来,青少年患抑郁症的比例逐渐增加,成人抑郁症也大多开始于青少年时期,青少年患抑郁症后再次发病的风险增加[1],疾病导致认知功能尤其是记忆功能受损,给青少年的学习和生活带来极大的影响。虽然很多研究者指出抑郁症患者脑部异常,但潜在的病理生理机制仍然不清楚。磁共振波谱(magnetic resonance spectrum, MRS) 可以无损伤测定活体某一特定区域代谢情况,对于探究抑郁症的病理生理学机制有非常重要的意义。以往的研究没有排除很多重要因素的综合影响,如药物、退变等[2],故本研究以首发青少年抑郁症患者为研究对象。以往的研究发现,抑郁症患者额叶结构和功能异常[3],额叶尤其是背外侧前额叶皮层(dorsolateral prefrontal cortex, DLPFC)和前扣带皮层(anterior cingulate cortex, ACC)在调节情绪和认知功能中发挥关键作用,可能参与抑郁症的病理生理过程,但大多数关于抑郁症的研究关注额叶灰质,较少关注额叶白质[4]。所以,本研究检测背外侧前额叶白质和前扣带回灰质代谢物的变化及与记忆功能的相关性。
1 对象与方法
1.1研究对象抑郁组共24人,系滨州医学院附属医院门诊和住院的患者。符合美国精神障碍诊断与统计手册第4版(DSM-Ⅳ)的诊断标准。年龄在15~20岁,汉密尔顿抑郁量表(HAMD)17项总分>17分。确诊时均未接受任何抗精神疾病的药物,最近1个月未接受心理治疗、电休克治疗,均无精神疾病的病史及家族史,6个月无药物及乙醇滥用史,无其他躯体性疾病。
对照组为23名健康青少年志愿者,HAMD 17项评分总分<7分,均无精神疾病史及精神疾病家族史。两组之间性别、年龄、体质量指数无明显差异。
1.2设备及参数使用西门子3.0T MR进行扫描,用标准8通道头颈联合线圈发射和接受信号,被检查者采用仰卧位,定位线垂直于鼻根处,戴耳塞和泡沫垫以减少噪音。常规FSE检查,排除任何结构和信号异常,并为1H-MRS定位。MRS使用多体素(MVS)3D-CSI序列,感兴趣区包含背外侧前额叶和前扣带回,位于双侧脑室前角的前缘,避开纹状体、脑室、头皮、颅骨和鼻窦等,感兴趣区周围加饱和带避免周围组织的影响,自动匀场后扫描。扫描参数如下:TR=1000 ms;TE=135 ms;激励次数=1;空间矩阵=18 mm×18 mm;FOV= 240 mm×240 mm;层厚=10 mm;体素大小=7.5 mm×7.5 mm×10 mm;总采集时间为5 min 28 s。
1.3波谱分析波谱分析采用西门子公司提供的软件包。体素定位在双侧大脑背外侧前额叶白质和双侧前扣带回灰质,由经过专门训练的放射科医师完成。计算Cho(3.22 ppm)、Cr(3.03 ppm)、NAA(2.02 ppm)等谱峰下的面积,并在此基础上计算NAA/Cr、Cho/Cr。
1.4记忆功能评价由精神科专业心理测试员利用韦氏记忆量表(WMS)对受试者进行记忆功能的评估,WMS包括10个分测验,即长时记忆(个人经历、时间空间、数字顺序关系),短时记忆(视觉再认、图片回忆、视觉再生、联想学习、触摸测验、理解记忆),瞬时记忆(顺背和倒背),根据各分测验总分及年龄,可查表得到受试者的记忆商数(memory quotient, MQ),MQ的判断标准是:69分以下为记忆缺损,70~79分为临界,80~89分为低于平常,90~109分为平常,110~119分为高于平常,120~129分为超常,130分以上为极超常[5]。
1.5统计学分析采用SPSS 15.0软件进行统计学分析。所有数据均以均数±标准差表示,以P<0.05差异有统计学意义。用独立样本t检验和χ2检验比较抑郁症和对照组之间的统计学差异,用独立样本t检验比较两组之间NAA/Cr、Cho/Cr,用Pearson相关系数分析临床变量和代谢物水平间的关系。
2 结 果
2.1抑郁症组和对照组的一般资料的比较本研究共包括47人,对照组23人[11男,12女,平均年龄为(18.21±1.29)岁],抑郁症组24人[10男,14女,平均年龄为(17.31±1.34)岁]。年龄在15~20岁,平均病程为(4.20±6.56)月,平均HAMD得分为21.4±3.09。性别、年龄、体重指数无明显差异(表1)。
表1对照组和抑郁症组一般资料的比较
Tab.1 Comparison of the general information between patient group and control group

项 目对照组(n=23)抑郁组(n=24)性别(女/男)12/1114/10年龄 (岁)18.21±1.2917.31±1.34体质量指数23.3±3.224.4±2.5年龄跨度(岁)15~2015~20平均病程(d)4.20±6.56汉密尔顿抑郁量表21.4±3.09记忆商数(分)101.02±3.9988.78±7.65
2.2抑郁症组和对照组背外侧前额叶白质1H-MRS检查结果的比较与对照组相比,抑郁症组左背外侧前额叶白质 NAA/Cr和Cho/Cr明显下降,右背外侧前额叶白质NAA/Cr明显下降,差异有统计学意义(P<0.05),而右背外侧前额叶白质Cho/Cr未见明显改变,差异具无统计学意义,且该脑区NAA/Cr、Cho/Cr与HAMD评分没有显著的相关性;与对照组相比,抑郁症组双侧前扣带回灰质NAA/Cr和Cho/Cr未见明显改变,差异无统计学意义,且该脑区NAA/Cr、Cho/Cr与HAMD评分也没有显著的相关性(表2)。
表2抑郁症组和对照组前额叶1H-MRS检查结果的比较

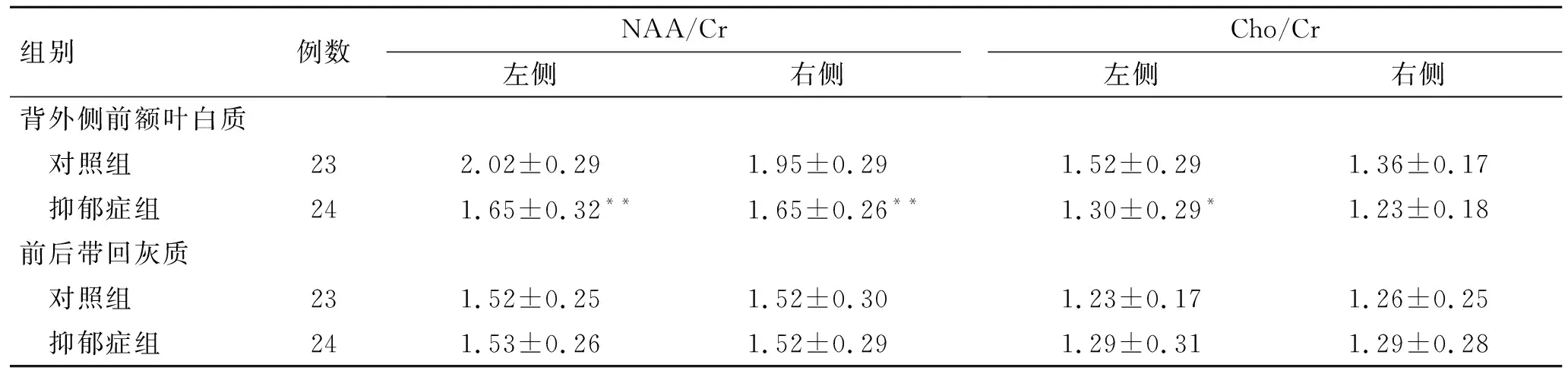
组别例数NAA/Cr左侧右侧Cho/Cr左侧右侧背外侧前额叶白质 对照组232.02±0.291.95±0.291.52±0.291.36±0.17 抑郁症组241.65±0.32**1.65±0.26**1.30±0.29*1.23±0.18前后带回灰质 对照组231.52±0.251.52±0.301.23±0.171.26±0.25 抑郁症组241.53±0.261.52±0.291.29±0.311.29±0.28
与对照组比较,*P<0.05,**P<0.01。
2.3抑郁症组前额叶白质1H-MRS检查结果与记忆功能的相关性比较抑郁症组双侧背外侧前额叶白质NAA/Cr与MQ呈一定程度的正相关(r值分别为0.593和0.553,P值分别是<0.01和0.05),Cho/Cr与MQ无相关性(P>0.05)。抑郁症组双侧前扣带回灰质NAA/Cr及Cho/Cr与MQ无相关性(P>0.05,表3)。
表3抑郁症组前额叶1H-MRS检查结果与MQ的相关性的比较(r值)
Tab.3 Correlation between1H-MRS in frontal lobes and MQ in patient group

脑 区NAA/Cr左侧右侧Cho/Cr 左侧 右侧背外侧前额叶0.593**0.553*-0.33-0.22前扣带回0.4330.309-0.219-0.05
*P<0.05,**P<0.01。
2.4前额叶1H-MRS检查结果与临床量表的关系HAMD可归纳为7类因子结构,包括:焦虑/躯体化、体重、认知障碍、日夜变化、迟缓、睡眠障碍、绝望感,经过分析,左侧背外侧前额叶白质NAA/Cr与认知障碍因子得分呈负相关(r=-0.38,P<0.05);右侧背外侧前额叶白质及前扣带回灰质NAA/Cr及Cho/Cr与HAMD其他因子无明显相关性(P>0.05)。左侧背外侧前额叶白质NAA/Cr与视觉再生(r=0.74,P<0.01)、联想学习(r=0.57,P<0.05)呈正相关;右侧背外侧前额叶白质NAA/Cr与视觉再认(r=0.35,P<0.05)、联想(r=0.45,P<0.05)呈正相关;左侧背外侧前额叶白质Cho/Cr与视觉再生(r=-0.48,P<0.05)、顺背和倒背(r=-0.57,P<0.05)呈负相关;前扣带回灰质检测结果与WMS无明显相关性(P>0.05)。
3 讨 论
本研究第1次应用多体素1H-MRS研究青少年首发抑郁症患者双侧前额叶脑白质的生化变化。在本项研究中,与对照组相比,抑郁症患者双背外侧前额叶白质NAA/Cr显著降低,左背外侧前额叶脑白质的Cho/Cr显著降低,而双侧前扣带回灰质的NAA/Cr、Cho/Cr均未见明显改变。这些数据表明,白质的生化异常可能构成青少年抑郁症重要的神经生物学基础,尤其在无用药干扰的疾病早期。
之前的研究表明,无论青少年和老年人,其背外侧前额叶皮层NAA/Cr显著降低[5-6]。然而,与之矛盾的发现也有报道[7-8]。同样,也有发现 Cho升高的报道[9]。很多因素,如年龄、持续时间、严重程度、药物,都会导致数据的处理与分析出现矛盾的结果。
通常,大多数的研究主要是专注于灰质,没有检测相同区域内的白质代谢物的改变。KAYMA等[7]的研究发现双背外侧前额叶皮层的各种代谢物没有显著改变。虽然他们的人口统计学数据和临床特点与本研究类似,但他们应用单体素MRS,选择的感兴趣区较大,包括背外侧前额叶的灰质和白质。本研究使用多体素MRS技术,选择更小的体素,只包括白质的区域。
在本研究中,与健康的受试者相比,抑郁症患者的双侧背外侧前额叶白质NAA/Cr降低。NAA是神经元及其轴突特异性的标记物,但对神经胶质细胞无特异性。因此,NAA/Cr降低说明此区域神经元及其轴突的数量减少或功能异常。然而,最近的研究显示,NAA在成熟的少突胶质细胞中表达[10]。在灰质中,少突胶质细胞形成神经元的卫星细胞,而在白质中,形成神经元的髓鞘[11]。因此,本研究中NAA水平下降表明双侧背外侧前额叶白质少突胶质细胞和髓鞘异常。本研究结果表明,青少年抑郁症患者存在记忆功能障碍,患者双侧背外侧前额叶白质NAA/Cr与患者的记忆商数呈一定程度的正相关,其中左侧与视觉再生、联想学习呈正相关,右侧与视觉再认、联想呈正相关,考虑患者记忆功能减退的病理生理学机制与双侧背外侧前额叶白质NAA/Cr的降低有关,NAA/Cr是否可作为青少年抑郁症患者记忆功能障碍的分子生物学标记有待于进一步的研究。
本研究也发现,抑郁症患者左背外侧前额叶白质Cho/Cr减低,虽然左背外侧前额叶白质Cho/Cr与MQ无明显相关性,但与分测验的视觉再生、顺背和倒背呈负相关。Cho是乙酰胆碱及膜磷脂、磷脂酰胆碱、鞘磷脂的前体。Cho下降说明细胞膜的更新下降或细胞内信号传导系统受损。或者可以从另外一种角度理解,即Cho在少突胶质细胞中显著表达。NAA及Cho的改变表明青少年抑郁患者左背外侧前额叶白质中少突胶质细胞和髓鞘异常。尸检的研究也报告了抑郁症患者前额叶少突胶质细胞的浓度较低[11]。这些研究表明,青少年抑郁症患者白质异常与少突胶质细胞的改变有关,这最终导致髓鞘完整性和神经网络的改变。
前扣带回对认知功能很重要,如奖励、决策、情绪。一些抑郁症患者的一些症状如认知功能障碍和淡漠可能与扣带回的功能障碍及神经环路有关。但是,本研究发现双侧扣带回灰质的NAA及Cho水平未明显降低,也提示前扣带回与记忆功能关系不密切。在本研究中,我们未检测含量较低的代谢物,因为MRS的数据采集不能准确的测量这些含量较低的物质。因此,不能排除扣带回灰质Glx/Glu和肌醇的浓度改变。
本研究的优势之一是包括选择首发青少年抑郁症患者。研究证明抗抑郁治疗对额叶代谢物有一定的影响[7],年龄与脑内代谢物的下降有一定的关系。另一个优势是采用多体素MRS测定NAA/Cr 和Cho/Cr,多体素可以同时获得多个谱线。因此,可以一次扫描完成多个区域的检测。这种方法可以选择比单体素更大的组织,以便测定感兴趣区内小的体素,将脑白质与灰质分开研究。
本研究表明,前额叶白质的生化异常,尤其是左背外侧前额叶白质,与青少年抑郁症的神经病理学有关。NAA/Cr和Cho/Cr的降低表明神经元和(或)轴突的完整性紊乱,也可能存在前额叶少突胶质细胞和髓鞘的异常,同时发现前额叶白质的代谢与记忆功能有关,今后需要进一步研究这些代谢物的改变与抑郁症严重程度、对治疗的反应及复发危险性的关系,抗抑郁治疗对记忆功能的影响,前额叶白质NAA的变化可否作为抑郁症记忆功能障碍的生物学标记物等,更深入地了解青少年抑郁症的发病机制。随着研究的不断深入[12], MRS一定能够为我们从本质上了解青少年抑郁症的病因提供新的思路。
参考文献:
[1] ROSSO IM, CINTRON CM, STEINGARD RJ, et al. Amygdala and hippocampus volumes in pediatric major depression[J]. Biol Psychiatry, 2005, 57(1):21-26.
[2] WANG Y, JIA Y, XU G, et al. Frontal white matter biochemical abnormalities in first-episode, treatment-naive patients with major depressive disorder: A protonmagnetic resonance spectroscopy study[J]. J Affect Disord, 2012, 136(3):620-626.
[3] KEMPTON MJ, SALVADOR Z, MUNAFMR, et al. Structural neuroimaging studies in major depressive disorder. Meta-analysis and comparison with bipolar disorder[J]. Arch Gen Psychiatry, 2011, 68(7):675-690.
[4] THAM MW, WOON PS,SUM MY, et al. White matter abnormalities in major depression: evidence from post-mortem, neuroimaging and genetic studies[J]. J Affect Disord, 2011, 132(3):26-36.
[5] OLVERA RL, CAETANO SC, STANLEY JA, et al. Reduced medial prefrontal N-acetyl-aspartate levels in pediatric major depressive disorder: a multivoxelinvivo1H spectroscopy study[J]. Psychiatry Res, 2010, 184(2):71-76.
[6] VENKATRAMAN TN, KRISHNAN RR, STEFFENS DC, et al. Biochemical abnormalities of the medial temporal lobe and medial prefrontal cortex in late-life depression[J]. Psychiatry Res, 2009, 172(1): 49-54.
[7] KAYMAK SU, DEMIR B, OGUZ KK, et al. Antidepressant effect detected on proton magnetic resonance spectr oscopy in drug-naive female patients with first-episode major depression[J]. Psychiatry Clin Neurosci, 2009, 63(3):350-356.
[8] NERY FG, STANLEY JA, CHEN HH, et al. Normal metabolite levels in the left dorsolateral prefrontal cortex of unmedicated major depressive disorder patients: a single voxel1H spectroscopy study[J]. Psychiatry Res, 2009, 174(3):177-183.
[9] 王冬青,朱彦,李月峰,等. 首发抑郁症患者敏感脑结构的磁共振质子波谱分析[J]. 中华行为医学与脑科学杂志,2011, 20(1):19-21.
[10] BHAKOO KK, PEARCE D.Invitroexpression of N-acetyl aspartate by oligodendrocytes: implications for proton magnetic resonance spectroscopy signalinvivo[J]. J Neurochem, 2010, 74(1): 254-262.
[11] URANOVA NA, VOSTRIKOV VM, ORLOVSKAYA DD, et al. Oligodendroglial density in the prefrontal cortex in schizophrenia and mood disorders: a study from the Stanley Neuropathology Consortium[J]. Schizophrenia Res, 2009, 67(2-3):269-275.
[12] 马现仓,孙彦,高成阁,等. 首发重症抑郁症患者双侧额叶和海马的磁共振质子波谱成像[J].西安交通大学学报:医学版,2008, 29(2):200-202.

