试验性疼痛测试与术后疼痛的关系
杨远东,张灵敏,袁 慧,袁 伟
(西安交通大学医学院第一附属医院麻醉科,陕西西安 710061)
随着医疗水平的不断发展,新的外科技术越来越多的被应用于临床,以期获得最好的疗效,同时最大程度的减轻患者的痛苦。但是,术后疼痛仍是影响患者术后生存质量的重要因素[1]。过去的研究显示,对于不同的患者,其术后的疼痛程度、持续时间及耐受度存在显著的个体差异,而这些差异受到了生理、心理及社会等多种因素的影响[2-6]。这其中,患者术前的疼痛敏感度被认为是判断术后疼痛状态的一个重要预测因子[7]。对于患者术后的疼痛治疗,临床一般采用比较被动的方式,即患者有诉求时给予一定镇痛治疗。尽管自控止痛装置(patient control analgesia device, PCAD),如止痛泵等在临床已应用多年,但出于多方面的原因,其使用时的术前决策仍受到诸多限制。因此,本课题拟通过对患者术前的疼痛敏感性进行测试,预判其术后的疼痛状态,为临床术后疼痛的预防及制定干预决策提供帮助。
1 对象及方法
1.1研究对象本实验为前瞻性研究。研究对象为2010年6月至2012年5月间就诊于西安交通大学医学院第一附属医院行开腹胃癌根治术的患者78例,所有病例均为初发初治。经校伦理委员会批准,告知所有患者可能存在的风险并取得知情同意书。收集患者的一般资料,包括年龄、性别、身高、体质量、饮酒史;记录其有无术前疼痛,并进行数字法分级(NRS,0~10代表不同程度的疼痛,0为无痛,10为剧痛)。所有患者术前均接受试验性冷、热敏感疼痛测试,术后记录手术类型、镇痛剂使用情况及患者疼痛状态。
1.2试验性冷、热敏感疼痛的测试热敏感疼痛测试使用2 cm×2 cm大小的热电极接触患者非优势手前臂掌侧皮肤,设定温度为48 ℃,刺激5 s后,对患者的疼痛状态进行NRS评分。对于冷敏感疼痛测试,嘱患者将其优势手的整个手掌至腕关节处浸入冰水中,15 s后进行一次NRS评分,并记录患者保持手掌在冰浴中的最长时间,但整个测试时间不超过90 s。
1.3术前麻醉所有患者均采用标准的全麻方式,即首先静脉微量泵给予雷米芬太尼(0.2 μg/kg·min),2~3 mg/kg异丙酚静脉麻醉诱导后给予肌松剂罗库溴铵,常规气管插管,机械通气及心电监护。雷米芬太尼0.05~0.25 μg/(kg·min)、异丙酚50~100 μg/(kg·min)静脉泵入用于麻醉维持。关腹前停止泵入雷米芬太尼,并静脉给予芬太尼1 μg/kg、昂丹司琼4 mg、氟哌利多0.01 mg/kg、新斯的明2.5 mg及格隆溴铵0.5 mg。
1.4术后镇痛患者术后转入麻醉恢复室,待其清醒后,每隔5 min询问一次患者的疼痛程度,并进行NRS评分,当NRS≥4时,通过静脉给予1~3 mg羟考酮止痛,而后每隔20 min询问一次患者的疼痛程度,直至需要下一次静注羟考酮。期间共观察2 h,按患者意愿安装止痛泵(PCAD),并送回普通病房。

2 结 果
2.1患者一般临床资料的比较入选患者共78例,其中男性48例,占61.5%,女性30例,为38.5%,平均年龄(63.9±9.8)岁。按手术方式分为3组,其中30例行近端胃大部切除术,26例为远端胃大部切除,22例为全胃切除,统计学比较3组患者的一般临床资料,未见显著性差异(表1)。
表1按手术方式不同分类后患者一般临床资料的比较
Tab.1 Clinical characteristics of patients grouped based on surgery type
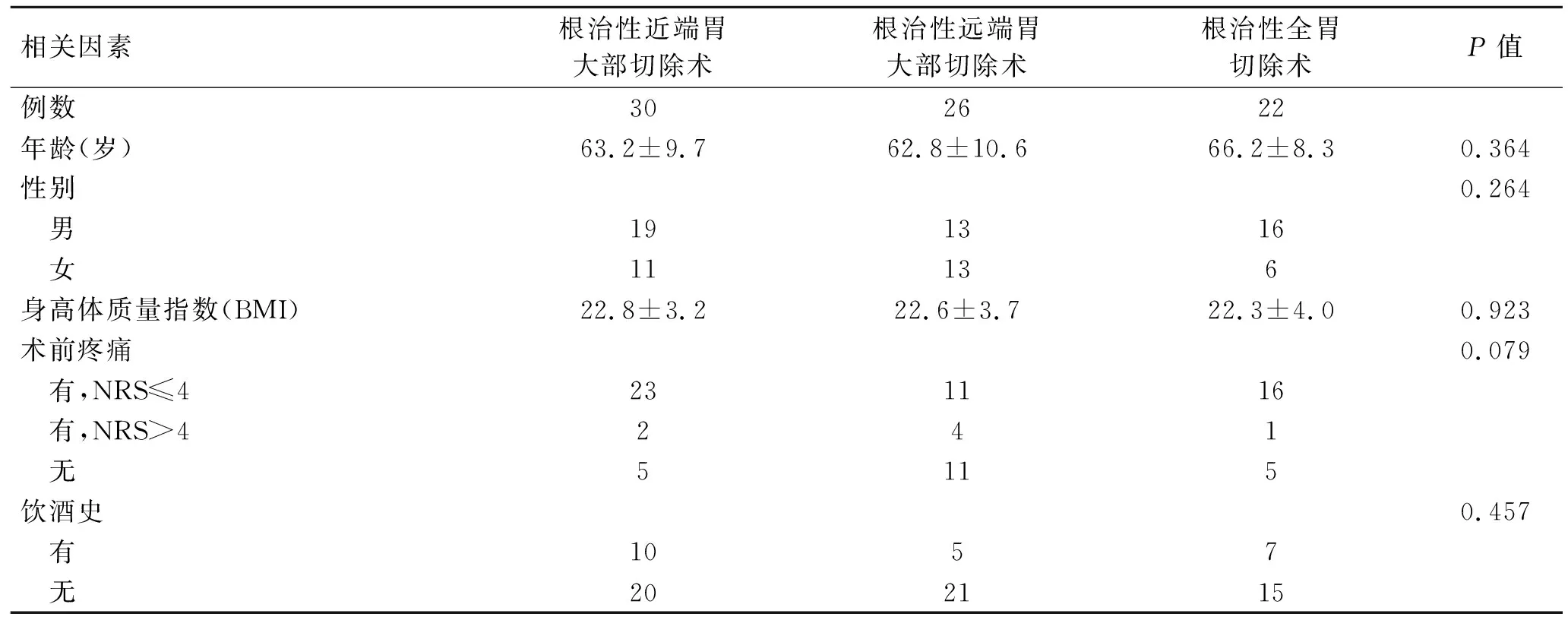
相关因素根治性近端胃大部切除术根治性远端胃大部切除术根治性全胃切除术P值例数302622年龄(岁)63.2±9.762.8±10.666.2±8.30.364性别0.264 男191316 女11136身高体质量指数(BMI)22.8±3.222.6±3.722.3±4.00.923术前疼痛0.079 有,NRS≤4231116 有,NRS>4241 无5115饮酒史0.457 有1057 无202115
2.2冷、热疼痛测试及冷耐受的相关性分析患者热刺激疼痛测试NRS评分平均为3.6±2.3,无患者出现10级热疼痛;冷刺激疼痛测试平均NRS评分为4.7±2.7;冷、热刺激疼痛的评分分布见图1。相关性分析显示,患者冷、热刺激疼痛具有一定的相关性(r=0.44,P<0.001)。在冷耐受的测试中,大多数患者(96%)能持续冰浴超过15s,其中有24.6%的患者能坚持90s以上(图2)。分析冷、热刺激疼痛评分与冷刺激耐受时间之间的相关性显示,冷、热刺激的疼痛程度均与耐受时间呈负向相关(Spearman相关性分析,r值分别为-0.846、-0.345,P值分别为<0.001、0.002)。
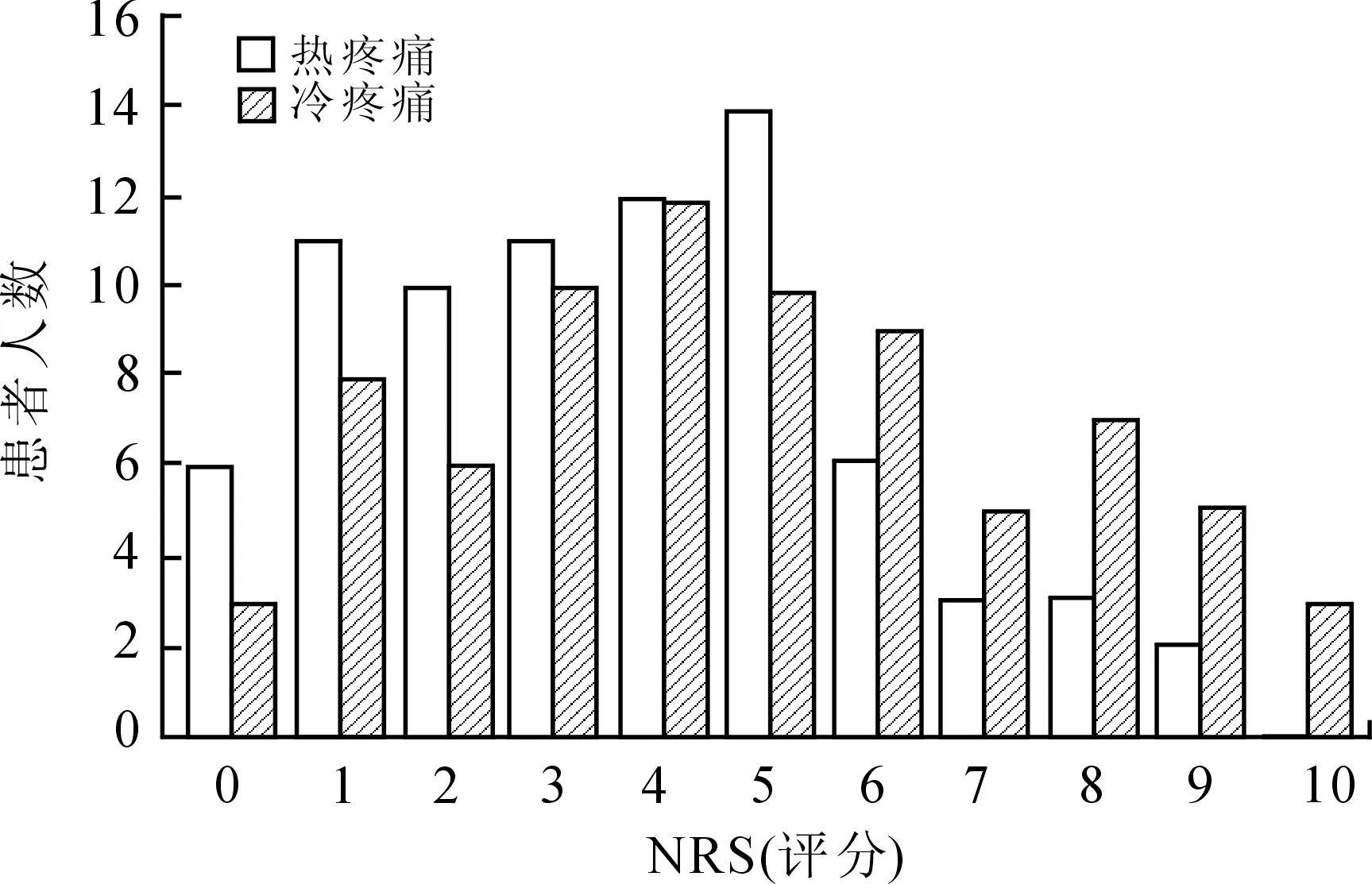
图1患者冷、热疼痛测试NRS评分的分布
Fig.1 Patients’ NRS scores of cold and heat pain tests
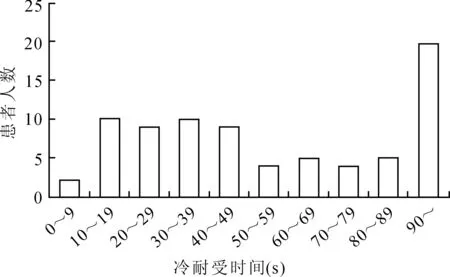
图2患者冷疼痛耐受程度的分布
Fig.2 Patients’ tolerance of cold pain tolerance
2.3术后疼痛与镇痛的关系患者于麻醉恢复室清醒后5 min平均疼痛NRS评分为4.3±2.8,首次要求羟考酮止痛的平均时间为清醒后(11.1±5.8)min,具体分布如图3、4所示。分析清醒后5 min疼痛NRS评分与首次要求羟考酮止痛时间的相关性发现,两者呈现为显著的负相关(r=-0.772,P<0.001),即疼痛程度越明显的患者要求止痛的时间越短。在送回普通病房前,绝大所数患者(85.9%)选择使用止痛泵控制疼痛,只有11名患者未使用PCAD,对比两组患者的清醒后5 min疼痛NRS评分及首次要求止痛的时间,并未发现显著性差异(P>0.05,表4),说明患者术后是否使用PCAD装置并未受到术后疼痛状态的影响。

图3患者清醒后5minNRS评分的分布
Fig.3 Patients’ NRS scores of pain at 5 min after waking
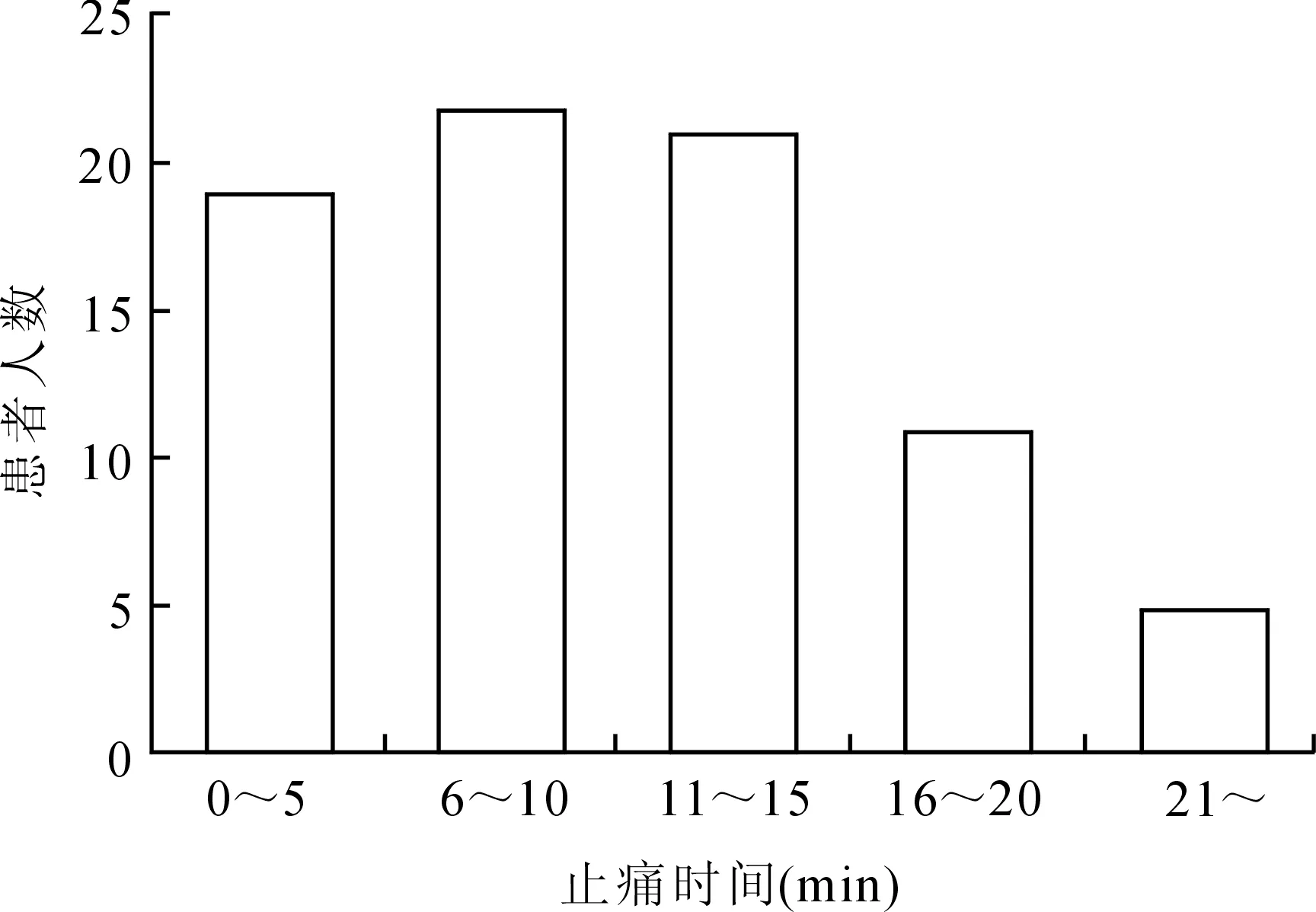
图4患者清醒后首次要求止痛的时间分布
Fig.4 Patients’ time from waking to the first request for oxycodone
2.4影响术后疼痛的相关风险因子分析针对连续变量与分级变量之间的相关性分析,结果显示患者清醒后5 min疼痛NRS评分及首次使用羟考酮的时间与年龄、BMI无明显的相关性(P>0.05,表2)。疼痛测试结果的分析显示,清醒后5 min疼痛的NRS评分与术前冷、热疼痛测试的NRS评分呈显著正相关(P<0.05),与冷刺激耐受时间呈显著负相关(P<0.05);首次使用羟考酮的时间与冷刺激疼痛NRS评分呈负相关,与冷刺激耐受时间呈正相关,但与热刺激疼痛无显著相关性(表2)。对于疼痛测试结果是否影响术后PCAD使用的研究发现,PCAD使用组的术前热疼痛测试NRS评分显著高于未使用PCAD组(表3),说明术前热疼痛测试结果是判断术后是否使用PCAD的一个重要预测因子。
进一步分组比较患者的临床资料与术后疼痛之间的关系(如表4所示),发现性别、手术类型、术前疼痛与否及饮酒状态均未影响患者清醒后5 min的疼痛NRS评分;但有趣的是,不同的手术类型预示着不
表2年龄、BMI及疼痛测试与术后疼痛的相关性分析
Tab.2 Pearson correlation coefficients of BMI and experimental pain test with post-operative pain
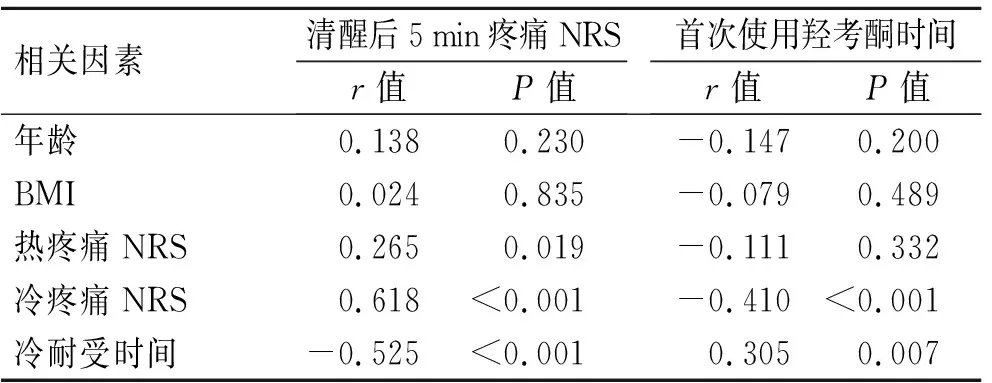
相关因素清醒后5min疼痛NRSr值P值首次使用羟考酮时间r值P值年龄0.1380.230-0.1470.200BMI0.0240.835-0.0790.489热疼痛NRS0.2650.019-0.1110.332冷疼痛NRS0.618<0.001-0.410<0.001冷耐受时间-0.525<0.0010.3050.007
同的首次要求止痛时间,单因素ANOVA分析两两比较显示,近端胃切除术患者清醒后首次要求使用羟考酮的时间显著晚于远端胃切除术的患者(P=0.01)。多元logistic回归分析显示,患者的性别、年龄、BMI、术前疼痛及饮酒史均与术后首次使用羟考酮的时间无相关性(P值均大于0.05),而冷疼痛评分、冷耐受时间及手术方式与该时间的长短显著相关(P值分别为0.043、0.0001、0.026)。此外,PCAD的使用率在患者的性别及术前疼痛状态分组中也表现出显著的差异,logistic回归分析显示,患者的性别及术前疼痛是术后PCAD使用的风险预测因子(P值分别为0.022、0.021)。
表3疼痛测试结果与术后止痛泵使用的相关性分析


相关因素使用止痛泵未使用止痛泵P值例数6711热疼痛NRS3.8±2.32.4±1.70.028冷疼痛NRS4.9±2.73.9±2.20.218冷耐受时间(min)52.4±27.664.3±26.00.186
表4术后疼痛分类比较


相关因素清醒后5min疼痛NRSP值首次使用羟考酮时间(min)P值止痛泵使用率(%)P值性别0.3670.3810.012 男4.1±2.511.6±6.193.7 女4.7±3.210.4±5.273.3手术类型0.7110.0100.857 近端胃切除4.2±2.412.5±6.683.3 远端胃切除4.7±3.09.1±4.088.5 全胃切除4.4±3.110.3±5.386.4术前疼痛0.8750.8310.034 有,NRS≤44.1±2.611.5±5.392.0 有,NRS>44.9±3.010.9±7.657.1 无4.6±3.210.5±6.081.0饮酒史0.3920.0530.425 有3.9±2.513.1±6.790.9 无4.5±2.910.3±5.283.9是否使用止痛泵0.3100.974 是4.5±2.811.1±6.0 否3.5±2.611.2±4.6
3 讨 论
术后的疼痛是影响患者生活质量的重要因素,且具有很大的个体差异性[8]。研究显示,一些风险因子可以预测术后的疼痛状态,其中最重要的一个因子就是自然状态下患者对疼痛的敏感程度[9]。因此,本课题设计使用术前的疼痛敏感测试来预测患者术后的疼痛状态,同时分析是否存在其他的一些影响因子,如性别、BMI、饮酒等。
本实验中,我们使用了常用的三个指标来评价患者的疼痛敏感性,分别为冷、热刺激后的NRS评分及冷刺激耐受时长[3,5,6,10],结果显示患者疼痛敏感性的分布状态及各指标之间的相关性与KAUNISTO及JOHANSEN等[5-6]的研究具有很高的一致性。而在衡量术后疼痛状态时,因受到研究条件的限制,只选取了患者清醒后5 min的疼痛NRS评分及首次要求使用羟考酮的时间这两个指标。因此,评价效力具有一定的局限性。在对这两个指标的研究中发现,患者清醒后5 min的疼痛NRS评分与首次要求使用羟考酮的时间呈负相关,但有趣的是这两个均未影响PCAD的使用率,表明PCAD的使用不受术后疼痛状态的影响。而随后的研究显示,患者的性别、术前有无疼痛及热刺激疼痛NRS评分能在一定程度上预测PCAD的使用,但能否作为其独立的风险预测因子尚需进一步研究。同时,对于PCAD的使用尚存在其他的社会、心理影响因素,也需在今后的研究中进一步完善。
在评价术后疼痛状态的风险因子过程中发现,患者的一般临床资料,如性别、年龄、BMI、手术方式、术前有无疼痛、饮酒史等均为显著影响清醒后5 min NRS评分及首次要求镇痛的时间,而术前疼痛测试结果的不同却预示着不同的术后疼痛状态,具体表现为对术前疼痛测试越敏感,术后的疼痛状态越严重。但应注意的是,这其中热刺激疼痛程度与术后首次要求镇痛的时间并无显著相关性,这可能由样本的选择及容量差异导致。
随着腔镜技术的不断发展,越来越多的手术采用微创技术,其能有效降低患者的创伤,减轻术后疼痛[11]。但值得关注的是该类术后疼痛的特点可能与传统手术存在差异,如传统手术主要表现出手术部位的疼痛,而微创手术可能会表现出由麻醉药物引起的“爆发式疼痛”特点[12],试验性疼痛实验能否预测该类手术的术后疼痛状态有待进一步研究。总之,本实验的研究发现,术前的试验性疼痛敏感测试能很好的预测术后的疼痛状态,这为制定术后疼痛的预防和治疗决策提供了良好的参考依据。
参考文献:
[1] JOHANSEN A, ROMUNDSTAD L, NIELSEN CS, et al. Persistent postsurgical pain in a general population: prevalence and predictors in the Tromso study[J]. Pain, 2012, 153(7):1390-1396.
[2] KIM H, MITTAL DP, IADAROLA MJ, et al. Genetic predictors for acute experimental cold and heat pain sensitivity in humans[J]. J Med Gene, 2006, 43(8): e40.
[3] NIELSEN CS, STUBHAUG A, PRICE DD, et al. Individual differences in pain sensitivity: genetic and environmental contributions[J]. Pain, 2008, 136(1-2):21-29.
[4] HINRICHS-ROCKER A, SCHULZ K, JARVINEN I, et al. Psychosocial predictors and correlates for chronic post-surgical pain (CPSP)—a systematic review[J]. Eur J Pain, 2009, 13(7):719-730.
[5] KAUNISTO MA, JOKELA R, TALLGREN M, et al. Pain in 1 000 women treated for breast cancer: a prospective study of pain sensitivity and postoperative pain[J]. Anesthesiology, 2013, 119(6):1410-1421.
[6] JOHANSEN A, SCHIRMER H, STUBHAUG A, et al. Persistent post-surgical pain and experimental pain sensitivity in the Tromso study: Comorbid pain matters[J]. Pain, 2014,155( 2): 341-348.
[7] YARNITSKY D, CRISPEL Y, EISENBERG E, et al. Prediction of chronic post-operative pain: pre-operative DNIC testing identifies patients at risk[J]. Pain, 2008, 138(1):22-28.
[8] KEHLET H, JENSEN TS, WOOLF CJ. Persistent postsurgical pain: risk factors and prevention[J]. Lancet, 2006, 367(9522):1618-1625.
[9] ANDERSEN KG, KEHLET H. Persistent pain after breast cancer treatment: a critical review of risk factors and strategies for prevention[J]. J Pain, 2011, 12(7):725-746.
[10] KIM H, NEUBERT JK, ROWAN JS, et al. Comparison of experimental and acute clinical pain responses in humans as pain phenotypes[J]. J Pain, 2004, 5(7):377-384.
[11] 石爱平,李嗣杰,路璐,等. 乳腔镜与传统手术治疗乳腺疾病的效果评价[J]. 吉林大学学报:医学版,2011,37(2):327-330.
[12] 李小刚,童华,周荣胜,等. 帕瑞昔布对胸腔镜肺叶切除术围术期疼痛和炎性细胞因子的影响[J]. 西安交通大学学报:医学版, 2013, 34(5):659-663.

