TAP-1、TAP-2及HLA-I在鼻咽癌中的表达及临床意义
任艳鑫,李晓江,张丽娟,杨 洁,孙瑞梅,张世文,张 吉
(昆明医科大学第三附属医院:1. 头颈肿瘤研究中心;2. 病理科,云南昆明 650118)
鼻咽癌是中国南方及东南亚地区常见恶性肿瘤之一,其发病与EB病毒(Epstein-Barr virus, EBV)感染密切相关[1-2]。然而,仅仅感染EBV还不足以导致细胞癌变,机体的某些因素也起着重要的作用,细胞介导的免疫反应是机体清除恶性细胞的主要机制。TAP主要功能是与低分子多肽复合物-2、7(1ow molecular mass polypeptide, LMP-2、7)一起加工、转运内源性抗原肽(其中包括肿瘤抗原)至内质网,在内质网锚定的MHC(主要是HLA-I)结合抗原肽后将其呈递至细胞表面供CD8+细胞毒性T淋巴细胞(cytotoxic T lymphocytes, CTLs)识别,从而启动细胞免疫。细胞免疫在机体抗肿瘤免疫中具有重要作用。HLA-I类分子肿瘤抗原可组成T细胞激活的第一信号,激活HLA特异性CD8+CTL,发挥抗肿瘤免疫效应。研究发现,在小细胞肺癌、结直肠癌、乳腺癌、恶性黑色素瘤、头颈恶性肿瘤及脑恶性肿瘤中都发现TAP-1、LMP-2/7及HLA-1的缺失或下调,转染TAP-1后可诱导LMP-2/7及HLA-I表达的增加[3-6]。本文着重研究鼻咽部组织中TAP-1、TAP-2及HLA-I的表达及其对鼻咽癌患者免疫功能的影响。
1 材料与方法
1.1实验标本选取2000年1月至2002年12月我院病理科存档的蜡块标本共78例(均为活检和手术切除的标本),其中包括鼻咽部非特异性炎症组织20例(入选对照组者均为患者自感不适,经本人及家属同意在我院行鼻咽部取材,病理检查排除),鼻咽癌标本58例(患者临床资料见表1)。所有标本经免疫组化证实且为治疗前收集,血液标本每人取外周血2 mL,肝素抗凝,所有标本采集之前均经患者同意。所有鼻咽癌患者在病理确诊后根据NCCN指南(头颈部肿瘤临床实践指南)进行治疗。Ⅰ期患者接受根治性放疗,Ⅱ期+Ⅲ期及无远处转移的Ⅳ期患者接受TPU化疗4~6周期以及根治性放疗,有远处转移的Ⅳ期患者接受TPU化疗6周期以及姑息性放疗,患者均接受定期随访。
表1鼻咽癌患者的临床特征
Tab.1 Clinical characteristics of the NPC patients

参 数例数(%) 性别 男38(65.5) 女20(34.5)年龄(岁)49.23(14~84)临床分期 Ⅰ4(6.9) Ⅱ18(31.0) Ⅲ10(17.3) Ⅳ26(44.8)病理类型 高或中分化5(8.6) 未分化53(91.4)淋巴结转移 N017(29.3) N1~341(70.7)远处器官转移 M048(82.8) M110(17.2)
1.2实验试剂兔抗人HLA-I多克隆抗体购自美国Epitomics公司,兔抗人TAP-1多克隆抗体购自美国Santa Cruz公司,兔抗人TAP-2单克隆抗体购自香港Abcam公司,IL-10酶联免疫检测试剂盒购自美国Biosource公司,SP免疫组化通用试剂盒购自北京中山公司,PE标记的鼠抗人CD8,FITC标记的鼠抗人CD4抗体,PC5标记的鼠抗人CD45抗体,同型对照分别为PE标记的鼠抗人IgG免疫球蛋白,FITC标记的鼠抗人IgG免疫球蛋白试剂均为Beckman Coulter公司提供。
1.3免疫组织化学方法将中性甲醛固定、石蜡包埋的鼻咽部组织标本制成4 μm厚的切片,采用SP免疫组化染色。用购自北京中杉公司的阳性对照片作为阳性对照,PBS代替一抗作为阴性对照。主要步骤:①石蜡切片脱蜡到水。②微波抗原修复。③30 mL/L H2O2-甲醇溶液浸泡10 min。④加100 mL/L山羊血清置室温20 min。⑤加一抗工作液4 ℃孵育过夜。⑥加生物素化二抗工作液,37 ℃孵育10 min。⑦加HRP标记链霉卵白素工作液,37 ℃孵育10 min。⑧DAB显色,苏木素复染,中性树胶封固。
1.4结果判定TAP-1、TAP-2阳性染色为棕黄色,阳性信号主要位于细胞胞质。HLA-I类抗原阳性染色为棕黄色,阳性信号主要位于细胞胞质及细胞膜。综合染色反应强度和阳性细胞数量两个方面进行半定量记分法判定:按阳性着色程度评分,0分为无色;1分为浅黄色;2分为棕黄色;3分为棕褐色。按阳性细胞比例评分,0分<5%;1分为5%~10%;2分为11%~50%;3分为51%~80%;4分为>80%。两者乘积判定阳性结果:0分为阴性(-);1~4分为弱阳性(+);5~8分为中度阳性();9~12分为强阳性()。
1.5流式细胞术检测外周血T细胞比例取全血100 μL,加三色荧光抗体10 μL,阴性对照相同,避光室温静置20 min,用Q-prep自动溶血,30 min后上机检测,分析外周血及组织中CD4+T、CD8+T细胞,CD45+细胞为淋巴细胞,分别计算CD4+T、CD8+T细胞在淋巴细胞中的比值。
1.6ELISA法检测外周血中IL-10水平外周血收集后于离心机3 000 r/min离心25 min,收集上清液,再用包被缓冲液稀释为1∶400备用。按照试剂盒操作步骤进行。
1.7统计学分析采用SPSS 12.0统计软件进行处理,计量资料采用t检验,计数资料采用χ2检验,生存率用Kaplan-Meier法计算,显著性检验采用Log-rank法检验,预后进行单因素分析、多因素Logistic回归模型分析,当P<0.05时认为差异有统计学意义。
2 结 果
2.1鼻咽癌组织中TAP-1、TAP-2及HLA-I低表达TAP-1、TAP-2主要在细胞胞质中分布,在鼻咽正常组织中呈中度阳性或强阳性表达,阳性率分别为90%、95%(18/20、19/20),表现为棕黄色或棕褐色。在鼻咽癌组织中大部分呈阴性或弱阳性43.1%、46.55%(25/58、27/58)(图1)。HLA-I主要在细胞胞质及胞膜上分布,在鼻咽正常组织中呈中度阳性或强阳性表达,阳性率为95%(19/20),表现为棕黄色或棕褐色。在鼻咽癌组织中大部分呈阴性或弱阳性,阳性率为50%(29/58)(图1、表2)。

图1TAP-1,TAP-2及HLA-I在鼻咽癌及鼻咽正常组织中的表达
Fig.1 Expressions of TAP-1, TAP-2 and HLA-I in NPC and normal nasopharyngeal tissue
A、C、E:分别为TAP-1、TAP-2、HLA-I在鼻咽癌组织中低表达或无表达(×400);B、D、F:分别为TAP-1、TAP-2、HLA-I在鼻咽正常组织中高表达(×400)。
表2鼻咽部不同病变组织中TAP-1、TAP-2及HLA-I的表达
Tab.2 Expressions of TAP-1 and 2 and HLA-I in NPC and control groups
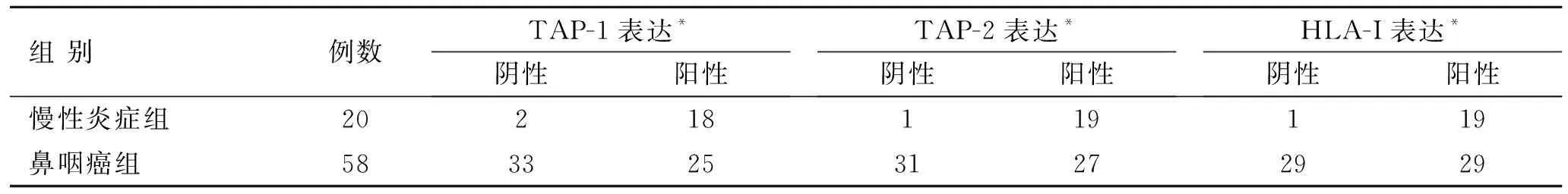
组 别例数TAP-1表达*阴性阳性TAP-2表达*阴性阳性HLA-I表达*阴性阳性慢性炎症组20218119119鼻咽癌组58332531272929
两组比较,*P<0.01。
2.2鼻咽癌外周血中CD4+T、CD8+T细胞及IL-10的变化我们采用流式细胞术检测鼻咽癌组及对照组外周血中CD4+、CD8+T细胞及IL-10。鼻咽癌组CD4+T细胞有不同程度降低,明显低于对照组[(33.41±10.04)%vs. (40.15±3.56)%](P<0.05),而CD8+T细胞略有升高,与对照组比较差异无统计学意义[(25.32±8.29)%vs.(22.89±2.24)%](P>0.05)。鼻咽癌IL-10表达明显高于对照组[(13.12±1.23)ng/mLvs.(3.69±1.03)ng/mL](P<0.05,图2)。

图2鼻咽癌组及对照组外周血中CD4+、CD8+T细胞的比例
Fig.2 The percentages of CD4+T cells and CD8+T cells in peripheral blood lymphocytes in NPC and control groups
A:CD4+T细胞在鼻咽癌患者外周血中比例为33.0%;B:CD4+T细胞在对照组外周血中比例为42.4 %;C:CD8+T细胞在鼻咽癌患者外周血中比例为25.2%;D:CD8+T细胞在对照组外周血中比例为22.4%。
2.3鼻咽癌中TAP-1、TAP-2及HLA-I与临床因素的关系在58例鼻咽癌中,我们发现TAP-1、TAP-2及HLA-I表达与年龄、性别无相关性(P>0.05),而与TNM分期、有无淋巴结转移及有无远处转移密切相关(P<0.05,表3)。
表3鼻咽癌组织中TAP-1、TAP-2和HLA-I与临床参数的关系
Tab.3 Association of TAP-1, TAP-2 and HLA-I expressions with clinical factors in NPC
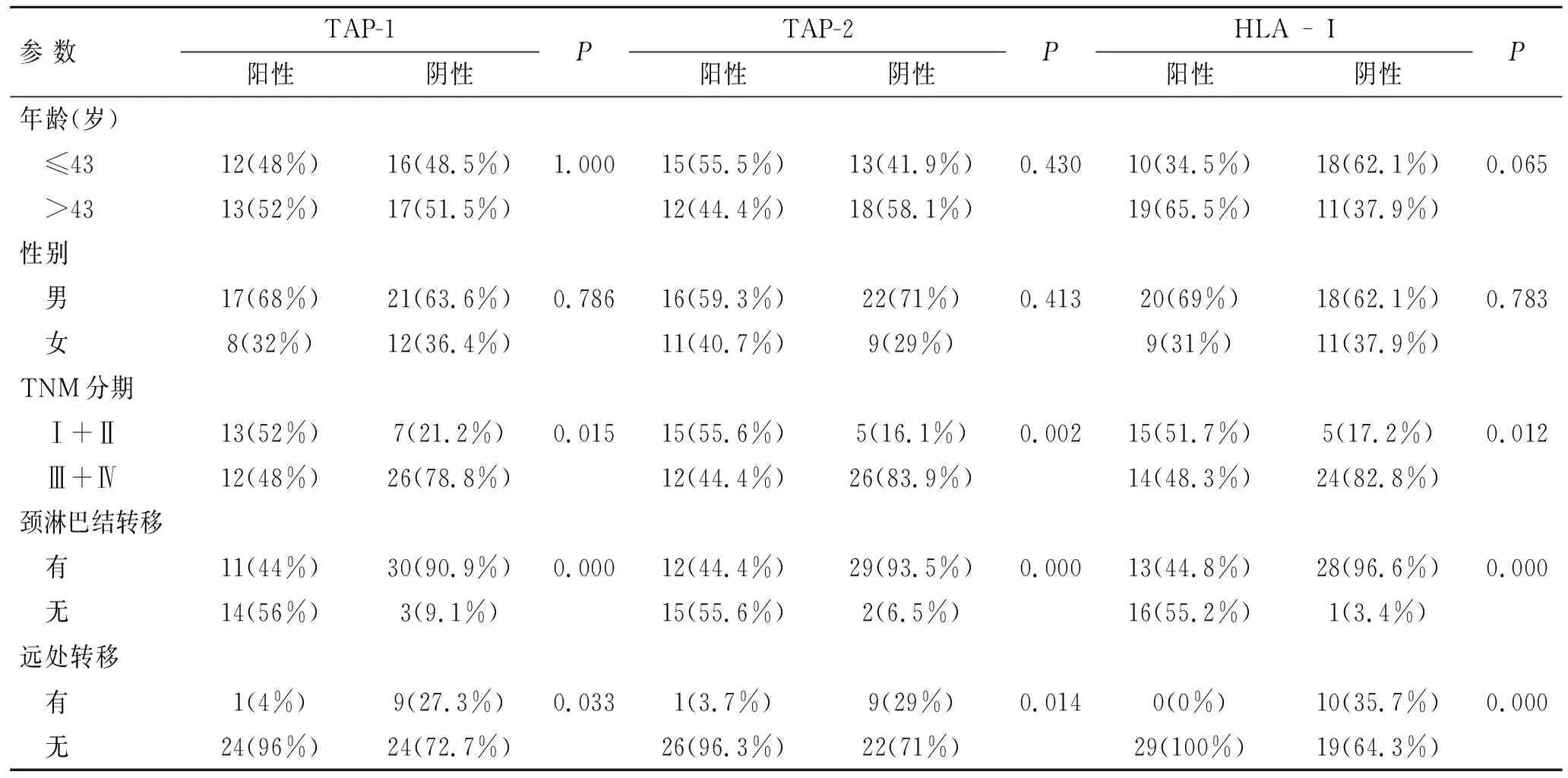
参 数TAP-1阳性阴性PTAP-2阳性阴性PHLA-I阳性阴性P年龄(岁) ≤4312(48%)16(48.5%)1.00015(55.5%)13(41.9%)0.43010(34.5%)18(62.1%)0.065 >4313(52%)17(51.5%)12(44.4%)18(58.1%)19(65.5%)11(37.9%)性别 男17(68%)21(63.6%)0.78616(59.3%)22(71%)0.41320(69%)18(62.1%)0.783 女8(32%)12(36.4%)11(40.7%)9(29%)9(31%)11(37.9%)TNM分期 Ⅰ+Ⅱ13(52%)7(21.2%)0.01515(55.6%)5(16.1%)0.00215(51.7%)5(17.2%)0.012 Ⅲ+Ⅳ12(48%)26(78.8%)12(44.4%)26(83.9%)14(48.3%)24(82.8%)颈淋巴结转移 有11(44%)30(90.9%)0.00012(44.4%)29(93.5%)0.00013(44.8%)28(96.6%)0.000 无14(56%)3(9.1%)15(55.6%)2(6.5%)16(55.2%)1(3.4%)远处转移 有1(4%)9(27.3%)0.0331(3.7%)9(29%)0.0140(0%)10(35.7%)0.000 无24(96%)24(72.7%)26(96.3%)22(71%)29(100%)19(64.3%)
2.4鼻咽癌中TAP-1、TAP-2及HLA-I表达与CD4+T、CD8+T细胞及IL-10的关系为了明确TAP-1、TAP-2及HLA-I表达是否对CD4+T细胞、CD8+T细胞及IL-10表达具有影响,我们分别将58例鼻咽癌患者分为TAP-1阳性组和阴性组,TAP-2阳性组和阴性组,HLA-I阳性组和阴性组,分析3种不同组别中CD4+T细胞、CD8+T细胞及IL-10表达的不同。CD4+T细胞在TAP-1、TAP-2、HLA-I阳性组与阴性组中表达差异无统计学意义(33.19±9.2vs. 33.35±8.05;33.58±6.4vs. 32.52±5.2; 34.34±6.58vs. 30.22±3.49;P>0.05)。CD8+T细胞在TAP-1、TAP-2、HLA-I阳性组均高于阴性组,差异具有统计学意义(27.93±4.04vs. 18.43±2.37;28.47±3.62vs. 19.18±2.11;31.35±4.72vs. 16.65±2.07;P<0.05)。IL-10在TAP-1、TAP-2、HLA-I阳性组均低于阴性组,差异具有统计学意义(9.87±1.24vs. 16.20±1.48;8.93±0.56vs. 16.04±1.75;6.28±0.86vs. 17.99±2.01;P<0.05,表4)。
表4鼻咽癌患者TAP-1、TAP-2、HLA-I表达与CD4+T、CD8+T细胞、IL-10的表达的关系
Tab.4 Analysis of CD4+T cells, CD8+T cells and IL-10 expression in different TAP-1, TAP-2, HLA-I expression groups in NPC


项目TAP-1阳性阴性PTAP-2阳性阴性PHLA-I阳性阴性PCD4+细胞(%)33.19±9.233.35±8.050.97033.58±6.432.52±5.20.81534.34±6.5830.22±3.490.379CD8+细胞(%)27.93±4.0418.43±2.370.01328.47±3.6219.18±2.110.01831.35±4.7216.65±2.070.005IL-10(ng/mL)9.87±1.2416.20±1.480.0218.93±0.5616.04±1.750.0156.28±0.8617.99±2.010.008
2.5影响鼻咽癌患者预后的单因素分析58例患者均按照NCCN指南进行规范化治疗并定期随访,将可能影响鼻咽癌治疗后进展的因素进行单因素Kaplan-Meier分析,列入的相关因素包括:年龄、性别、临床分期、有无淋巴结转移、有无远处器官转移、病理分型、TAP-1表达、TAP-2表达和HLA-I表达。我们发现临床分期、有无淋巴结转移、有无远处器官转移、病理分型、TAP-1表达、TAP-2表达及HLA-I表达与鼻咽癌患者预后相关,差异具有统计学意义(P<0.05,图3)。

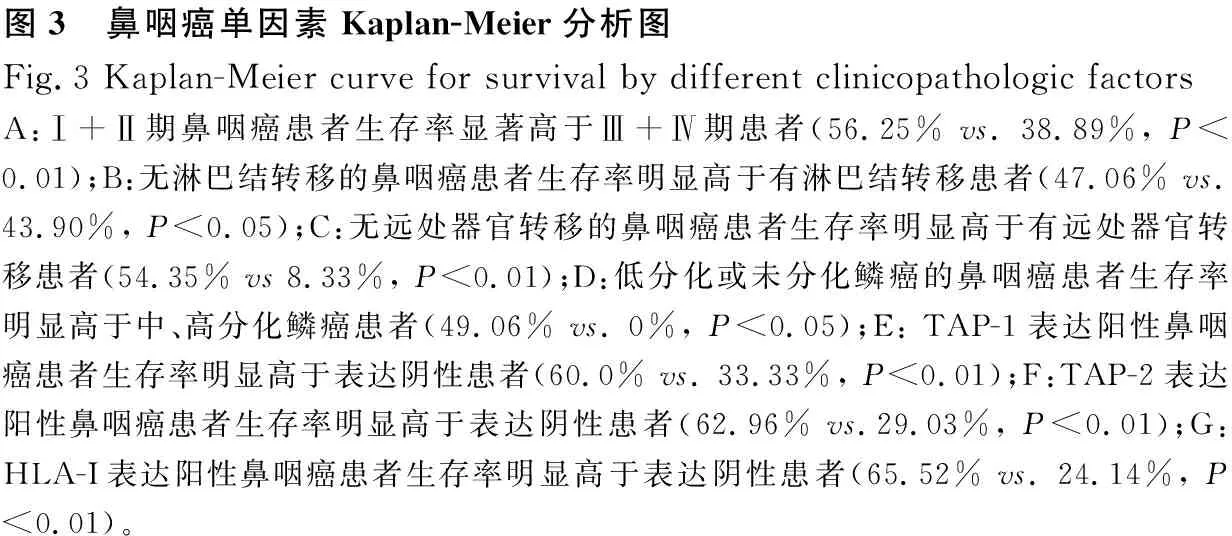
图3 鼻咽癌单因素Kaplan-Meier分析图Fig.3 Kaplan-Meier curve for survival by different clinicopathologic factorsA:Ⅰ+Ⅱ期鼻咽癌患者生存率显著高于Ⅲ+Ⅳ期患者(56.25% vs. 38.89%, P<0.01);B:无淋巴结转移的鼻咽癌患者生存率明显高于有淋巴结转移患者(47.06% vs. 43.90%, P<0.05);C:无远处器官转移的鼻咽癌患者生存率明显高于有远处器官转移患者(54.35% vs 8.33%, P<0.01);D:低分化或未分化鳞癌的鼻咽癌患者生存率明显高于中、高分化鳞癌患者(49.06% vs. 0%, P<0.05);E: TAP-1表达阳性鼻咽癌患者生存率明显高于表达阴性患者(60.0% vs. 33.33%, P<0.01);F:TAP-2表达阳性鼻咽癌患者生存率明显高于表达阴性患者(62.96% vs.29.03%, P<0.01);G:HLA-I表达阳性鼻咽癌患者生存率明显高于表达阴性患者(65.52% vs. 24.14%, P<0.01)。
2.6鼻咽癌患者预后的多因素Logistic回归模型分析我们进一步将鼻咽癌患者多种因素(包括年龄、性别、临床分期、有无淋巴结转移、有无远处器官转移、病理分型、TAP-1表达、TAP-2表达、HLA-I表达)纳入Logistic回归模型分析。结果显示,只有有无远处器官转移及HLA-I表达为鼻咽癌患者独立预后因素(P=0.043,P=0.045,表5)。
表5鼻咽癌患者多因素Cox回归模型分析
Tab.5 Multivariate Cox regression analysis of NPC

因素BSEWaldPExp(B)95.0%CI for Exp(B)年龄-0.2550.3300.5950.4400.7750.406~1.481性别-0.0370.3050.0140.9040.9640.530~1.753TNM分期0.0490.7490.0040.9481.0500.242~4.555淋巴结转移-0.1440.4310.1120.7370.8660.372~2.013远处器官转移-0.8790.4634.5980.043*0.4150.167~1.030病理0.0810.6420.0160.8991.0850.308~3.814TAP-10.0680.9450.0050.9420.9340.147~5.949TAP-20.6551.0210.4120.5210.5190.070~3.844HLA-I0.5800.7774.5570.045*0.5600.122~2.568
3 讨 论
抗原处理相关转运体是MHC-I类分子抗原递呈途径中的重要分子。其主要功能是与低分子多肽复合物-2、7(1ow molecular mass polypeptide, LMP-2、7)一起加工、转运内源性抗原肽(其中包括肿瘤抗原)至内质网,在内质网锚定的MHC(主要是HLA-1)结合抗原肽后将其呈递至细胞表面供CD8+细胞毒性T淋巴细胞(CTLs)识别,从而启动细胞免疫。由于MHC-I类基因、TAP基因、LMP-2及LMP-7基因位置靠近,转录活性同时受干扰素的诱导,能够协调三者基因产物的量,有效提呈抗原,故三者构成的系统被比喻成真核生物MHC-I类分子抗原加工和提呈的“操纵子”。 在肿瘤免疫应答过程中,MHC-I类分子限制的CD8+细胞毒性T淋巴细胞(CTLs)在阻止肿瘤的发生、发展过程中起关键作用。MHC-I类分子抗原加工和提呈的“操纵子”的任何组分的改变对肿瘤免疫应答第一信号的产生有直接影响。这些分子的减少或丢失可能反映了肿瘤细胞在MHC-I类分子向T细胞递呈免疫源性多肽这一作用而选择的一种逃避机制。
TAP-1启动子是593 bp的双向启动子,包含IFN-r反应元件、p53反应元件和NF-κB结合位点。其中任何异常调节反应元件及影响NF-κB的因素都可以引起TAP基因的表达异常,从而影响抗原加工和提呈的“操纵子”,最终引起肿瘤细胞表面抗原的表达异常。如果肿瘤细胞表面的TAP蛋白表达下降,将会导致肿瘤细胞的MHC-I类分子的表达下降或缺如[7-10],结果是肿瘤不呈现或仅呈现弱的抗原性,导致肿瘤抗原无法被递呈给CD8+的T细胞,从而逃脱免疫监管,这是肿瘤免疫逃逸的一个重要机制。
本文鼻咽癌组织中TAP-1、TAP-2及HLA-I阳性表达分别43.1%、46.55%、50%,均显著低于鼻咽正常组织中的表达。这提示鼻咽癌患者对肿瘤抗原提呈功能减弱,肿瘤细胞很可能发生免疫逃逸。我们进一步检测鼻咽癌患者的CD4+T、CD8+T细胞及IL-10的表达变化。具有免疫抑制作用的IL-10表达增加,CD4+T细胞明显减少,而CD8+T细胞无明显差异。但是, TAP-1、TAP-2、HLA-I表达阳性鼻咽癌中CD8+T细胞表达升高,而IL-10表达减少。这提示TAP-1、TAP-2、HLA-I表达与肿瘤免疫密切相关,鼻咽癌TAP-1、TAP-2、HLA-I的下调,将抑制具有细胞毒性T淋巴细胞(CD8+T细胞)的数量,同时具有免疫抑制作用的IL-10分泌增加也将加剧细胞免疫功能的下降,这将为鼻咽癌细胞逃脱机体免疫监视创造条件。
我们发现临床分期、有无淋巴结转移、有无远处器官转移、病理分型、TAP-1表达、TAP-2表达、HLA-I表达与鼻咽癌患者预后相关。将这7项引入logistic模型,显示远处转移、HLA-I表达是鼻咽癌独立预后因素。HLA-I分子表达下调导致鼻咽癌患者生存率下降,这与其他研究者结果相一致[11-15]。提示HLA-I分子参与的肿瘤细胞免疫发挥着关键性作用, HLA-I分子表达下调或缺失将预示着患者的预后不良。
本研究提示我们在临床治疗中检测HLA-I分子的表达将可能作为鼻咽癌预后不良因素的指标之一。HLA-I分子低表达的鼻咽癌患者预示着将接受更加有力的治疗方案。同时,可以提高患者HLA-I分子表达的生物治疗也可作为该类患者的治疗选择。
参考文献:
[1] 黄光武. 鼻咽癌的基础研究[J]. 中国耳鼻咽喉头颈外科,2010,17(3):113-115.
[2] 任艳鑫,李晓江,杨洁,等. 鼻咽癌组织中BCRF-1基因表达及其与免疫功能的相关性分析[J]. 西安交通大学学报:医学版,2012,33(4):494-497.
[3] SINGAL DP, YE M, BIENZLE D. Transfection of TAP 1 gene restores HLA class I expression in human small-cell lung carcinoma[J]. Int J Cancer, 1998, 75(1):112-116.
[5] WANG X, NI J, HSU CL, et al. Reduced expression of tocopherol-associated protein (TAP/Sec14L2) in human breast cancer[J]. Cancer Invest, 2009, 27(10):971-977.
[6] FACOETTI A, NANO R, ZELINI P, et al. Human leukocyte antigen and antigen processing machinery component defects in astrocytic tumors[J]. Clin Cancer Res, 2005, 11(23):8304-8311.
[7] EVERETT MW, EDIDIN M. Tapasin increases efficiency of MHC I assembly in the endoplasmic reticulum but does not affect MHC I stability at the cell surface[J]. J Immunol, 2007, 179(11):7646-7652.
[8] LI XL, ZHANG D, KNIGHT D, et al. Priming of immune responses against transporter associated with antigen processing (TAP)-deficient tumours: tumour direct priming[J]. Immunology, 2009, 28(3):420-428.
[9] TOURKOVA IL, SHURIN GV, FERRONE S, et al. Interferon regulatory factor 8 mediates tumor-induced inhibition of antigen processing and presentation by dendritic cells[J].Cancer Immunol Immunother, 2009, 58(4):567-574.
[10] 钟华,韩宝惠.紫杉醇通过上调TAP-1,TAP-2以及消除调节性T细胞逆转肺癌免疫逃逸[J].中国肺癌杂志,2010,13(10):937-941.
[11] TANAKA K, TSUCHIKAWA T, MIYAMOTO M, et al. Down-regulation of human leukocyte antigen class I heavy chain in tumors is associated with a poor prognosis in advanced esophageal cancer patients[J]. Int J Oncol, 2012, 40(4):965-974.
[12] SELIGER B, ATKINS D, BOCK M, et al. Characterization of human lymphocyte antigen Class I antigen processing machinery defects in renal cell carcinoma lesion with special emphasis on transporter-associated with antigen-processing down-regulation[J]. Clin Cancer Res, 2003, 9(5):1721-1727.
[13] HANAGIRI T, SHIGEMATSU Y, SHINOHARA S, et al. Clinical significance of expression of cancer/testis antigen and down-regulation of HLA class-I in patients with stage I non-small cell lung cancer[J]. Anticancer Res, 2013, 33(5):2123-2128.
[14] TORIGOE T, ASANUMA H, NAKAZAWA E, et al. Establishment of a monoclonal anti-pan HLA class I antibody suitable for immunostaining of formalin-fixed tissue: unusually high frequency of down-regulation in breast cancer tissues[J]. Pathol Int, 2012, 62(5):303-308.
[15] BANDOH N, OGINO T, KATAYAMA A, et al. HLA class I antigen and transporter associated with antigen processing downregulation in metastatic lesions of head and neck squamous cell carcinoma as a marker of poor prognosis[J]. Oncol Rep, 2010, 23(4):933-939.

