水解度对蚕蛹蛋白酶解物的物化特性和抗氧化能力的影响
刘偲琪, 方佳茂, 刘红梅, 杜金华, 孙中涛,*
(1.山东农业大学食品科学与工程学院,山东泰安 271018;2.广东环西生物科技股份有限公司,广东普宁 515300;3.山东农业大学生命科学学院,山东泰安 271018)
我国是世界上最大的蚕丝生产国,作为蚕丝生产的副产物,鲜蚕蛹年产量高达50万t以上,占世界总产量的70%.蚕蛹不仅蛋白质含量高达45%~50%,氨基酸组成合理,而且还具有保护肝脏、提高免疫力、促进生长、降低血糖和血压及抗癌等多种药理作用[1].然而,蚕蛹蛋白的溶解性、乳化性和起泡性等物化特性较差,还具有特殊的气味,限制了它在食品工业中的应用.因此,蚕蛹目前除小部分被直接食用外,大部分被用作饲料与肥料,其资源价值未能得到充分利用[2].
对动植物蛋白原料进行适度酶解是改善其溶解性、乳化性和起泡能力等物化性质和提高抗氧化能力等生理活性的常用方法[3].通过酶解改性提高蚕蛹资源的利用率,提升其资源价值得到许多学者的关注.蚕蛹蛋白酶解物主要成分是蚕蛹肽和少量游离氨基酸.目前已有许多研究致力于蛋白酶的选择与酶解工艺的优化,以提高水解度与产品得率,但尚未涉及水解度对蚕蛹蛋白酶解物的溶解性、乳化性和起泡能力等物化特性与抗氧化能力的影响[4-5],这导致蚕蛹蛋白酶解时盲目追求高水解度,而不能按照产品的具体要求对水解度进行合理控制.
本研究采用蛋白酶对蚕蛹蛋白进行不同程度的水解,获得不同水解度的蚕蛹蛋白酶解物,并对其溶解性、乳化性、起泡能力与抗氧化能力进行测定,以确定水解度对其物化特性和抗氧化能力的影响,为蚕蛹蛋白酶解过程中对水解度进行合理控制提供理论依据.
1 材料与方法
1.1 材料与试剂
蚕蛹蛋白粉(脱脂蚕蛹)从泰安信得利生物工程有限公司购买,其蛋白质质量分数为66%.复合蛋白酶由济宁和美生物工程有限公司生产,其酶系组成为碱性蛋白酶1×105U/g,中性蛋白酶5×104U/g.1,1-二苯基-2-苦肼基自由基(DPPH)与水杨酸购自Sigma公司,其他试剂均为国产分析纯试剂.
1.2 仪器与设备
pHS-3C型数字酸度计 ,上海雷磁仪器厂;电子天平,上海恒平科学仪器有限公司;数显恒温水浴锅,国华电器有限公司;磁力搅拌器,国华电器有限公司;离心机,上海安亭科学仪器厂;恒温振荡器,太仓市实验设备厂;UV2800型紫外可见分光光度计,上海精密科学仪器有限公司;实验室小型喷雾干燥机,上海达成实验设备有限公司.
1.3 蚕蛹蛋白的酶解
称取50 g蚕蛹蛋白粉,加入350 mL去离子水,搅拌均匀,90℃水浴加热10 min使蛋白质适度变性,然后冷却至55℃,加入质量分数为3%的复合蛋白酶,于55℃进行酶解,酶解结束后,升温至90℃维持10 min进行灭酶.酶解液经真空抽滤获得澄清滤液.滤液采用小型喷雾干燥机进行喷雾干燥,进口温度200℃,出口温度75℃.控制不同的酶解时间,可以获得不同水解度的蚕蛹酶解物.
1.4 水解度的测定[6]
水解度(degree of hydrolysis,DH)是水解过程中所断裂的肽键数占总肽键数的百分比.肽键断裂后生成多肽或氨基酸,α-氨基氮含量增加,因此,水解度可根据水解过程中生成的α-氨基氮的数量,依据式(1)计算.

水解后生成的α-氨基氮的量采用甲醛滴定法测定,样品总含氮量采用凯氏定氮法测定(参照国标GB/T 23530—2009).
1.5 溶解性的测定
参考Parrado等[7]的测定方法.准确称取1.000 g蚕蛹蛋白酶解物,溶于99 mL去离子水中,配成1%的溶液,采用2 mol/L HCl或NaOH调节至所需的pH值,搅拌均匀,4 000 r/min离心30 min,测定上清液的氮含量.溶解性等于上清液氮含量与原始溶液氮含量的比值,通常以百分数的形式表示.
1.6 乳化性的测定
参考Klompong等[8]的测定方法并稍有改动.将30 mL 1%的蚕蛹蛋白酶解物溶液与10 mL植物油混匀,采用2 mol/L HCl或NaOH调节至所需的pH值,用高速剪切乳化机以10 000 r/min的速度均质1 min,制得乳状液.分别在0,10 min时从底部吸取100 μL乳状液,加入10 mL 0.1%的SDS(十二烷基硫酸钠)溶液中,混匀,以0.1%的SDS作空白对照,测定其在500 nm处的吸光度A0和A10.A0即为乳化性(EA),乳化稳定性(ES)用式(2)计算.

1.7 起泡性的测定
参考Klompong等[8]的测定方法并稍有改动.配制0.5%的蚕蛹蛋白酶解物溶液,采用2 mol/L HCl或NaOH调节至所需的pH值,吸取20 mL,用搅拌器搅拌20 min,记录0 min与10 min时泡沫的体积A0与At.起泡性FC=(A0-B)/B×100%;起泡稳定性用式(3)计算.式(3)中B为搅拌之前的体积.
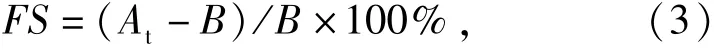
1.8 抗氧化能力测定
1.8.1 还原力
采用Osawa等[9]的方法.吸取1.0 mL不同浓度的蚕蛹蛋白酶解物溶液,加入2.5 mL 0.1 mol/L的磷酸盐缓冲液和2.5 mL 1%的铁氰化钾溶液,充分混合,于50℃保温20 min,再加入2.5 mL 10%的三氯乙酸,充分混合后于3 000 r/min离心10 min.取2.5 mL上清液,加入2.5 mL蒸馏水和2.5 mL 0.l%FeCl3溶液,然后在700 nm波长下测定吸光度A700.
1.8.2 DPPH自由基清除能力
采用Yamagucei等[10]的方法.取2 mL不同浓度的蚕蛹蛋白酶解物溶液,添加至2 mL 0.2 mmol/L的DPPH的95%乙醇溶液中,混合均匀,室温下放置30 min,于517 nm处测定吸光值A1.以95%乙醇溶液代替DPPH乙醇溶液,按上述方法测定吸光度A2,以蒸馏水代替蚕蛹蛋白酶解物溶液,按上述方法测定吸光度A3.DPPH自由基清除能力按式(4)计算.

1.8.3 超氧阴离子自由基清除能力
采用Nicholas等[11]的方法并稍加改动.向4.5 mL 0.05 mol/L的Tris-HCl(pH 8.2)缓冲液中加入1.0 mL蚕蛹蛋白酶解物溶液(空白组加入相同体积的蒸馏水),再加入0.3 mL 0.03 mol/L的邻苯三酚溶液(以0.01 mol/L的HCl配制),振荡3 min,加入50 μL 10%抗坏血酸溶液,混合均匀,迅速于325 nm处测定吸光度As(空白组的吸光度A0),并按式(5)计算超氧阴离子自由基清除能力.

1.8.4 羟基自由基清除能力[12]
取2 mL不同浓度的蚕蛹蛋白酶解物溶液(0.5~2.5 mg/mL),依次加入2 mL 6 mmol/L的硫酸亚铁、2 mL 6 mmol/L的H2O2,混合均匀,静置10 min,再加入2 mL 6 mmol/L的水杨酸,混匀、静置30 min后于510 nm处测吸光度Ai.空白组以双蒸水代替水杨酸,按上述方法测定吸光度Aj,对照组以双蒸水代替蚕蛹蛋白酶解物溶液,按上述方法测定吸光度A0.羟自由基清除能力按式(6)计算.

2 结果与分析
2.1 酶解时间对水解度的影响
蚕蛹蛋白酶解过程中水解度的变化曲线如图1.酶解初期蛋白质水解速度很快,水解度迅速上升,12 h后水解速率变缓,这与Jamdar等[13]报道的花生蛋白的酶解曲线类似.酶解过程中蛋白酶活力损失,酶解产物的反馈抑制作用和可被水解的肽键浓度降低均可导致水解速度下降,但后者是导致水解速率降低的主要原因[14].各种水解度的酶解物可以通过控制不同酶解时间来获得,制备水解度为5%,15%,25%和35%的蚕蛹蛋白酶解物所需的酶解时间分别为90 min,6 h,10 h与16 h.
2.2 水解度对溶解性的影响

图1 酶解时间与水解度的关系Fig.1 Effect of hydrolysis time on DH
不同水解度的蚕蛹蛋白酶解物在pH值为2~10时的溶解性如图2.蚕蛹蛋白酶解后溶解性显著提高,且水解度越大溶解性越好.这和花生蛋白、鲑鱼蛋白酶解物的溶解性与水解度的相关性是一致的[13,15].提高水解度可以改善溶解性,是因为蛋白质水解成肽后,亲水基团得到充分暴露,疏水性基团的疏水作用力被亲水基团的亲水作用力平衡,使溶解性增强[16].未经酶解的蚕蛹蛋白在碱性条件及pH值小于3的条件下具有较好的溶解性,但受等电点效应的影响,蚕蛹蛋白在pH值为4~6时溶解性较差[17].蚕蛹蛋白经适度水解后,等电点效应不再明显,在pH值为4~6时的溶解性得到显著改善,当水解度≥35%时,溶解性接近100%.

图2 水解度与蚕蛹蛋白酶解物溶解性的关系Fig.2 Effect of DH on solubility of silkworm pupa protein hydrolysates
2.3 水解度对乳化性的影响
水解度对蚕蛹蛋白酶解物乳化性(EA)和乳化稳定性(ES)的影响如图3.蚕蛹蛋白水解后乳化性与乳化稳定性在pH值为5~9时均有不同程度的降低,这种现象也见于鲑鱼肌肉蛋白的酶解物[18],其原因可能是酶解后肽链变短,使溶液界面张力下降,不能在油-水界面形成高黏弹性的保护膜.然而,水解度为5%的蚕蛹蛋白酶解物在pH值为3时的乳化性高于蚕蛹蛋白,这可能是因为在水解初期蛋白质疏水性增加,溶液的黏度下降,阻止了胶束周围的小油滴的形成,从而提高了其乳化活性[17].

图3 水解度与蚕蛹蛋白酶解物乳化性与乳化稳定性的关系Fig.3 Effect of DH on emulsifying activity and emulsifying stability of silkworm pupa protein hydrolysates
2.4 水解度对起泡性的影响
水解度对蚕蛹蛋白酶解物起泡能力(FC)和起泡稳定性(FS)的影响如图4.在酸性和中性条件下(pH值为3~7),蚕蛹蛋白酶解后起泡能力显著增强,在水解度为5%时,起泡能力最强,此后随着水解度的增加,起泡能力降低.其原因是起泡性受表面张力的影响,蛋白质轻度水解后溶液黏度与表面张力降低,对泡沫的形成比较有利;但水解度较高时,酶解产物的分子量过小,溶液黏度与表面张力过低,起泡能力反而下降.但在碱性pH值时,蚕蛹蛋白酶解后起泡能力反而下降,其原因可能是蚕蛹蛋白在碱性条件下溶解性好,起泡性也比较高,酶解后分子量降低,溶液黏度和表面张力降低,起泡能力反而下降.水解度对起泡稳定性的影响也十分显著(p<0.01),水解度为5%时起泡稳定性远高于蚕蛹蛋白和其他水解度时的酶解物,这说明轻度水解有利于提高起泡稳定性,但深度水解时产物分子量小,溶液黏度与表面张力过低,不利于溶液的起泡稳定性.

图4 水解度与蚕蛹蛋白酶解物起泡性与起泡稳定性的关系Fig.4 Effect of DH on foaming activity and foaming stability of silkworm pupa protein hydrolysates
2.5 水解度对还原力的影响
还原力是抗氧化剂提供电子或氢的能力,与其抗氧化活性有直接的关系.水解度对蚕蛹蛋白酶解物还原力的影响如图5.蚕蛹蛋白酶解后还原力显著提高,水解度为5%时,还原力最大,此后再增加水解度,还原力反而下降.荞麦蛋白酶解时,水解度对还原力的影响也存在类似的规律,在水解度为5%时还原力最大[19].不同水解度的蚕蛹蛋白酶解物在2.5 mg/mL时还原力为0.107~0.170,与相同浓度时鹰嘴豆蛋白酶解物的还原力相同,但比苜蓿叶蛋白和花生蛋白酶解物的还原力稍低[13、20-21].
2.6 水解度对DPPH自由基清除能力的影响

图5 水解度与蚕蛹蛋白酶解物还原力的关系Fig.5 Effect of DH on reducing power of silkworm pupa protein hydrolysates
DPPH自由基在乙醇溶液中稳定,且在517 nm处有较强的吸光度,可通过简单的方法进行定量检测,已广泛应用于测定天然抗氧化剂的抗氧化能力.水解度对蚕蛹蛋白酶解物DPPH自由基清除能力的影响如图6,水解度为5%时DPPH自由基清除能力最强;在5%~25%的水解度范围内蚕蛹蛋白酶解物均具有较高的DPPH自由基清除能力,但水解度增加至35%时,DPPH自由基清除力降低显著(p<0.1).黄条纹鲹蛋白酶解物的DPPH自由基清除能力也具有类似的变化规律[8],但花生蛋白酶解物[13]的水解度越高DPPH自由基清除能力越强,这说明水解度对DPPH自由基清除能力的影响十分复杂,与蛋白质原料和蛋白酶种类有关.

图6 水解度与蚕蛹蛋白酶解物DPPH自由基清除能力的关系Fig.6 Effect of DH on DPPH radical scavenging ability of silkworm pupa protein hydrolysates
2.7 水解度对超氧阴离子自由基清除能力的影响
超氧阴离子自由基毒性很强,可以通过歧化等化学反应生成羟基自由基和过氧化氢,引起DNA和细胞膜损伤,对超氧阴离子自由基的清除能力是表征抗氧化剂的抗氧化能力的一个重要指标.水解度对蚕蛹蛋白酶解物超氧阴离子自由基清除能力的影响如图7.水解度较低时,超氧阴离子自由基清除能力随水解度的升高而增大,水解度15%时达到最大,继续增大水解度,超氧阴离子自由基清除能力反而下降.据Zhang等[22]报道,花生蛋白轻度水解时超氧阴离子自由基清除能力也随着水解度的上升而增加,这与本研究的结果是一致的,但其实验中花生蛋白的水解度均较小,未能观察到超氧阴离子自由基清除能力到达最大值后会随着水解度上升而下降的现象.

2.8 水解度对羟基自由基清除能力的影响
羟基自由基十分活跃,具有潜在的毒性,在人体内很容易与氨基酸、蛋白质和DNA发生反应并导致生理上的紊乱.如图8所示,蚕蛹蛋白酶解后清除羟基自由基的能力显著提高(p<0.05),水解度5%时羟基自由基清除能力最大,继续增大水解度羟基自由基的清除能力反而下降,但下降的速度十分缓慢,至水解度35%时,羟基自由基清除能力与最大值相比仅下降3.8%,仍比蚕蛹蛋白高30.64%.据You等[23]报道,泥鳅蛋白水解时羟基自由基清除力也随着水解度上升而增加,至水解度23%时达到最大,之后再增加水解度,羟基自由基清除能力开始下降,这一规律和本研究结果是一致的.

图8 水解度与蚕蛹蛋白酶解物羟基自由基清除能力的关系Fig.8 Effect of DH on hydroxyl radical scavenging activity of silkworm pupa protein hydrolysates
3 结 论
研究了水解度对蚕蛹蛋白酶解物的溶解性、乳化性和起泡性等物化性质的影响,以及水解度对蚕蛹蛋白酶解物的还原力,对DPPH自由基、超氧阴离子自由基和羟基自由基清除能力等抗氧化性质的影响.在pH值为2~10时,酶解可以显著改善蚕蛹蛋白的溶解性,且水解度越大溶解性越好,水解度至35%时,蚕蛹蛋白酶解物已可以完全溶解.蚕蛹蛋白酶解后乳化性与乳化稳定性在pH值为5~9时均有不同程度的降低.蚕蛹蛋白酶解后起泡性和起泡稳定性在水解度为5%时达到最高,继续水解起泡性和起泡稳定性反而下降.蚕蛹蛋白酶解后抗氧化性提高,水解度为5%时,还原力和对DPPH自由基和羟基自由基清除能力最大,但水解度为15%时超氧阴离子自由基清除能力最大,过度水解反而不利于其抗氧化能力的提高.目前对动植物蛋白酶解工艺的研究多将提高水解度作为目标,未充分考虑水解度对酶解产物物化性质与抗氧化能力等生理活性的影响,这样做是欠妥的,水解过程应根据生产目的控制一个最佳水解度,并非水解度越高越好.
[1] 杨海霞,朱祥瑞,陆洪省.蚕蛹在医学上的应用研究进展[J].科技通报,2002,18(4):318-322.
[2] Rangacharyulu P V,Giri S S,Paul B N,et al.Utilization of fermented silkworm pupae silage in feed for carps[J].Bioresource Technology,2003,86(1):29-32.
[3] Panyam D,Kilara A.Enhancing the functionality of food proteins by enzymatic modification[J].Trends in Food Science and Technology,1996,7(4):120-125.
[4] 李爱玲,高兰兴.氨基酸对心血管功能的影响[J].氨基酸和生物资源,1998,20(2):45-49.
[5] 周爱梅,彭凯文,张桂珍,等.酶解蚕蛹蛋白及其应用研究[J].广州食品工业科技,1995,11(2):11-14.
[6] 邵伟,乐超银,涂志英,等.响应面法优化发酵大豆多肽工艺条件研究[J].食品科技,2007(6):81-85.
[7] Parrado J,Bautista J,Machado A.Production of soluble enzymatic protein hydrolysate from industrially defatted undehulled sunflower meal[J].Journal of Agriculture and Food Chemistry,1991,39(4):447-450.
[8] Klompong V,Benjakul S,Kantachote D,et al.Antioxidative activity and functional properties of protein hydrolysate of yellow stripe trevally(selaroides leptolepis)as influenced by the degree of hydrolysis and enzyme type[J].Food Chemistry,2007,102(4):1317-1327.
[9] Osawa T N,Amiki M A.Novel type of antioxidant isolated from leaf wax of eucalyptus leaves[J].Agriculture and Biological Chemistry,1981,45:735-739.
[10] Yamagucei T,Tasamura H,Matob A,et al.HPLC method for evaluation of the free radieal-scavenging activity of foods by using 1,1-dipheny 1-2-picrylhydrazy[J].Bioscience Biotechnology and Biochemistry,1998,62(6):1201-1204.
[11] Nicholas S,Cumbes Q J.Hydroyl radical scavenging activity of compatible solutes[J].Phytochemistry,1989,28(4):1057-1060.
[12] 吴琼英,贾俊强.柚皮黄酮的超声辅助提取及其抗氧化性研究[J].食品科学,2009,30(2):29-33.
[13] Jamdar S N,Rajalakshmi V,Pednekar M D,et al.Influence of degree of hydrolysis on functional properties,antioxidant activity and ACE inhibitory activity of peanut protein hydrolysate[J].Food Chemistry,2010,121(1):178-184.
[14] Guerard F,Dufosse L,De La Broise D,et al.Enzymatic hydrolysis of proteins from yellowfin tuna(Thunnus albacares)wastes using alcalase[J].Journal of Molecular Catalysis B:Enzymatic,2001,11(4):1051-1059.
[15] Gbogouri G A,Linder M,Fanni J,et al.Influence of hydrolysis degree on the functional properties of salmon byproducts hydrolysates[J].Journal of Food Science,2004,69(8):615- 622.
[16] Chobert J M,Bertrand-harb C,Nicolas M G.Solubility and emulsifying properties of caseins and whey proteins modified enzymatically by trypsin[J].Journal of Agricultural and Food Chemistry,1988,36(5):883-886.
[17] 韩仁娇,刘春红,冯志彪.不同酶切方式对乳清蛋白疏水性和乳化性的影响[J].中国乳品工业,2011,39(10):15-18.
[18] Kristinsson H G,Rasco B A.Biochemical and functional properties of At-lantic salmon(Salmo salar)muscle proteins hydrolyzed with various alkaline proteases[J].Journal of Agriculture and Food Chemistry,2000,48(3):657-666.
[19] Tang Chuanhe,Peng Jing,Zhen Dawen,et al.Physicochemical and antioxidant properties of buckwheat(fagopyrum esculentum Moench)protein hydrolysates[J].Food Chemistry,2009,115(2):672-678.
[20] Xie Zhengjun,Huang Junrong,Xu Xueming,et al.Antioxidant activity of peptides isolated from alfalfa leaf protein hydrolysate[J].Food Chemistry,2008,111(2):370-376.
[21] Li Yanhong,Jiang Bo,Zhang Tao,et al.Antioxidant and free radical-scavenging activities of chickpea protein hydrolysate(CPH)[J].Food Chemistry,2008,106(2):444-450.
[22] Zhang Youwei,Zhang Hui,Wang Li,et al.Influence of the degree of hydrolysis(DH)on antioxidant properties and radical-scavenging activities of peanut peptides prepared from fermented peanut meal[J].European Food Research and Technology,2011,232(6):941-950.
[23] You Lijun,Zhao Mouming,Cui Chun,et al.Effect of degree of hydrolysis on the antioxidant activity of loach(Misgurnus anguillicaudatus)protein hydrolysates[J].Innovative Food Science and Emerging Technologies,2009,10(2):235-240.

