原木灵芝破壁孢子粉对小鼠免疫功能的影响*
吴学谦,吴学良,楼利明,赵中山,陈如楚,徐 娟,李青青,许海顺,党亚丽
(1.浙江五养堂药业有限公司,丽水市食用菌研究开发中心,浙江 丽水 323000;2.浙江省医学科学院,浙江 杭州 310013)
原木灵芝破壁孢子粉对小鼠免疫功能的影响*
吴学谦1,2,吴学良1,楼利明1,赵中山1,陈如楚1,徐 娟2,李青青2,许海顺2,党亚丽2
(1.浙江五养堂药业有限公司,丽水市食用菌研究开发中心,浙江 丽水 323000;2.浙江省医学科学院,浙江 杭州 310013)
通过设3个浓度的原木灵芝破壁孢子粉药物组和阴性对照组,分别进行ConA诱导的小鼠脾淋巴细胞转化试验,绵羊红细胞诱导小鼠DTH试验,小鼠血清溶血素测定,抗体生成细胞检测,小鼠腹腔巨噬细胞吞噬鸡红细胞试验,小鼠碳廓清试验,NK细胞活性测定试验和脏器指数测定。结果表明,与阴性对照组比较,低、中、高3个剂量原木灵芝破壁孢子粉均能提高小鼠脾淋巴细胞的增殖能力,差异均有显著性;高剂量组能提高小鼠左后足跖部24 h与0 h厚度差,差异有显著性;中剂量、高剂量组均能提高小鼠溶血空斑数,差异有显著性。说明原木灵芝破壁孢子粉具有较强的免疫调节作用。
原木灵芝破壁孢子粉;免疫力;灵芝多糖;灵芝三萜
灵芝为多孔菌科真菌赤芝(Ganoclermalucidum)的干燥子实体(2010年版《中华人民共和国药典》),性温味淡、养心安神、补气益血,是我国传统的扶正固本、滋补强壮的名贵中药,具有极高的医疗保健和营养价值[1]。
原木灵芝是选用优质适生阔叶树原木为栽培材料,接种优质高产灵芝菌种,采用仿野生灵芝生长的原生态环境进行仿生栽培,根据孢子粉的生长时间与弹射时间分3期~4期采集孢子粉。目前,丽水原木灵芝被确定为“丽九味”浙江丽水地道药材,丽水下辖龙泉栽培的灵芝和灵芝孢子粉均获得了国家地理标志保护产品,正在被许多厂家选用为增强免疫力保健食品的主要原料。之前作者曾研究了“灵芝多糖提取物对小鼠免疫功能的影响”[2],尚不清楚经破壁的原木灵芝孢子粉对小鼠免疫调节功能的影响情况,不经提取有效成分而直接选用原木灵芝破壁孢子粉作为增强免疫力的保健食品原料是否可行。
灵芝孢子粉富含灵芝多糖、灵芝三萜、蛋白质、酶类、硒元素等特殊成分,据报道具有增强免疫力、保护肝损伤、抑制肿瘤细胞生长等药效[3-5]。但由于灵芝孢子具有双层细胞壁,其组成为既不溶于水也不溶于酸的几丁质,大大降低其生物利用度,因此灵芝孢子粉作为保健食品原料需进行破壁处理。破壁后灵芝孢子粉吸收更迅速、完全,功效更明显[6]。目前大部分灵芝孢子粉采用振动式破壁设备进行破壁,破壁过程容易产生高温环境使孢子粉的活性物质氧化褐变,导致孢子粉颜色变深,同时造成了重金属铬镍残留。本研究选用可防氧化、焦化和重金属污染的水冷降温超微技术破壁加工的丽水原木破壁灵芝孢子粉为试验材料,研究原木灵芝破壁孢子粉对小鼠免疫调节功能的影响,以期为开发增强免疫力功能保健食品提供理论依据。
1 材料与方法
1.1 材料
1.1.1 原木灵芝破壁孢子粉
原木灵芝破壁孢子粉由浙江五养堂药业有限公司提供,水冷降温超微技术破壁加工,破壁率99%,淡棕色,无焦化颗粒,入口无颗粒感,粉末装。试验前将样品以蒸馏水为溶媒配置成各剂量,混匀供试。
1.1.2 实验动物
实验用ICR小鼠,由上海西普尔-必凯实验动物有限责任公司提供,实验动物生产许可证号:SCXK(沪)2008-0016,清洁级,雌性,体重(20±2) g。饲料由浙江省实验动物中心提供,执行标准GBL4924 2001。检测环境条件,温度20℃~24℃,相对湿度40%~70%。试验动物适应性喂养1周后按体重随机分成4组,每组10只,各组平均体重基本相同。
1.1.3 试剂
Hank's液:美国Hy Clone公司;RPMI-1640培养基:Pharmacia公司;刀豆蛋白A(ConA):美国Sigma公司;四甲基偶氮唑盐(MTT):美国Sigma公司;印度墨汁:Winsaw &Newton 公司。
1.1.4 仪器
超净工作台:苏州净化设备工程有限公司;恒温CO2培养箱:美国Thermo公司;722分光光度计:上海精密科学仪器有限公司;酶标仪:美国Thermo公司。
1.2 方法
1.2.1 灌胃剂量及方法
灵芝破壁孢子粉设低、中、高3个剂量组和1个阴性对照组。低、中、高3个剂量分别为250 mg·kg-1、500 mg·kg-1、 1 500 mg·kg-1,相当于人推荐量的5倍、10倍和30倍(人推荐量为1.4 g·d-1~2.1 g·d-1,本试验以1.4 g·d-1计)。灌胃给样品,灌胃容量按0.01 mL·g-1体重计,阴性对照组给予同体积的蒸馏水。参照卫生部《保健食品检验与评价技术规范》(2003年版)中的方法对小鼠进行免疫功能的测定[7]。
1.2.2 ConA诱导小鼠脾淋巴细胞转化试验(MTT法)
各组灌胃给样品,每天1次,连续30 d。在试验第30天,每鼠无菌取脾,置于盛有适量无菌Hank's液的小平皿中,用镊子轻轻撕碎,制成单细胞悬液,200目筛网过滤,洗涤,计数,最后用RPMI-1640完全培养液调整细胞浓度为3×106个·mL-1。将细胞悬液分两孔加入24孔培养板中,每孔1 mL,1孔加75 μL ConA液(相当于7.5 μg·mL-1),另1孔作为对照,置37℃、5%CO2培养箱中培养72 h。培养结束前4 h,每孔轻轻吸去上清液0.7 mL,加入0.7 mL不含小牛血清的RPMI1640培养液,同时加入MTT(5 mg·mL-1)50 μL·孔-1,继续培养4 h。培养结束后,每孔加入1 mL酸性异丙醇,吹打混匀,使紫色结晶完全溶解。在570 nm波长处测定光密度值(OD)。最后用加ConA孔的光密度值减去不加ConA孔的光密度值代表淋巴细胞的增殖能力。
1.2.3 绵羊红细胞(SRBC)诱导小鼠迟发型变态反应(DTH)试验(足跖增厚法)
各组灌胃给样品,每天1次,连续30 d。在试验第25天,每只鼠腹腔注射0.2 mL 2%(v·v-1)压积绵羊红细胞(SRBC)悬液,进行免疫。免疫后4 d,测量左后足跖部厚度,然后在测量部位皮下注射20%(v·v-1)SRBC,每只鼠20 μL(约1×108个SRBC),注射后于24 h测量左后足跖部厚度,同一部位测量3次,取平均值。
1.2.4 小鼠血清溶血素测定(血凝法)
各组灌胃给样品,每天1次,连续30 d。在试验第25天,每只鼠腹腔注射0.2 mL 2%(v·v-1)压积绵羊红细胞(SRBC)悬液,进行免疫。5 d后,取血离心,收集血清,用生理盐水将血清倍比稀释,37℃温箱孵育3 h,观察血球凝集程度,计算抗体积数。
1.2.5 抗体生成细胞检测(Jerne改良玻片法)
各组灌胃给样品,每天1次,连续30 d。在试验第25天,每只鼠腹腔注射0.2 mL 2%(v·v-1)压积绵羊红细胞(SRBC)悬液,进行免疫。5 d后,每鼠无菌取脾,置于盛有适量无菌Hank's液的小平皿中,用镊子轻轻撕碎,制成单细胞悬液,200目筛网过滤,洗涤,计数,最后用RPMLL640完全培养液调整细胞浓度为5×106个·mL-1。将表层培养基(1 g琼脂糖加双蒸水至100 mL)加热溶解后,放45℃水浴保温,与等量pH7.2~pH7.4、2倍浓度的Hank's液混合,分装小试管,每管0.5 mL,再向管内加50 μL 10%SRBC(v·v-1,用SA液配制),20 μL脾细胞悬液(5×106个·mL-1),迅速混匀,倾倒于已刷琼脂糖薄层的玻片上,做平行片,待琼脂凝固后,将玻片水平扣放在片架上,放入二氧化碳培养箱中温育1 h~1.5 h,然后用SA缓冲液稀释的补体(1∶8)加入到玻片架凹槽内,继续温育1 h~1.5 h后,计数溶血空斑数。
1.2.6 小鼠腹腔巨噬细胞吞噬鸡红细胞试验(半体内法)
各组灌胃给样品,每天1次,连续30 d。动物处死前30 min,每鼠腹腔内注射20%(v·v-1)鸡红细胞悬液1 mL,处死后再注入2 mL生理盐水,取腹腔液滴片,38℃温箱孵育30 min,固定,染色,镜检,计数100个巨噬细胞,计算吞噬率及吞噬指数。
1.2.7 小鼠碳廓清试验法
各组灌胃给样品,每天1次,连续30 d。在试验第30天,每鼠尾静脉注入用生理盐水稀释3倍~4倍的印度墨汁,按每10 g体重0.1 mL计算,待墨汁注入,立即计时。注入墨汁后2 min、10 min分别从内眦静脉丛取血20 μL,并将其加到2 mL0.1%Na2CO3溶液中,用721分光光度计在600 nm波长处测光密度值(OD),以Na2CO3溶液作空白对照。第2次采血结束后,立即处死小鼠,取肝脏和脾脏,用滤纸吸干脏器表面血污,称重。计算吞噬指数。
1.2.8 NK细胞活性测定(LDH测定法)
各组灌胃给样品,每天1次,连续30 d。在试验第30天,每鼠无菌取脾,置于盛有适量无菌Hank’s液的小平皿中,用镊子轻轻撕碎,制成单细胞悬液,200目筛网过滤,洗涤,计数,最后用RPMLL640完全培养液调整细胞浓度为2×107个·mL-1。试验前24 h将YAC-1细胞(靶细胞)传代培养,应用前用Hank’s液洗3次,用RPMIL640完全培养液调整细胞浓度为4×105个·mL-1。取靶细胞和脾细胞悬液(效应细胞)各100 μL(效靶比50∶1),加入U型96孔培养板中,靶细胞自然释放孔加靶细胞和培养液各100 μL,靶细胞最大释放孔加靶细胞和1%NP40各100 μL;上述各项均设3个复孔,于37℃、5%CO2,培养箱中培养4 h,离心,每孔吸取上清100 μL置平底96孔培养板中,同时加入LDH基质液100 μL,反应5 min,每孔加入1 mol·L-1的HCl 30 μL在490 nm波长处测光密度(OD)值,计算NK细胞活性。
1.2.9 脏器指数测定
各组灌胃给样品,每天1次,连续30 d。处死动物,取其胸腺及脾脏,称重,计算胸腺体重和脾脏体重比值。
1.3 统计方法
2 结果与分析
2.1 灵芝破壁孢子粉对小鼠免疫器官的影响
实验前后小鼠胸腺和脾脏指数见表1。
表1 灵芝破壁孢子粉对小鼠脏器体重比值的影响

表1 灵芝破壁孢子粉对小鼠脏器体重比值的影响
组别剂量∕(mg·kg-1)胸腺(mg)∕体重(g)脾脏(mg)∕体重(g)阴性对照组02.5±0.33.9±0.6低剂量2502.5±0.34.1±1.8中剂量5002.8±0.54.0±0.6高剂量15002.8±0.54.2±1.0F值-1.2530.148p值-0.3050.930
结果表明,灵芝破壁孢子粉低、中、高3个剂量组小鼠胸腺指数和脾脏指数与阴性对照组(蒸馏水)进行比较,差异无显著性(方差分析,p>0.05)。2.2 灵芝破壁孢子粉对小鼠细胞免疫功能的影响
灵芝破壁孢子粉对小鼠细胞免疫功能的影响,见表2。
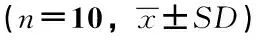
表2 灵芝破壁孢子粉对ConA诱导的小鼠脾淋巴细胞增殖能力及绵羊红细胞诱导小鼠迟发型变态反应(DTH)的影响
注:q检验:与阴性对照组(蒸馏水)比较,*p<0.05。下同。
由表2可知,通过比较各实验组脾淋巴细胞ConA 刺激后的净增值(以OD570值表示),与阴性对照组比较,灵芝破壁孢子粉低、中、高3个剂量组均能提高ConA诱导的小鼠脾淋巴细胞的增殖能力,差异均有显著性(q检验,p<0.05),表明灵芝破壁孢子粉具有刺激脾淋巴细胞增值作用。
绵羊红细胞(SRBC)诱导小鼠DTH(足跖增厚法)试验表明,高剂量组能提高小鼠左后足跖部厚度差24 h与0 h厚度差值,差异有显著性(q检验,p<0.05),表明灵芝破壁孢子粉能提高绵羊红细胞(SRBC)诱导小鼠足跖部肿胀程度,具有促进迟发型变态反应的作用。由此可见,灵芝破壁孢子粉可增强小鼠细胞免疫功能。
2.3 灵芝破壁孢子粉对小鼠体液免疫功能的影响
灵芝破壁孢子粉对小鼠体液免疫功能的影响见表3。
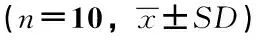
表3 灵芝破壁孢子粉对小鼠抗体生成细胞及血清溶血素的影响
由表3可知,低剂量组、中剂量组和高剂量组小鼠的血清溶血素抗体积数值和阴性对照组相比较,差异均无显著性(p>0.05)。
与阴性对照组比较,中剂量组和高剂量组均能提高小鼠溶血空斑数,差异均有显著性(q检验,p<0.05),表明灵芝破壁孢子粉具有促进抗体生成细胞增值的作用,从而有助于增强小鼠体液免疫功能。
2.4 灵芝破壁孢子粉对小鼠单核巨噬细胞吞噬功能的影响
灵芝破壁孢子粉对小鼠单核巨噬细胞吞噬功能的影响,见表4。
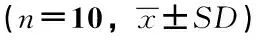
表4 灵芝破壁孢子粉对小鼠腹腔巨噬细胞吞噬鸡红细胞及碳廓清试验吞噬指数的影响

2.5 灵芝破壁孢子粉对小鼠NK细胞活性的影响
灵芝破壁孢子粉对小鼠NK细胞活性的影响情况及结果见表5。
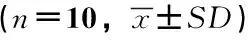
表5 灵芝破壁孢子粉对小鼠NK细胞活性的影响

2.6 灵芝破壁孢子粉对小鼠体重的影响
40只小鼠均通过了试验,未出现不适、异常等现象。与阴性对照组相比较,低剂量、中剂量、高剂量3个剂量组小鼠的体重,在各试验的初期、中期及终期的体重变化量无统计学差异。
3 讨论
原木灵芝破壁孢子粉给予小鼠连续灌胃30 d,能提高ConA诱导的小鼠脾淋巴细胞的增殖能力,促进小鼠的迟发型变态反应,表明灵芝破壁孢子粉对小鼠细胞免疫功能有促进作用。原木灵芝破壁孢子粉中剂量组和高剂量组能提高小鼠溶血空斑数,表明灵芝破壁孢子粉具有促进抗体生成细胞增值的作用,从而有助于增强小鼠体液免疫功能。本研究结果表明,原木灵芝破壁孢子粉具有增强免疫力的效果,可用作研发和生产增强免疫力功能的保健食品主要原料。
灵芝孢子粉氨基酸、不饱和脂肪酸(以油酸、亚油酸为主)、有益矿物元素种类丰富,营养价值较高,尤其是灵芝多糖和三萜类化合物含量高于灵芝子实体超微粉,可强化免疫系统机能、预防肿瘤和心血管疾病[8-12],并且孢子粉中含有特殊的灵芝孢子油,被证实具有改善过敏性体质、抗抑郁、强化肝脏功能和抗氧化等功效[13-16],可进一步通过保健食品功能学评价动物模型,研究从原木灵芝破壁孢子粉中提炼的灵芝孢子油有效成分,对抗酒精性肝损伤、抗氧化和改善睡眠等的影响。
[1]付立忠,吴学谦,李明焱,等. 灵芝品种子实体多糖和三萜含量分析与评价[J]. 中国食用菌,2009,28(4):38-40.
[2] 程俊文,吴学谦,孙培虎,等. 灵芝多糖提取物胶囊对小鼠免疫功能的影响[J]. 中国食用菌,2009,28(6):58-64.
[3] Zhu HS, Yang XL, Wang LB, et al. Effects of extracts from sporoderm-broken spores ofGanodermalucidumon Hela cells[J]. Cell Biol Toxical, 2000(16):201-206.
[4] 林志彬,王鹏云. 灵芝孢子及其活性成分的药理研究[J]. 北京大学学报:医学版,2006,38(5):541-547.
[5] 刘昕,袁剑刚,黄晓霓,等. 灵芝孢子对小鼠肝癌的抑制及其对肝脏的保护作用[J]. 中西医结合肝病杂志,2000,10(5):31-32.
[6] 吴明忠,沈爱光,熊晓辉,等. 灵芝孢子粉破壁前后对小鼠免疫功能影响试验[J]. 食用菌,2001,23(6):36-37.
[7] 中华人民共和国卫生部. 保健食品检验与评价技术规范[S]. 2003:22-35.
[8] Bao XF, Liu CP, Fang JN, et al. Structural and immunological studies of a major polysaccharide from spores ofGanodermalucidum[J]. Carbohydrate Research,2001(332):67-74.
[9] 王鹏云,王赛贞,林树钱,等. 灵芝孢子和破壁孢子多糖对体外培养的小鼠脾淋巴细胞及腹腔巨噬细胞免疫调节活性的比较[J]. 北京大学学报:医学版,2005,37(6):569-574.
[10] 冯鹏,赵丽,赵卿,等. 灵芝孢子多糖对荷瘤小鼠的免疫调节作用[J]. 中国药科大学学报,2007,38(2):162-166.
[11] 江艳,王浩,吕龙,等. 灵芝孢子粉多糖Lzps-1的化学研究及其总多糖的抗肿瘤活性[J]. 药学学报,2005,40(4):347-350.
[12] 李森柱,谢意珍,周静文,等. 灵芝孢子油主要活性成分及降血脂功能的研究[J]. 中国食用菌,2006,25(5):40-42.
[13] 罗俊,林志彬. 灵芝三萜类化合物药理作用研究进展[J]. 药学学报,2002,37(7):574-578.
[14] 唐庆九,季哲,郝瑞霞,等. 灵芝中性三萜类成分的抗肿瘤作用[J]. 食用菌学报,2010,17(1):60-64.
[15] 李敏,仇雯倩,黄金华. 灵芝三萜对小鼠肝损伤的预防和保护作用研究[J]. 现代中西医结合杂志,2009,18(32):3933-3934.
[16] 刘冬,孙海燕,李世敏. 灵芝三萜类物质抗高血压实验研究[J]. 时珍国医国药,2007,18(2):307-309.
Effects of Sporoderm-brokenGanodermaSpores Cultivated by Logs on the Immune Function in Mice
WU Xue-qian1,2, WU Xue-liang1, LOU Li-ming1, ZHAO Zhong-shan1,CHEN Ru-chu1, XU Juan2, LI Qing-qing2,XU Hai-shun2, DANG Ya-li2
(1.Zhejiang Wuyangtang Pharmaceutical CO., LTD. Edible fungus Research and Development Centre in Lishui City, Lishui Zhejiang 323000; 2.Zhejiang Academy of Medical Science, Hangzhou Zhejiang 310013)
To study the immune function of sporoderm-brokenGanodermaspores cultivated by logs, three concentrations of sporoderm-brokenGanodermaspores cultivated by logs and a control group were studied by a serial experiments including ConA-induced lymphocyte transformation test, sheep red blood cells induced delayed type hypersensitivity (DTH) test, serum hemolysin and antibody producing cells determination, phagocytosis test of chicken red blood cells by peritoneal macrophages, carbon clearance and NK cells activities assay, and organ weight measurement in mice. The results showed that all dose groups were able to significantly improve the proliferation of splenic lymphocytes, that the high dose group could significantly improve left-hind feet thickness of mice, and that the medium and high dose groups could significantly improve the numbers of plague forming cells in mice compared with the control group. In conclusion, the sporoderm-brokenGanodermaspores cultivated by logs could improve the immune function in mice.
Sporoderm-brokenGanodermaspores cultivated by logs; Immune function; Mice
*项目来源:科技部创新基金项目“高生物活性灵芝多糖与三萜提取物”(11C26213304715);国家948项目“食药用菌活性多糖生物酶法与检测技术引进”(2008-4-64);浙江省科技专项“生物活性物质与中药保健食品创新人才培养”(2011F20014);丽水市科技项目“高品质有机灵芝孢子粉防氧化超微破壁新技术产业化”(20100401)、“对酒精性肝损化有保护作用的中药保健食品研发”(2011NZH0218)。
吴学谦(1964-),男,研究员,主要从事食药用真菌活性物质与保健食品研究。E-mail: wxq655@163.com
2013-11-20
S646.9
A
1003-8310(2014)01-0051-04

