Gli-1在缺氧诱导乳腺癌MDA-MB-231细胞上皮-间质转分化中的重要作用
李徐奇,雷建军,徐勤鸿,段万星,盛 薇,王 康,魏光兵
(西安交通大学医学院第一附属医院:1.普通外科;2.肝胆外科,陕西西安 710061)
◇基础研究◇
Gli-1在缺氧诱导乳腺癌MDA-MB-231细胞上皮-间质转分化中的重要作用
李徐奇1,雷建军2,徐勤鸿2,段万星2,盛 薇1,王 康1,魏光兵1
(西安交通大学医学院第一附属医院:1.普通外科;2.肝胆外科,陕西西安 710061)
目的 探讨Gli-1在缺氧诱导乳腺癌MDA-MB-231细胞上皮-间质转分化(EMT)及侵袭中的重要作用。方法 通过缺氧培养乳腺癌MDA-MB-231细胞,以常氧培养作为对照。Transwell小室侵袭试验检测各组MDA-MB-231细胞的侵袭能力;Western blot检测HIF-1α、Gli-1、E-Cadherin和vimentin蛋白的表达水平。通过shRNA稳定转染乳腺癌细胞,再次通过Transwell小室侵袭试验检测缺氧对乳腺癌细胞侵袭能力的影响,Western blot检测HIF-1α、Gli-1、E-Cadherin和vimentin蛋白的表达水平。结果 缺氧可明显诱导乳腺癌MDA-MB-231细胞侵袭,并上调HIF-1α、Gli-1和vimentin蛋白,下调E-cadherin蛋白。靶向沉默Gli-1基因后,缺氧失去了对乳腺癌细胞侵袭和EMT的诱导作用。结论 缺氧通过上调Gli-1表达活化Hedgehog通路,诱导乳腺癌细胞侵袭及EMT过程。
乳腺癌;侵袭;上皮-间质转分化;缺氧;Gli-1;Hedgehog通路
肿瘤细胞上皮-间质转分化(epithelial-mesenchymal transition, EMT)是肿瘤细胞侵袭转移的一个关键过程[1],是肿瘤细胞以上皮表型向狭长状成纤维样表型转化,以获得间质表型的复杂过程。EMT是启动恶性肿瘤侵袭转移的重要途径之一,最终导致细胞活性和侵袭性增强。在EMT特征获得过程中细胞丧失上皮细胞-细胞间连接,细胞-细胞接触的蛋白如E-Cadgerin等的下调,和获得间质标志如vimentin等蛋白的表达上调。大量研究表明,在包括结肠癌、乳腺癌、前列腺癌及肝癌等多种肿瘤侵袭转移过程中均可观察到EMT的发生,而且发生EMT的癌细胞数量直接与肿瘤侵袭转移程度相关[2-4]。
缺氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)作为一种氧应答调控因子,在肿瘤侵袭转移过程中起着关键的作用[5]。研究显示,EMT相关转录因子在低氧微环境中存在过表达,这些转录因子的上调可能是由HIF-1α所介导的[6]。然而到目前为止,缺氧诱导肿瘤发生EMT从而促进侵袭的具体分子机制仍不清楚。本研究旨在通过靶向沉默乳腺癌细胞的Gli-1基因,探讨Gli-1在缺氧诱导乳腺癌MDA-MB-231细胞EMT过程中的重要作用。
1 材料与方法
1.1 材料与分组 人乳腺癌细胞株MDA-MB-231细胞购自中国科学院上海生命研究所。DMEM细胞培养基、胰蛋白酶购自Hyclone公司;胎牛血清购自杭州四季青公司;兔抗人HIF-1α、Gli-1、E-Cadherin和vimentin多克隆抗体均购自Bioworld公司;鼠抗人β-actin单克隆抗体,HRP标记山羊抗鼠IgG、山羊抗兔IgG二抗均购自北京中衫金桥公司;聚偏二氟乙烯膜(PVDF膜),Transwell小室均购自Millipore公司;Gli-1 shRNA和对照shRNA Control质粒购自上海吉玛公司,Gli-1 shRNA的有效序列为5′-GGCUCAGCUUGUGUGUAAUTT-3′;转染试剂Lipofectamine 2000购自Invitrogen公司;PCR引物合成于北京鼎国生物公司;Real-time PCR试剂盒购自大连TaKaRa公司。实验分组:常氧对照组(Normoxia),缺氧组(Hypoxia),常氧+对照shRNA干扰组(Normoxia+sh-vector),常氧+Gli-1 shRNA干扰组(Normoxia+sh-Gli-1),缺氧+对照shRNA干扰组(Hypoxia+sh-vector),缺氧+Gli-1 shRNA干扰组(Hypoxia+sh-Gli-1)。
1.2 细胞培养与转染 人乳腺癌细胞株MDA-MB-231于含100 mL/L胎牛血清的DMEM培养液中,37 ℃、50 mL/L CO2培养,2~3 d用2.5 g/L胰酶消化传代。取对数生长期的细胞进行实验。参照Lipofectamine 2000转染试剂盒说明书进行转染。瞬时转染48 h后消化细胞,按1∶6接种于6孔板后加600 μg/mL G418进行稳定转染筛选,每2~3 d换液1次。14 d后,出现多个G418抗性的克隆,由于质粒带有绿色荧光蛋白GFP的表达,在荧光显微镜下可看到带绿色荧光的阳性克隆。显微镜下挑取带绿色荧光的单个克隆移入24孔培养板,继续G418维持培养,经过4周可以获得稳定转染的细胞克隆。
1.3 Transwell小室侵袭实验 按实验目的,将细胞在常氧条件(200 mL/L O2)或缺氧条件(10 mL/L O2)下培养24 h。以预冷的DMEM与Matrigel胶1∶1稀释后,取100 μL稀释胶加到Transwell上层小室中,于37 ℃孵育6 h。收集各组细胞,按5×104个/mL的细胞密度100 μL接种于Transwell上层小室。含100 mL/L胎牛血清的DMEM培养基500 μL加入Transwell下层小室,置于37 ℃、50 mL/L CO2的培养箱中培养24 h。用棉签沾PBS轻轻地擦去小室上层聚碳酸酯膜上贴壁生长但未能穿过膜的细胞。将膜取出固定10 min,1 g/L的结晶紫染色30 min后小心洗去。200倍放大倍数下随机观察并计10个视野内穿过聚碳酸酯膜的细胞数,照相记录。重复3次。
1.4 蛋白印记法(Western blot)检测蛋白表达 选择生长良好的细胞1×107个,蛋白裂解液裂解细胞,提取细胞总蛋白,BCA法测定蛋白浓度。SDS-PAGE凝胶电泳,半干转膜法转至PVDF膜;50 g/L脱脂牛奶室温封闭1 h;加一抗稀释液4 ℃孵育过夜;TBST缓冲液洗膜后加入二抗稀释液室温孵育1 h;ECL化学发光,暗室显影。
1.5 PCR检测mRNA的转录 用Trizol-氯仿-异丙醇法提取各组细胞总RNA。取5 μg按反转录试剂盒说明反转录为cDNA。以cDNA为模板PCR扩增HIF-1α、Gli-1、E-Cadherin和vimentin,以GAPDH为内参照。各基因引物序列如下:HIF-1α:5′-AAGTCTAGGGATGCAGCA-3′,5′-CAAGATCACCAGCATCATG-3′;Gli-1:5′-GGGATGATCCCACATCCTCAGTC-3′,5′-CTGGAGCAGCCCCCCCAGT-3′;E-Cadherin:5′-ATTCTGATTCTGCTGCTCTTG-3′,5′-AGTCCTGGTCCTCTTCTCC-3′;vimentin:5′-AATGACCGCTTCGCCAAC-3′,5′-CCGCATCTCCTCCTCGTAG-3′;GAPDH:5′-GTAAAGACCTCTATGCCATCA-3′,5′-GGACTCATC-GTACTCCTGCT3-3′。PCR反应条件:预变性94 ℃ 5 s,94 ℃ 30 s → 60 ℃ 30 s → 72 ℃ 30 s共40个循环;溶解曲线条件:95 ℃ 15 s → 60 ℃ 30 s → 95 ℃ 15 s。基因相对表达水平通过ΔΔC(T)法计算。
2 结 果
2.1 缺氧显著促进乳腺癌MDA-MB-231细胞的侵袭能力 Tanswell实验结果显示,常氧对照组与缺氧组MDA-MB-231细胞穿过Transwell小室的细胞数分别为(45.88±4.99)个和(108.88±5.67)个,差异有统计学意义(t=8.16,P<0.01,图1)。结果提示,缺氧能显著促进乳腺癌MDA-MB-231细胞侵袭能力。
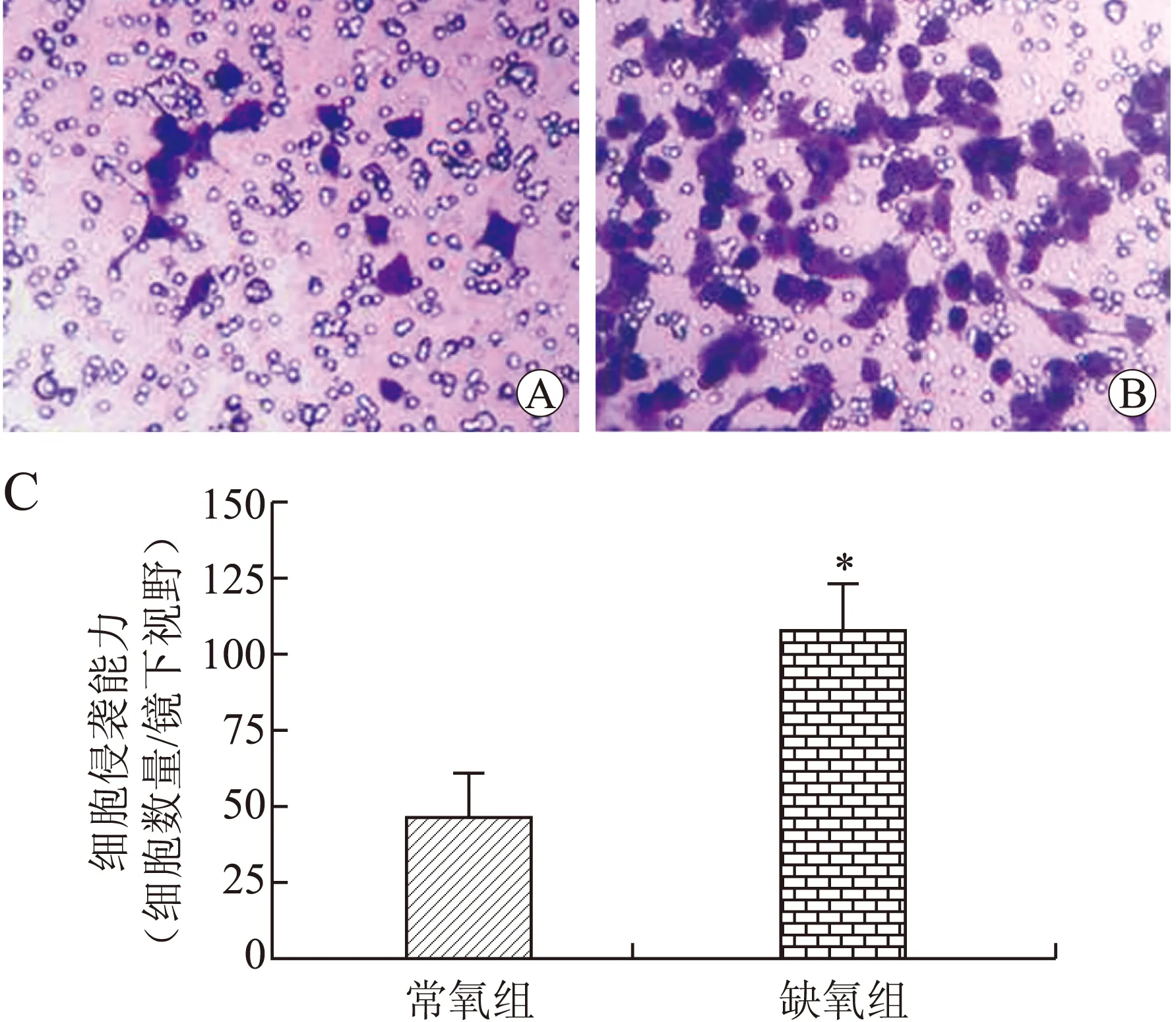
图1 缺氧显著促进乳腺癌MDA-MB-231细胞的侵袭
Fig.1 Hypoxia significantly promoted the invasion of breast carcinoma cell line MDA-MB-231A:常氧组;B:缺氧组,缺氧显著促进乳腺癌MDA-MB-231细胞的侵袭;C:Transwell小室穿膜细胞计数。与常氧组比较,*P<0.05。
2.2 缺氧促进乳腺癌细胞侵袭与活化Gli-1并诱导细胞EMT有关 在常氧条件和缺氧条件下培养MDA-MB-231细胞24 h,Western blot检测其蛋白表达。结果显示,缺氧组MDA-MB-231细胞的HIF-1α蛋白水平(0.946±0.070)比常氧对照组(0.098±0.021)显著上调(P<0.01,图2A)。而Real-time PCR检测未能发现缺氧组MDA-MB-231细胞的HIF-1α mRNA量与常氧对照组之间有明显差异(P>0.05,图2B)。
缺氧组的MDA-MB-231细胞Gli-1蛋白水平(0.685±0.053)较常氧对照组(0.263±0.014)明显上调(P<0.05)、缺氧组vimentin蛋白水平(0.402±0.031)较常氧组(0.106±0.010)明显上调(P<0.05);然而,缺氧组E-Cadherin蛋白水平(0.435±0.042)较常氧组(0.982±0.062)显著下调(P<0.05)。说明缺氧促进乳腺癌细胞Gli-1表达并诱导细胞EMT。
2.3 特异性RNA干扰载体Gli-1 shRNA对MDA-MB-231细胞Gli-1蛋白和mRNA表达的抑制作用

图2 缺氧对乳腺癌MDA-MB-231细胞HIF-1α、Gli-1、E-Cadherin和vimentin表达的影响
Fig.2 The effects of hypoxia on HIF-1α, Gli-1, E-Cadherin and vimentin expressions in MDA-MB-231 cell
A:缺氧培养的MDA-MB-231细胞的HIF-1α、Gli-1和vimentin蛋白比常氧培养时显著上调,E-Cadherin显著下调;B:缺氧培养的MDA-MB-231细胞的HIF-1α mRNA无明显变化,Gli-1和vimentin mRNA比常氧培养时显著上调,E-Cadherin mRNA显著下调。与常氧组比较,*P<0.05。
Western blot结果显示,常氧组、常氧+对照shRNA干扰组、常氧+Gli-1 shRNA干扰组的Gli-1蛋白相对表达量分别为(0.529±0.070)、(0.506±0.074)和(0.095±0.010),组间差异具有统计学意义(P<0.05)。稳定转染后Gli-1靶向沉默的细胞Gli-1蛋白表达受到了显著的抑制,抑制率达81%(图3A)。Real-time RT-PCR结果显示,常氧组、常氧+对照shRNA干扰组、常氧+Gli-1 shRNA干扰组的Gli-1 mRNA相对表达量分别为(1.049±0.149)、(0.992±0.226)和(0.168±0.056),组间差异具有统计学意义(P<0.05)。稳定转染后Gli-1靶向沉默的细胞Gli-1表达受到了显著的抑制,抑制率为85%(图3B)。
2.4 Gli-1沉默逆转了缺氧对乳腺癌细胞侵袭的促进作用 Transwell实验显示,常氧+对照shRNA干扰组与缺氧+对照shRNA干扰组穿膜细胞数分别为35.125±13.611和106.500±19.310,差异具有统计学意义(P<0.05),表明缺氧对乳腺癌MDA-MB-231细胞有明显的促进侵袭作用;与此同时,常氧+Gli-1 shRNA干扰组与缺氧+Gli-1 shRNA干扰组穿膜细胞数分别为24.875±11.256和35.250±15.691,差异没有统计学意义(P>0.05)。表明当乳腺癌细胞Gli-1被阻断后,缺氧失去了对乳腺癌细胞的侵袭诱导作用(图4)。本结果提示,Gli-1在缺氧促进乳腺癌细胞侵袭过程中扮演重要作用。
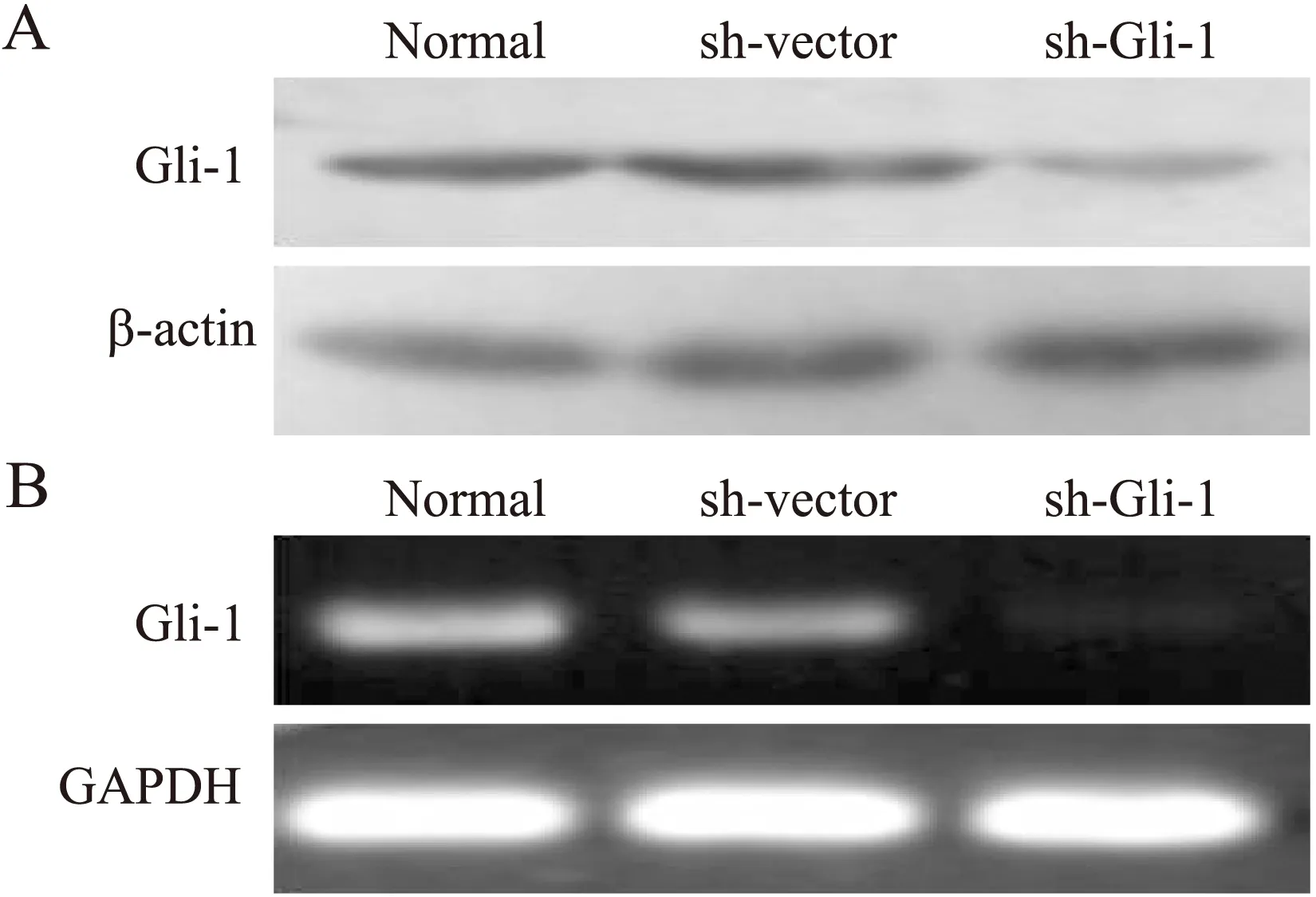
图3 Gli-1靶向沉默对MDA-MB-231细胞Gli-1表达的抑制作用
Fig.3 The inhibitory effect on shRNA targeting for Gli-1 on the expression of Gli-1 in MDA-MB-231 cell
A:Gli-1靶向沉默对MDA-MB-231细胞Gli-1蛋白表达的抑制作用;B:Gli-1靶向沉默对MDA-MB-231细胞Gli-1 mRNA表达的抑制作用。

图4 缺氧促进乳腺癌细胞侵袭依赖于Gli-1
Fig.4 Hypoxia promoted the invasion of breast carcinoma cell by depending with Gli-1
A、C:常氧组;B、D:缺氧组,Transwell试验显示,缺氧条件可诱导MDA-MB-231-sh-vector细胞侵袭,但对Gli-1靶向沉默后的MDA-MB-231-sh-Gli-1细胞没有作用;E:Tranwell实验各组穿膜细胞数分析。与常氧组比较,*P<0.05。
2.5 缺氧通过上调Gli-1后诱导乳腺癌细胞EMT 提取细胞总蛋白,经Western blot检测发现(图5),缺氧+对照shRNA干扰组与常氧+对照shRNA干扰组HIF-1α相对表达量分别为(0.286±0.043)、(0.981±0.065)、Gli-1的相对表达量分别为(0.247±0.023)、(0.633±0.040)、vimentin蛋白相对表达量分别为(0.206±0.021)、(0.616±0.038),差异具有统计学意义(P<0.05),缺氧+对照shRNA干扰组与常氧+对照shRNA干扰组E-Cadherin蛋白水平分别是(0.967±0.071)、(0.293±0.036),差异具有统计学意义(P<0.05);而缺氧+Gli-1 shRNA干扰组与常氧+Gli-1 shRNA干扰组比较,HIF-1α蛋白水平分别是(0.953±0.066)、(0.264±0.035),尽管缺氧导致HIF-1α蛋白明显上调(P<0.05),但Gli-1蛋白的相对表达量分别为(0.106±0.013)、(0.098±0.018),vimentin蛋白相对表达量分别为(0.114±0.020)、(0.109±0.019),E-Cadherin蛋白相对表达量分别为(0.896±0.036)、(0.913±0.040),差异无统计学意义(P>0.05)。本结果说明,Gli-1的激活是缺氧通过HIF-1α上调诱导乳腺癌细胞EMT的关键环节。

图5 Gli-1的激活是缺氧通过HIF-1α上调诱导乳腺癌细胞EMT的关键环节
Fig.5 Activation of Gli-1 was the key to hypoxia’s inducing breast carcinoma cell EMT
3 讨 论
乳腺癌是最常见的恶性肿瘤之一[7],在我国居女性恶性肿瘤死亡率之首。其侵袭和转移途径多样,是造成死亡率居高不下的重要原因[8]。大多数实体瘤具有缺氧的微环境,在肿瘤发生发展过程中一个关键的步骤是肿瘤细胞对缺氧的适应。缺氧微环境可通过调控多种基因表达,从而促进恶性肿瘤发生浸润转移,其中HIF在这一过程中发挥重要作用。
HIF-1由α和β亚基组成,其中HIF-1α是受氧分子调节的主要功能亚基。人体肿瘤组织中HIF-1α高水平表达,表达程度与肿瘤的进展程度、转移等正相关。HIF-1在常氧条件下不断通过泛素-蛋白酶体途径水解,在缺氧条件下则降解受阻而在胞质内聚集,随后转运入核,与缺氧反应元件结合,启动下游靶基因转录。最新研究表明,HIF-1α高表达能引起胰腺癌、卵巢癌、前列腺癌、胆囊癌、肝细胞癌等多种肿瘤细胞发生EMT特征的转变,提高其侵袭转移能力[9]。我们的研究发现,乳腺癌MDA-MB-231细胞在缺氧条件下其侵袭能力显著提高;同时发现,缺氧的乳腺癌细胞HIF-1α蛋白水平较正常对照显著上调,但mRNA水平未明显增高,说明缺氧是从转录后水平调节细胞HIF-1α表达。
KRISHNAMACHARY等[10]发现,HIF-1α是肿瘤细胞EMT的一个重要上游信号,缺氧诱导的HIF-1α高表达激活Snail通路上调,导致细胞发生E-Cadherin等上皮标志丢失和vimentin等间质标志获得的EMT改变。我们检测了MDA-MB-231细胞上皮细胞标志性蛋白分子E-Cadherin和间质细胞标志性蛋白分子vimentin表达水平。通过Western blot观察到,随着缺氧诱导乳腺癌细胞HIF-1α蛋白上调,随之发生丢失E-Cadherin并获得vimentin事件,即细胞失去上皮表型,开始向间质表型转化,导致侵袭能力增强。
Hedgehog信号通路是乳腺癌发展的重要机制之一。在乳腺癌患者的组织中,该通路成员SHH、SMO、PTCH、Gli均高表达[11],表明此通路的激活与乳腺癌的发生、发展相关。配体SHH可与受体PTCH结合,解除PTCH对SMO的抑制,活化的SMO激活其下游转录因子Gli-1,Gli-1进入细胞核内促进其下游基因转录,促进肿瘤细胞迁徙浸润[12]。因此,Gli-1不仅是Hedgehog信号通路的关键环节,其上调激活也是该通路活化的标志。研究发现[13],在体内外髓母细胞瘤、神经胶质瘤、乳腺癌、前列腺癌、基底细胞癌等均存在不经过活化SMO,而直接激活Gli-1促进肿瘤进展的现象。此外,有报道提示,Hedgehog信号通路的活化可能与肿瘤细胞侵袭过程中的EMT转变有关[14]。
为了阻断乳腺癌细胞Hedgehog信号通路的活化,我们选择了Gli-1基因沉默的方法。通过对稳定转染Gli-1 shRNA的MDA-MB-231细胞,利用Western blot和Real-time RT-PCR分别检测对Gli-1蛋白和mRNA的抑制效果。结果发现,抑制效率约70%~80%,与无效对照组和正常细胞Gli-1的表达具有明显的差异性,说明shRNA靶向沉默Gli-1基因的效果满意。随即Transwell小室实验发现,Gli-1干扰的细胞和空载体对照细胞在缺氧条件下其侵袭行为的变化有着明显的差异。空载体对照细胞的侵袭能力能被缺氧诱导,而Gli-1干扰的乳腺癌细胞在常氧和缺氧条件下,其侵袭能力没有明显的变化。提示Hedgehog通路的活化是缺氧诱导乳腺癌细胞侵袭中的一个关键环节。此外,我们又检测了EMT相关分子的表达变化。我们发现,在Gli-1干扰的乳腺癌细胞中,尽管缺氧诱导了HIF-1α蛋白上调,但因为Gli-1蛋白上调被抑制,E-cadherin和vimentin的表达水平并未发生相应变化。因此,可以认为缺氧是通过活化Hedgehog通路来诱导乳腺癌细胞发生EMT和增加其侵袭能力的。
综上所述,我们运用Gli-1沉默技术抑制乳腺癌MDA-MB-231细胞Gli-1表达,抑制Hedgehog通路活性,可以阻断缺氧诱导的肿瘤细胞EMT过程及侵袭能力上调,提示了Hedgehog通路在乳腺癌浸润转移机制中的重要作用。该通路的活化与乳腺癌的侵袭转移潜能密切相关,并为其作为乳腺癌治疗靶点的选择提供了新的理论和实验依据。
[1] ALDERTON GK. Metastasis: Epithelial to mesenchymal and back again[J]. Nat Rev Cancer, 2013, 13(1):3.
[2] OCANA OH, CORCOLES R, FABRA A, et al. Metastatic colonization requires the repression of the epithelial-mesenchymal transition inducer prrx1[J]. Cancer Cell, 2012, 22(6):709-724.
[3] LEI J, MA J, MA Q, et al. Hedgehog signaling regulates hypoxia induced epithelial to mesenchymal transition and invasion in pancreatic cancer cells via a ligand-independent manner[J]. Mol Cancer, 2013, 12:66-66.
[4] 李四光,刘凯歌,常远鸿. 肝星状细胞经趋化因子SDF-1/CXCR4轴途径促进肝癌细胞侵袭的作用及其机制[J]. 吉林大学学报:医学版, 2013, 39(4):730-736.
[5] 巴云鹏,张晓,宋瑞彪. 喉鳞状细胞癌组织中缺氧诱导因子-1和人表皮生长因子受体2的表达[J]. 郑州大学学报:医学版, 2013, 48(1):100-102.
[6] TSAI YP, WU KJ. Hypoxia-regulated target genes implicated in tumor metastasis[J]. J Biomed Sci, 2012, 19(1):102-112.
[7] SIEGEL R, NAISHADHAM D, JEMAL A. Cancer Statistics, 2013[J]. CA Cancer J Clin, 2013, 63(1):11-30.
[8] 周灿,王珂,何建军,等. 不同年龄段女性乳腺癌患者临床病理特征的回顾性分析[J]. 西安交通大学学报:医学版, 2013, 34(1):133-137.
[9] JIAO M, NAN KJ. Activation of PI3 kinase/Akt/HIF-1alpha pathway contributes to hypoxia-induced epithelial-mesenchymal transition and chemoresistance in hepatocellular carcinoma[J]. Int J Oncol, 2012, 40(2):461-468.
[10] KRISHNAMACHARY B, ZAGZAG D, NAGASAWA H, et al. Hypoxia-inducible factor-1-dependent repression of E-cadherin in von Hippel-Lindau tumor suppressor-null renal cell carcinoma mediated by TCF3, ZFHX1A, and ZFHX1B[J]. Cancer Res, 2006, 66(5):2725-2731.
[11] SIMS-MOURTADA J, YANG D, TWOROWSKA I, et al. Detection of canonical hedgehog signaling in breast cancer by 131-iodine-labeled derivatives of the sonic hedgehog protein[J]. J Biomed Biotechnol, 2012, 2012:639562-639570.
[12] LI X, MA Q, XU Q, et al. SDF-1/CXCR4 signaling induces pancreatic cancer cell invasion and epithelial-mesenchymal transition in vitro through non-canonical activation of Hedgehog pathway[J]. Cancer Lett, 2012, 322(2):169-176.
[13] LI X, MA Q, DUAN W, et al. Paracrine sonic hedgehog signaling derived from tumor epithelial cells: a key regulator in the pancreatic tumor microenvironment[J]. Crit Rev Eukaryot Gene Expr, 2012, 22(2):97-108.
[14] TANG SN, FU J, NALL D, et al. Inhibition of sonic hedgehog pathway and pluripotency maintaining factors regulate human pancreatic cancer stem cell characteristics[J]. Int J Cancer, 2012, 131(1):30-40.
(编辑 卓选鹏)
The important role of Gli-1 in hypoxia-induced epithelial-mesenchymaltransition of breast cancer cell line MDA-MB-231
LI Xu-qi1, LEI Jian-jun2, XU Qin-hong2, DUAN Wan-xing2,SHENG Wei1, WANG Kang1, WEI Guang-bing1
(1. Department of General Surgery; 2. Department of Hepatobiliary Surgery, the FirstAffiliated Hospital, Medical School of Xi’an Jiaotong University, Xi’an 710061, China)
Objective To investigate the important role of Gli-1 in hypoxia-induced epithelial-mesenchymal transition of breast cancer cell line MDA-MB-231. Methods For the present study, breast cancer cell line MDA-MB-231 was cultured under normoxic or hypoxic condition. Then, the shRNA of Gli-1 was stably transfected into MDA-MB-231 cells. Invasion of MDA-MB-231 was detected by the Transwell assay. The expressions of HIF-1α, Gli-1, E-Cadherin and vimentin proteins were determined by Western blot. Results Hypoxia significantly induced the invasion of MDA-MB-231 cells, upregulated the expressions of HIF-1α, Gli-1 and vimentin proteins, and downregulated the expression of E-Cadherin protein. Furthermore, knocking down Gli-1 obviously abrogated hypoxia-induced epithelial-mesenchymal transition and enhanced invasion of MDA-MB-231 cells. Conclusion Hypoxia induces epithelial-mesenchymal transition and enhances invasion of breast carcinoma cells via strengthening Gli-1 expression and activation of Hedgehog pathway.
breast carcinoma; invasion; epithelial-mesenchymal transition; hypoxia; Gli-1; hedgehog pathway
2014-01-24
2014-04-20
国家自然科学基金资助项目(No.81201824),中央高校基本科研业务费专项资金资助项目(No.2013jdhz33) Supported by the National Natural Science Foundation of China (No.81201824) and the Fundamental Research Funds for the Central Universities in Xi’an Jiaotong University (No.2013jdhz33)
魏光兵,主治医师. E-mail: weiguangbing1208@163.com
李徐奇(1981-),男(汉族),博士,助理研究员. 研究方向:消化系统及乳腺肿瘤的发病机制与治疗策略. E-mail: lixuqi@163.com
时间:2014-07-25 17∶58 网络出版地址:http://www.cnki.net/kcms/detail/61.1399.R.20140725.1758.001.html
R737.9
A
10.7652/jdyxb201406014

