CHD5基因与雌激素受体阴性乳腺癌相关因子的研究
王白石,李东阳,崔桂花,罗 速 (.天津医科大学中新生态城医院检验科,天津 00467;.天津市泰达医院检验科,天津 00457;.吉林医药学院药学院,吉林 吉林 0;4.北华大学基础医学院,吉林 吉林 0)
乳腺癌是妇女常见的恶性肿瘤,20世纪以来,乳腺癌的发病率在全世界各国均呈上升趋势,尤其以雌激素受体阴性乳腺危害程度最大,恶性程度最高。在许多大城市中它已成为女性首位或第二位常见的恶性肿瘤[1]。
癌基因的发现广泛依赖于分析肿瘤的获得或缺失,来揭示肿瘤抑制基因的位置,所以癌症很可能包含一种或更多的肿瘤抑制基因[2]。2007年,美国冷泉港实验室发现了CHD5,证实位于人1P36的染色质区解旋酶DNA结合区5(CHD5)能够通过p19Arf/p53途径调控细胞增殖、凋亡、衰老。在人类中,研究发现许多种癌症CHD5基因缺失,说明CHD5与人类癌症有莫大关系[2],如神经母细胞瘤、大肠癌等[3]。但其抑癌的具体机制并未阐明。冷泉港实验室的研究表明,CHD5就像一个细胞内调控肿瘤抑制系统的开关,当它失效时,细胞内预防癌症的“设施”会关闭,肿瘤就可能发生。提示CHD5与多种人类癌症有关[3-5]。
核糖核酸干扰技术(RNAi)是遗传工程领域近几年取得的重大技术进展之一,RNAi是由dsRNA介导的由特定酶参与的特异性基因沉默现象,它在转录水平、转录后水平和翻译水平上阻断基因的表达。RNAi是一种高效、特异性强的基因阻断技术,被誉为将在功能基因组学及遗传工程领域掀起一场真正的革命[6]。
在本研究中,根据GenBank中CHD5序列设计siRNA序列,合成双链DNA,构建重组表达质粒。大肠杆菌转化、筛选并测序。得到设计的shRNA重组质粒用于基因沉默。购买正常乳腺上皮细胞HBL-100进行细胞培养,同时培养雌激素受体阴性乳腺癌细胞MDA-MB-231细胞作为对照组,RT-PCR同时检测两种细胞中CHD5表达并进行比对。将筛选好的重组质粒用脂质体转染的方法导入HBL-100细胞中进行培养,G418筛选,获得稳定表达细胞株,RT-PCR检测转染后细胞CHD5表达量,观察抑制效果。同时检测转染后的HBL-100细胞中雌激素受体阴性乳腺癌相关因子HER-2表达量,以初步探讨CHD5基因与雌激素受体阴性乳腺癌发生发展的相互关系及分子机制。
1 材料与方法
1.1 实验材料
MDA-MB-231细胞、人乳腺正常细胞HBL-100(武汉细胞保藏中心)。
低温冷冻高速离心机(美国Sigma公司),恒温水浴箱(常州国华公司),紫外透射仪ZF-90A(上海华岩公司),-80℃冰箱(日本三洋公司),CO2恒温培养箱(日本平泽制作所),电泳仪、电泳槽(北京六一仪器厂),PCR仪(美国ABI公司),荧光显微镜(日本olympus),流式细胞仪FACScan(美国BD公司)。
pRNAT-U6.1/Neo质粒(美国Creighton University赠与),TaKaRa Agarose Gel DNA Purification Kit Ver.2.0(大连宝生物工程公司),质粒DNA小量纯化试剂盒(大连宝生物工程公司),PrimeScriptMTRT-PCR Kit(大连宝生物工程公司),T4 DNA连接酶(大连宝生物工程公司),核酸内切酶HindⅢ、BamHⅠ;Taq DNA聚合酶(大连宝生物工程公司),λ-Hind ⅢDNA Marker(上海生物工程公司),RPMI-1640(大连宝生物工程公司)。
1.2 RT-PCR法检测CHD5含量
购买人乳腺正常上皮细胞HBL-100及雌激素受体阴性乳腺癌MDA-MB-231细胞进行细胞培养,提取细胞总RNA,半定量RT-PCR法检测CHD5含量,设计引物序列如下:
CHD5:上游引物5′-GAGCAGGCGTTGGTCATTG-3′
下游引物5′-GGCGAGGCACTCCACTTCA-3′
目的片段长度:120 bp
内参:上游引物5′-TGACGGGGTCACCCACACTGT GCCCATCTA-3′
下游引物5′-CTAGAAGCATTTGCGGTGGACG ATGGAGGG-3′
目的片段长度:661 bp
1.3 pRNAT-U6.1/Neo-CHD5 siRNA重组质粒构建
根据人CHD5序列(genebank登录号:NM_015557)和载体设计的具体要求,针对目的基因CHD5的序列5′-CACGGTGATGTATCGCAACTA-3′设计DNA双链,命名为CHD5-siRNA1;同法构建阴性质粒序列为5′-CATGGAACTATGAGGCCCTGA-3′的DNA双链,命名为CHD5-siRNA2。
根据质粒图谱设计小干扰序列如下:

序列交由上海生工公司合成,两条互补寡核苷酸链退火,形成互补双链结构。利用大肠杆菌扩增pRNAT-U6.1/Neo质粒并提取,BamHⅠ,HindⅢ37 ℃ 3 h双酶切使质粒线性化,使用TaKaRa Agarose Gel DNA Purification Kit Ver2试剂盒,严格按照试剂盒说明书凝胶回收高纯度线性质粒备用。将线性质粒与siRNA模板链16 ℃水浴过夜连接,构建重组质粒。
1.4 连接产物转化感受态细胞与筛选
制备感受态大肠杆菌细胞,将重组质粒转化入细胞中,将转化后的菌液均匀涂布于含有AMP抗生素的预制90 mm LB琼脂板,37 ℃培养过夜。
挑取15个菌落分别接种到2 mL含有AMP抗生素的LB培养基中,于37 ℃振摇培养过夜增菌,提取质粒,BamHⅠ,HindⅢ37 ℃ 3 h双酶切,1.0%琼脂糖凝胶电泳,根据以70 bp小干扰引物作对照鉴定正确克隆。
1.5 测序鉴定
将纯化的重组质粒菌液交由上海生物工程公司完成测序。
1.6 重组质粒对HBL-100细胞CHD5基因的抑制效应
1.6.1 转 染
细胞培养,HBL-100,MDA-MB-231贴壁生长于10%RPMI-1640培养基中,含青、链霉素最终浓度为100 U/mL,37 ℃ 5%的CO2培养箱中培养。使细胞在转染前处于对数生长期,并离心收集细胞,使用lipofeetamineTM2000质脂体法试剂盒,严格按照说明书操作转染重组质粒DNA入HBL-100细胞中,流式细胞仪检测转染效率,MCYCLE软件分析结果。
1.6.2 G418筛选稳定转染细胞株
瞬时转染后24 h,细胞1∶10倍数稀释传代到新鲜培养液中。24 h后换成含有G418 (500 mg/L)的培养液进行筛选。G418的浓度由参考文献查得[7]。2周后克隆长成。
1.6.3 siRNA重组质粒对HBL-100细胞抑制效应的检测
同时培养转染后的HBL-100细胞和正常乳腺细胞(未转染的HBL-100)提取细胞总RNA,RT-PCR法检测CHD5mRNA含量并进行对比。
1.6.4 雌激素受体阴性乳腺癌相关因子HER-2检测
同时培养未转染的HBL-100细胞、转染后的HBL-100细胞和MDA-MB-231细胞,提取细胞总RNA,RT-PCR法检测HER-2含量并进行对比。
HER-2引物由Primer Premier 5设计,上海生工合成。
上游引物:5′-GAATTCGGCACAGTCTACAAGGGCATC-3′
下游引物:5′-GCTAGCAGGCGTCCGCGGTTT-3′
2 结 果
2.1 CHD5在正常细胞HBL-100与癌细胞MDA-MB-231中含量检测
2.1.1 总RNA提取
提取CHD5及MDA-MA-231细胞的总RNA,总RNA纯度及浓度鉴定,紫外分光光度计测A260/A280=1.936,浓度为243 mg/L,总RNA的纯度和浓度均符合实验要求,待用于后续实验。结果见图1。
2.1.2 RT-PCR检测结果
1.0%琼脂糖凝胶电泳,扩增片段120 bp与预期结果相符,以便进行后续实验。结果见图2。

图 1 图1 HBL-100,MDA-MB-231细胞总RNA提取
2.2 pRNAT-U6.1/Neo-CHD5 siRNA重组质粒的构建
2.2.1 siRNA模板链DNA合成
将上海生工合成的引物序列退火,1%琼脂糖凝胶电泳检测双链形成效率,结果见图3。
2.2.2 pRNAT-U6.1/Neo载体线性化及回收
质粒pRNAT-U6.1/Neo经BamHⅠ和Hind Ⅲ双酶切,1.0%琼脂糖凝胶电泳,酶切完全,条带清晰。结果见图4。凝胶回收结果见图5。

图3 siRNA模板DNA合成
2.2.3 重组质粒提取和鉴定
重组质粒组菌液15组,提取质粒后BamHⅠ和HindⅢ双酶切并电泳检测阳性与阴性重组质粒。其中1号和8号样本未切出条带,证明质粒与小干扰片段(70 bp)未连接成功,因为空质粒经BamHⅠ和HindⅢ双酶切后,可以切出18 bp的小条带,条带过小电泳无法显示;2到6号样本重组质粒成功切出小片段清晰条带,证明重组质粒构建成功,保存备用测序。8份样本电泳结果见图6。

图5 图5 凝胶回收
2.2.4 重组质粒的DNA测序
挑选一个构建成功的阳性克隆进行DNA测序分析,合成的siRNA序列正确,并克隆于pRNAT-U6.1/Neo的BamHⅠ和HindⅢ两个酶切位点之间,该序列位于U6启动子的下游,结果见图7,方框标出位置为目标序列。

图 7 重组质粒测序图,方框处为目标序列
2.3 小干扰重组质粒抑制HBL-100细胞CHD5基因表达
2.3.1 重组质粒转染
转染后48 h流式细胞仪检测瞬时转染效率。瞬时转染48 h后,流式细胞仪检测结果显示,瞬时转染效率为38.6%。结果见图8。
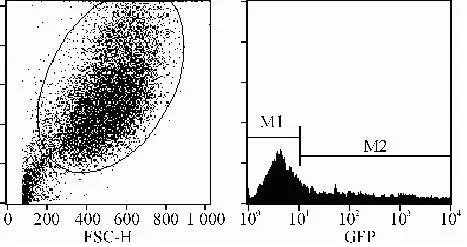
图 8 流式细胞仪检测瞬时转染效率
2.3.2 siRNA重组质粒对HBL-100细胞CHD5基因表达抑制效应的检测
转染小干扰重组质粒后筛选阳性重组细胞,获得稳定表达细胞株,细胞培养并分别提取细胞HBL-100,MDA-MB-231,转染阳性重组质粒的HBL-100细胞和转染阴性重组质粒的HBL-100细胞总RNA,总RNA纯度及浓度鉴定,紫外分光光度计测A260/A280=1.89,浓度为227 mg/L。总RNA条带清晰,纯度和浓度均符合实验要求,待用于后续实验。1.0%琼脂糖凝胶电泳80 V 30 min,结果见图9。
半定量RT-PCR同时检测上述4种细胞的CHD5 mRNA表达水平。结果显示正常细胞HBL-100中CHD5高表达,雌激素受体阴性乳腺癌细胞MDA-MB-231中低表达,与两者相比较,转染阳性重组小干扰质粒的HBL-100细胞CHD5表达水平明显受到抑制,阴性对照组表达与正常细胞相当。证明针对CHD5序列设计的小干扰抑制效果显著。结果见图10。
图 9 转染后总RNA提取
2.4 雌激素受体阴性乳腺癌相关因子HER-2检测
利用阳性重组细胞总RNA进行RT-PCR,扩增出的DNA片段大小与预计(269 bp)的相符,并做对比。其中正常细胞组HER-2含量低,阳性重组质粒转染组含量明显升高,雌激素受体阴性乳腺癌细胞组含量高,结果见图11。

图 10 转染后RT-PCR
3 讨 论
3.1 RT-PCR检测CHD5基因在正常人乳腺细胞与人雌激素受体阴性乳腺癌中的表达差异
本实验所研究的对象CHD5基因,是一种位于人染色体1p36上的一种抑癌基因,在人正常细胞中高表达,在很多癌症中缺失或低表达,本实验培养了人正常乳腺细胞HBL-100和人雌激素受体阴性乳腺癌细胞MDA-MB-231,RT-PCR检测2种细胞中CHD5 mRNA表达水平,结果显示有明显差异,在雌激素受体阴性乳腺癌MDA-MB-231细胞中表达很低。提示CHD5的缺失可能与乳腺癌的发生发展有关,其分子机制有待进一步研究。
3.2 针对CHD5基因的小干扰载体构建
为了研究CHD5基因与乳腺癌发生发展的关系,本实验采取了最新的siRNA技术,在正常人乳腺细胞HBL-100中沉默CHD5基因表达。RNAi技术有很多关键点,包括序列设计、靶点选择等。
RNAi是双链RNA介导的、序列特异的同源靶基因转录后的沉默效应。自1998年Fire等在研究线虫时发现此现象,至今已经相继在果蝇、锥虫、小鼠及哺乳动物细胞(包括人类细胞)中发现RNAi[8-10]。siRNA表达质粒在体内的转录,主要是由HⅠ polymeraseⅢ和U6两种启动子来调控[11],RNAi作用机制重组质粒导入细胞以后,在U6启动子的调控下,不断地转录产生RNA,RNA在胞内退火形成shRNA,shRNA进一步被核酸酶水解为RNAi的效应分子siRNA,再与靶基因的mRMA相结合,进一步水解靶基因的mRMA,从而抑制靶基因表达[12-13]。
本实验中RNAi干扰靶点的选择经过精心设计和探讨。靶位点的选择是实验成功的关键,实验是否能够有效进行,能否成功抑制住CHD5基因,RNAi的位点选择十分重要。并不是每个位点都有显著的抑制效果,需经过实验筛选和验证。有的学者认为RNA的二级结构的存在,影响了siRNA与mRNA的结合,导致RISC不能切割目标mRNA[14-15]。
将小干扰片段成功导入细胞中,载体的应用和选择十分重要,本实验选择质粒pRNAT-U6.1/Neo作为载体。它含有多种酶切位点并且含有人U6启动子,属RNA多聚酶Ⅲ启动子。
3.3 转染入乳腺细胞HBL-100观察抑制效果
在本实验中,利用上述质粒构建了CHD5-siRNA真核表达载体,转染导入人正常乳腺细胞HBL-100中,成功抑制了CHD5 mRNA的表达,这表明选择的靶位点是有效的,通过RNA干扰技术可以有效的抑制CHD5基因在人乳腺正常细胞HBL-100中的表达。转染小干扰重组质粒的细胞经过筛选,获得稳定表达的重组HBL-100细胞株,传代冻存,为进一步研究CHD5基因在雌激素受体阴性乳腺癌发生发展中的分子机制提供实验基础。
3.4 CHD5与雌激素受体阴性乳腺癌相关因子HER-2相互关系的研究
HER-2是雌激素受体阴性乳腺癌细胞典型的癌相关因子,已有大量文献证明其在雌激素受体阴性乳腺癌细胞中高表达。本实验中,经检测,HER-2在人雌激素受体阴性乳腺癌细胞MDA-MB-231中高表达。小干扰抑制HBL-100细胞中CHD5基因的表达,结果表明:CHD5失活或受抑制,可以导致HER-2的表达升高,两者呈负相关性。提示CHD5基因在雌激素受体阴性乳腺癌发生发展的分子通路中可能扮演抑制因子的重要角色。
综上所述,在人正常乳腺细胞株HBL-100中CHD5 mRNA正常高表达,在雌激素受体阴性乳腺癌细胞MDA-MB-231中低表达,CHD5可能是抑制雌激素受体阴性乳腺癌发生发展的重要调控因子。初步探讨了CHD5的作用机制,当CHD5失活或低表达时,能引起乳腺癌相关因子HER2的高表达,提示正常乳腺细胞的分子调控系统可能出现紊乱,相关分子通路调节基因被激活,使其相关基因表达产物增强。CHD5可能是乳腺癌发生中潜在的重要抑癌基因,随着今后对该基因作用机制的进一步研究,其在乳腺癌发生和发展中作用的进一步阐明,CHD5的抑癌分子机制有望丰富我们对乳腺癌的认识,提供一条新的研究途径。
[1] 徐兵河.乳腺癌的分子靶向治疗进展[J].中国医科大学学报,2013,42(12):1057-1064.
[2] Bagchi A,Papazoglu C,Wu Ying,et al.CHD5 is a Tumor Suppressor at Human 1P36[J].Cell,2007,128(3):459-475.
[3] Fatemi M,Paul T A,Brodeur G M.Epigenetic silencing of CHD5,a novel tumor-suppressor gene,occurs in early colorectal cancer stages[J].Cancer,2014,120(2):172-180.
[4] Wu Xiao,Zhu Zhengmao,Li Weidong,et al.Chromodomain helicase DNA binding protein 5 plays a tumor suppressor role in human breast cancer[J].Breast Cancer Res,2012,14(3):R73.
[5] Li Hui,Xu Weijue,Huang Yimin,et al.Genistein demethylates the promoter of CHD5 and inhibits neuroblastoma growth in vivo[J].Int J Mol Med,2012,30(5):1081-1086.
[6] Mollaie H R,Monavari S H,Arabzadeh S A.RNAi and miRNA in viral infections and cancers[J].Asian Pac J Cancer Prev,2013,14(12):7045-7056.
[7] Litvinov S V,Balzar M,Winter M J,et al.Epithelial cell adhesion molecule (Ep-CAM) modulates cell-cell interactions mediated by classic cadherins[J].J Cell Biol,1997,139(5):1337-1348.
[8] Wianny F,Zernicka-Goetz M.Specific interference with gene function by double stranded RNA in early mouse development[J].Nature Cell Biology,2000,2(2):70-75.
[9] Elbashir S M,Harborth J,Lendeckel W,et al.Duplexes of 21-nucleotide RNAs mediateRNA interference in cultured mammalian cells[J].Nature,2001,411(6836):494-498.
[10] Kamath R S,Martinez-Campos M,Zipperlen P,et al.Effectiveness of specific RNA-mediated interference through ingested double-stranded RNA in Caenorhabditis elegans[J].Genome Biol,2000,2(1):1-10.
[11] Hannon G J.RNA interference[J].Nature,2002,418(6894):244-251.
[12] Zamore P D,Tuschl T,Sharp P A,et al.RNAi:double-stranded RNA directs the ATP-dependent cleavage of mRNA at 21 to 23 nucleotide intervals[J].Cell,2000,101(1):25-33.
[13] Hammond S M,Bernstein E,Beach D,et al.An RNA-directed nuclease mediates post-transcriptional gene silencing in Drosophila cells[J].Nature,2000,404(6775):293-296.
[14] Chen Ying,Du Dan,Wu Jun,et al.Inhibition of hepatitis B virus replication by stably expressed shRNA[J].Biochem Biophys Res Commun,2003,311(2):398-404.
[15] Tuschl T,RNA interference and small interfering RNAS[J].Chem Bio Chem,2001,2(4):239-245.

