酒鬼酒制曲车间产淀粉酶细菌筛选和系统发育*
钟小娟,刘 荷,程金莲,刘祝祥,陈义光
(1.吉首大学生物资源与环境科学学院,湖南 吉首 416000;2.酒鬼酒股份有限公司,湖南 吉首 416000)
酒鬼酒制曲车间产淀粉酶细菌筛选和系统发育*
钟小娟1,刘 荷1,程金莲1,刘祝祥1,陈义光1
(1.吉首大学生物资源与环境科学学院,湖南 吉首 416000;2.酒鬼酒股份有限公司,湖南 吉首 416000)
采用平板水解圈法对酒鬼酒制曲车间空气的细菌进行产淀粉酶活性筛选,运用基于16S rRNA基因序列的分析法对高酶活菌株进行系统发育分析.研究结果表明,65株受试菌株中,有24.6%的菌株(16株)淀粉水解酶活性呈阳性,其中有4株(JSM 2145008,JSM 2155001,JSM 2155017,JSM 2175012)产淀粉水解酶能力较强.基于16S rRNA基因序列的系统发育分析表明,这4个菌株分别属于细菌域3个大的系统发育类群中3个科的3个属.菌株JSM 2145008属于放线菌门微球菌科,与节杆菌属(Arthrobacter)的氧化节杆菌的系统发育关系最为密切,它们之间的16S rRNA基因序列相似性高达99.8%,且在系统进化树上形成一个稳定的亚分支;菌株JSM 2155001和JSM 2175012属于异常球菌——栖热菌群异常球菌科的异常球菌属(Deinococcus),分别与该属的大琼异常球菌和云威异常球菌系统发育关系最为密切(序列相似性分别为99.6%和99.9%);菌株JSM 2155017属于厚壁菌门芽孢杆菌科,与芽孢杆菌属(Bacillus)的同温层芽孢杆菌系统发育关系最为密切(序列相似性为100%),它们以极高的自展值支持(boostrap value,100%)在系统进化树上聚在一起.上述实验结果表明,酒鬼酒制曲车间空气源细菌中存在较高比例的产淀粉酶菌株,且这些菌株具有较高的类群多样性.
酒鬼酒制曲车间;空气源微生物;淀粉酶活性;系统发育分析
中国白酒酿造工艺是在相对开放的环境中进行的,发酵菌株主要来源于原辅料、空气、用水、窖泥、窖池、曲药和糟醅等[1].在酿酒发酵工艺中,首先需要酿造微生物产生胞外淀粉酶,对原料中的大宗物质淀粉进行糖化,这直接影响出酒率,在整个发酵过程中起着十分重要的作用.[2]根据以香味馥郁、酒体净爽、芳香秀雅、醇厚细腻的独特风格著名的酒鬼酒相关微生物研究报道可以看出,有学者对酒鬼酒小曲、大曲、窖泥等与发酵工艺直接相关的微生物以及其独特的生产工艺进行了一些研究[3],但对酿造环境中相关微生物的研究暂无报道.因此,笔者以酒鬼酒制曲车间空气中的微生物为研究对象,从中分离筛选出产淀粉酶的细菌,并对产淀粉酶菌株的多样性进行研究,以期了解酒鬼酒曲药空气源发酵微生物的基本情况.
1 材料和方法
1.1材料
1.1.1 主要仪器 PCR仪器(PE-9600)购自BIO-RAD公司;PCR引物由生工生物工程(上海)有限公司合成;其他试剂和仪器同文献[4].
1.1.2 培养基 (1)营养琼脂(nutrient agar,NA):牛肉膏粉3 g,蛋白胨10 g,NaCl 5 g,琼脂15 g,加水至1 000 mL,调整pH值至7.2~7.4;(2)淀粉酶筛选培养基:可溶性淀粉2 g,蛋白胨1 g,酵母膏1 g,琼脂20 g,加水至1 000 mL,调整pH值至7.5~8.0.
1.1.3 菌株来源 用于产淀粉酶研究的实验细菌菌株共65株,为本实验室采用空气沉降法[5]分离自酒鬼酒制曲车间空气样品.
1.2淀粉酶活性筛选
实验菌株用营养琼脂平板活化后,采用小十字划线法接种于淀粉酶筛选培养基,28 ℃培养5~7 d.采用平板水解圈法测定产淀粉酶活性:待实验菌株形成明显菌落后,在平板上滴加卢革氏碘液直至铺满整个平板,观察菌落周围有无不变色的透明水解圈[6].
1.3系统发育分析
总DNA提取、16S rRNA基因的PCR扩增和序列测定方法见文献[7].根据测序结果,运用NCBI网站和EzTaxon server[8]所提供的Blast搜索软件在GenBank/EMBL/DDBJ等公共数据库中进行在线相似性序列搜索,选出同源性最高的相关典型菌株的16S rRNA基因序列并组成序列集;运用CLUSTAL X[9]软件进行多重序列比对.根据Kimura模型[10]估算系统进化距离矩阵,采用MEGA 4.0软件的邻接法进行聚类分析和系统进化树的构建[11]等系统发育分析,重复取样1 000次,运用自展(bootstrap)法来评估系统发育树的拓扑结构稳定性[12].
1.4生物学特性观察
菌落特征、细胞形态和生理生化特性观察按照常见细菌鉴定手册[6]所用方法进行.
2 结果与讨论
2.1产淀粉酶活性筛选
按照平板水解圈法[5],对65株实验菌株进行产淀粉酶活性筛选.产淀粉水解酶阳性的菌株共16株,总水解率为24.6%.其中有4株(JSM 2145008,JSM 2155001,JSM 2155017,JSM 2175012)的淀粉水解圈直径达30 mm以上(见表1).实验结果表明,酒鬼酒制曲车间空气中存在较高比例的产淀粉酶菌株,其中部分菌株产淀粉酶活性显著.

表1 实验菌株产淀粉酶活性统计表
2.2基于16SrRNA基因序列的系统发育分析
在产淀粉酶活性较强菌筛选的基础上,结合菌落形态、细胞显微形态及部分生理生化实验结果综合分析,对4株产淀粉酶活性较强的菌株进行16S rRNA基因序列测定和系统发育分析.分析结果表明,菌株JSM 2145008属于放线菌门(Actinobacteria)微球菌科(Micrococcaceae)节杆菌属(Arthrobacter),与该属已知种氧化节杆菌的系统发育关系最为密切,与其典型菌株的16S rRNA基因序列相似性高达99.8%(见表2),且这2个菌株在系统进化树上形成一个稳定的亚分支(见图1);菌株JSM 2155001和JSM 2175012属于异常球菌-栖热菌群异常球菌科异常球菌属(Deinococcus),分别与该属的大琼异常球菌(Deinococcusdaejeonensis)和云威异常球菌(Deinococcusyunweiensis)系统发育关系最为密切,序列相似性分别为99.6%和99.9%(见表2),且在系统进化树上分别形成稳定的进化分支(见图1);菌株JSM 2155017属于厚壁菌门(Firmicutes)芽孢杆菌科(Bacillaceae)芽孢杆菌属(Bacillus),与该属的同温层芽孢杆菌(Bacillusstratosphericus)以100%的16S rRNA基因序列相似性和极高的自展值支持(boostrap value,100%)在系统进化树上聚在一起(见图1和表2).

表2 强产淀粉酶菌株与其系统发育关系最密切的典型菌株间的系统发育关系

图1 根据16S rRNA基因序列构建的4株产淀粉酶菌株的系统进化树
2.3产淀粉酶活性较强菌株的生物学特征
对4株产淀粉酶活性较强的菌株进行菌落特征、细胞形态和部分生理生化特征等生物学特性的观察,结果见表3(所有菌株产物H2S反应阴性,并且对干酪素或纤维水解活性呈阴性反应).
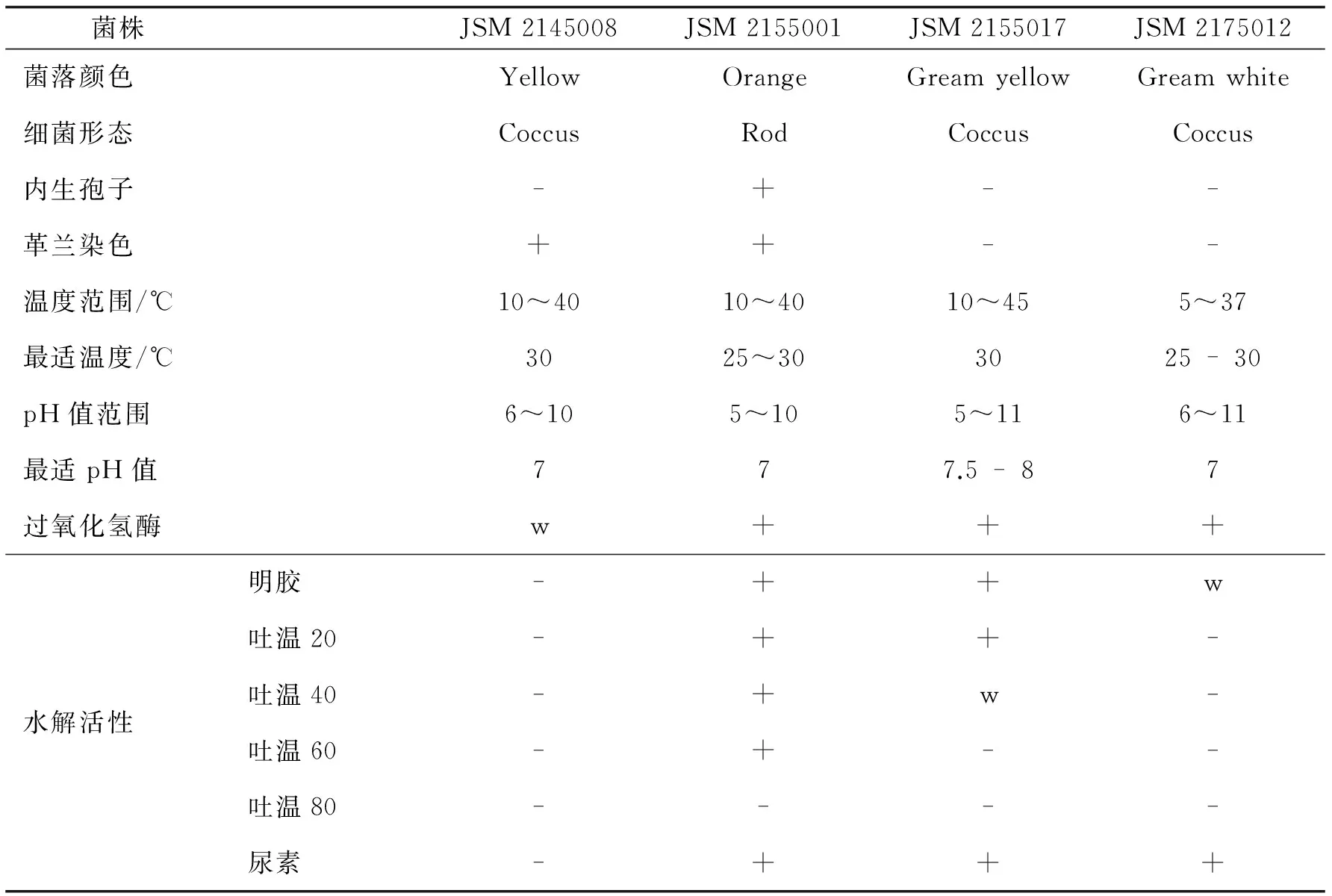
表3 产淀粉酶活性较强菌株的部分表型特征
注 +表示阳性;-表示阴性;w表示弱阳性.
3 结语
采用平板菌落水解圈法对酒鬼酒制曲车间空气样品的细菌(含放线菌)进行产淀粉酶活性筛选,并对部分阳性较强菌株进行系统发育分析和生物学特性观察.研究结果表明,65株实验菌株中有16株菌株具有产淀粉酶活性,有4株的淀粉水解圈直径达30 mm以上,说明酒鬼酒制曲车间空气中存在较高比例的产淀粉酶菌株,其中部分菌株产淀粉酶活性显著.系统发育分析结果表明,这4个产淀粉酶活性较强菌株具有较高的类群多样性,分别属于3个大的系统发育类群(Actinobacteria,Deinococcus-Thermus,Firmicutes)中的3个科(Bacillaceae,Deinococcaceae,Micrococcaceae)的3个属(Arthrobacter,Bacillus,Deinococcus).根据有关文献报道,目前生产应用的细菌源淀粉酶大部分来源于栖热菌属(Thermus)[13]、芽孢杆菌属(Bacillus)[14]和噬纤维菌属(Cytophaga)[15-16]等,而文中鉴定的产淀粉酶菌株还包括了节细菌属(Arthrobacter)和异常球菌属(Deinococcus),说明在酒鬼酒酿造环境中存在一些特殊的酿造功能微生物类群,该微生物在酒鬼酒独特的馥郁香型和独特品质的形成方面有何作用,值得进一步探讨.
[1] 陕小虎,敖宗华,沈才洪,等.中国固态白酒中酿酒微生物研究进展[C]//第12届中国科学技术协会年会(第3卷).福州:中国科学技术协会年会,2010:1-6.
[2] 张双民.土壤中淀粉酶高产菌株的分离及产酶条件的优化[J].土壤肥料,2006(2):59-61.
[3] 赵 湖.湘泉酒微生物群系的分布探讨[J].酿酒,2002,29(4):23-24.
[4] 陈义光,李文均,崔晓龙,等.具抗肿瘤活性放线菌菌株YIM 90022的分离和系统发育分析[J].微生物学报,2006,46(5):696-701.
[5] 于玺华,车凤翔.现代空气微生物学及采检鉴技术[M].北京:军事医学科学出版社,1998.
[6] 东秀珠,蔡妙英.常见细菌鉴定手册[M].北京:科学出版社.2001:43-65.
[8] CHUN J,LEE J,JUNG Y,WAGNER M.A Web-Based Tool for the Identification of Prokaryotes Based on 16S Ribosomal RNA Gene Sequences[J].International Journal of Systematic and Evolutionary Microbiology,2007,57(10):2 259-2 261.
[9] THOMPSON J D,GIBSON T J,PLEWNIAK F,et al.The CLUSTAL_X Windows Interface:Flexible Strategies for Multiple Sequence Alignment Aided by Quality Analysis Tools[J].Nucleic Acids Research,1997,25(24):4 876-4 882.
[10] KIMURA M.A Simple Method for Estimating Evolutionary Rates of Base Substitutions Through Comparative Studies of Nucleotide Sequences[J].Journal of Molecular Evolution,1980,16(2):111-120.
[11] TAMURA K,DUDLEY J,NEI M,et al.MEGA4:Molecular Evolutionary Genetics Analysis (MEGA) Software Version 4.0[J].Molecular Biology and Evolution,2007,24(8):1 596-1 599.
[12] FELSENSTEIN J.Confidence Limits on Phylogenies:An Approach Using the Bootstrap[J].Evolution,1985,39(4):783-791.
[13] 翁庆北,赵维娜,万晴姣,等.茅台酒曲中产淀粉酶细菌分离及性质[J].贵州师范大学学报:自然科学版,2005,23(2):20-28.
[14] GOYAL N,GUPTA J K,SONI S K.A Novel Raw Starch Digesting Thermostable α-Amylase fromBacillusSp.Ⅰ-3 and Its Use in the Direct Hydrolysis of Raw Potato Starch[J].Enzyme Microb. Tech.,2005,37(7):723-734.
[15] SHIOU R J,HUNG H C,JEANG C L.Improving the Themostability of Raw Starch Digesting Amylase from aCytophagaSp. by Site Directed Mutagenesis[J].Appl. Environ. Microb.,2003,69(4):2 383-2 385.
[16] JEANG C L,CHEN LS,SHIOU R J,et al.Cloning of a Gene Encoding Raw Starch Digesting Amylase fromCytophagaSp.and Its Expression inE.Coli[J].Appl. Environ. Microb.,2002,68(7):3 651-3 654.
(责任编辑 陈炳权)
ScreeningandPhylogeneticAnalysisofAmylase-ProducingStrainsIsolatedfromtheAirSamplesfromaLiquorStarter-MakingWorkshopofJiuguiLiquorCo.Ltd.
ZHONG Xiaojuan1,LIU He1,CHENG Jinlian1,LIU Zhuxiang1,CHEN Yiguang1
(1.College of Biology and Environmental Sciences,Jishou University,Jishou 416000,China;2.Jiugui Liquor Co. Ltd.,Jishou 416000,China)
The culturable bacteria in the air samples from a liquor starter-making workshop in Jiugui Liquor Co.Ltd.,China were isolated by using the natural precipitation method and culture-dependent method.The amylase-producing ability of the strains was investigated by using the plate hydrolysis spot method.The results showed that 16 out of 65 (24.6%) strains tested exhibited amylase-producing activity,in which 4 strains (JSM 2145008,JSM 2155001,JSM 2155017,JSM 2175012) could relatively strongly produce amylase.Subsequently,these 4 strains were investigated by means of a phylogenetic analysis based on 16S rRNA gene sequence comparisons.The results showed that these 4 strains were the members of 3 families (Bacillaceae,Deinococcaceae,Micrococcaceae) in 3 phylogenetic group/phyla (Actinobacteria,Deinococcus-Thermus,Firmicutes):strain JSM 2145008 belonged to the genus Arthrobacter (Actinobacteria,Micrococcaceae),being most closely to the type strain of Arthrobacter oxydans (sequence similarity 99.8%);strains JSM 2155001 and JSM 2175012 were the members of the genus Deinococcus (Deinococcus-Thermus,Deinococcaceae),being related most closely to the type strains ofDeinococcusdaejeonensis(99.6%) andDeinococcusyunweiensis(99.9%),respectively;strain JSM 2155017 belonged to the genusBacillus(Firmicutes,Bacillaceae),exhibiting 100% 16S rRNA gene sequence similarity to the type strain of Bacillus stratosphericu.In conclusion,there is abundant bacterial diversity,as well as a number of amylase-producing strains in the air samples from a liquor starter-making workshop in Jiugui Liquor Co. Ltd.
liquor starter-making workshop;airborne microbes;amylase activity;phylogenetic analysis
1007-2985(2014)05-0051-04
2014-06-15
国家自然科学基金资助项目(30970007);湖南省重点学科建设资助项目(JSU071312Z01);湖南省高校科技创新团队支持计划资助项目(201208Z01);酒鬼酒股份有限公司委托项目(JGKJ 2012-JD03);吉首大学校级科研课题资助项目(13JDY017)
钟小娟(1983-),女(白族),湖南桑植人,吉首大学生物资源与环境科学学院硕士研究生,主要从事微生物资源与生态研究
陈义光(1965-),男,湖南新化人,吉首大学生物资源与环境科学学院教授,硕士生导师,主要从事微生物资源与分类研究.
Q939.9;S182
B
10.3969/j.issn.1007-2985.2014.05.012

