优化玫瑰红鹅膏培养条件及抑菌活性研究*
张 楠,包海鹰
(吉林农业大学中药材学院,食药用菌教育部工程研究中心,吉林 长春 130118)
鹅膏菌是一个世界性分布的大属,有毒蘑菇中最重要的一类。目前已定名的约有500多种[1]。属于担子菌亚门 (Basidiomycotina)、层菌纲 (Hymenomycetes)、伞菌目 (Agaricales)、鹅膏科 (Amanitaceae)、鹅膏属 (Amanita Pers.:Gray)[2]。鹅膏菌中主要的毒素为肽类毒素,共有3大类22种,分别为鹅膏毒肽 (Amatoxins)9种、鬼笔毒肽 (Phallotoxins)7种和毒伞素 (Vrotoxins)6种。肽类毒素由于独特的生物学特性,目前广泛应用于生物学、医学、遗传学、生物化学、基因工程,病毒等研究领域[3-5]。由于鹅膏属大多数与针科或壳斗可形成外生菌根菌[6],尚无人工栽培。国内毒素来源美国Sigma公司,每毫克价格在1.2×105美元~1.4×105美元。
因为鹅膏属在真菌中的关键性地位以及其毒素的特殊性,人工培养鹅膏菌的努力从来没有停止过。为了更方便地研究鹅膏菌,人工纯培养正在逐步成为一个研究热点[7]。
依据包海鹰教授多年来对长白山产鹅膏属真菌的调查研究,以及对7种长白山产鹅膏属真菌肽类毒素的高效液相分析[8,9],发现了玫瑰红鹅膏 A.pallidorosea,其具有资源丰富、毒素含量高等特点。本试验对玫瑰红鹅膏进行液体发酵培养,并对发酵产物中的肽类毒素进行分离提取,研究其药理活性,为毒素获得提供新的资源,进一步丰富了鹅膏毒肽药理作用方面的研究内容。
1 材料与方法
1.1 试验材料
玫瑰红鹅膏Amanita pallidorosea,采自吉林省辉南县朝阳镇样子哨。
1.2 仪器和试剂
1.2.1 仪器
安捷伦1100高效液相色谱仪;色谱分析柱:分析柱YWG-C18柱 (150 mm×4.6 mm,10 μm),北京分析仪器厂,半制备柱 VenusⅡ MP-C18柱 (250 mm ×10 mm,10 μm),Agela Technologies;二氧化碳培养箱,NAPCO法国;离心机SORVALL;电子分析天平,SHIMADZU-AUY220型。
1.2.2 试剂
醋酸铵 (美国Sigma公司);乙腈和甲醇 (色谱纯);冰醋酸和石油醚 (分析纯);洗脱液A相:10%乙腈和90%0.02 mol·L-1醋酸铵,冰醋酸调节pH值至5.0;洗脱液B相:30%乙腈和70%浓度0.02 mol·L-1醋酸铵,冰醋酸调节pH值至5.0;纯净水 (杭州娃哈哈公司)。
标准品:a-鹅膏毒肽 (a-AMA)、β-鹅膏毒肽 (β-AMA)、二羟鬼笔毒肽 [Phalloidin(PHD)],以上3种标准品均由吉林农业大学菌物研究所提供。
1.3 液体深层培养方法
1.3.1 基础培养基 (改良PDM)
马铃薯 200 g·L-1、葡萄糖 20 g·L-1、磷酸二氢钾3 g·L-1、硫酸镁 0.5 g·L-1、磷酸氢氨 0.5 g·L-1、氯化钙0.05 g·L-1、硝酸钾 0.1 g·L-1、麦芽汁 (12 波美度)120 mL、VB10.01 g·L-1。
1.3.2 菌种培养
斜面菌种于26℃恒温培养箱培养10 d后,将适量菌丝接入最适培养基中,然后置于恒温振荡器上,150 r·min-1振荡培养10 d。
摇瓶发酵:250 mL三角瓶装100 mL培养液,接种量5%(v·v-1),置于 26℃恒温振荡器上,150 r·min-1振荡培养 25 d。取25 d的发酵菌丝体,于烘箱中60℃烘至恒重,电子天平称重并记录。
1.3.3 培养条件优化
试验设计采用中心组合旋转设计 (Box-Benhnken)法,对温度 (A)、pH值 (B)和转速 (C)进行优化设计。各因素及其编码水平的设计见表1。
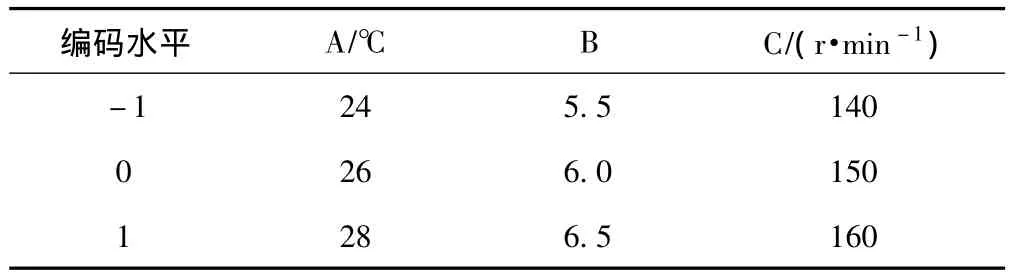
表1 中心组合旋转设计的变量及水平
1.4 发酵产物中肽类毒素的检测
1.4.1 粗毒液的制备
菌种培养完成后,将发酵液过滤,收集滤渣和滤液,把菌丝体在60℃下烘干后研磨。取1 g研磨后的菌丝体粉末,溶于10 mL 50%甲醇中,室温下振荡抽提24 h,8 000 r·min-1离心收集上清液。沉淀以10 mL 50%甲醇室温下振荡抽提24 h,8 000 r·min-1离心收集并合并上清液。用石油醚去脂2次,然后冷冻干燥,冻干的样品用超纯水溶解,再用0.22 μm的微孔滤膜过滤,得到鹅膏粗毒液。
1.4.2 HPLC测定参数
使用安捷伦1100高效液相色谱仪分离梯度模式为:0→15 min,B 0→5%,A 100%→95%;15 min→35 min,B 5%→80%,A 95%→20%;35 min→40 min,B 80%,A 20%;40 min→45 min,B80%→100%,A20%→0%;45 min→50 min,B 100%;50 min→55 min,B 100%→0%,A 0→100%并保持10 min。纯化梯度模式:与分离梯度模式相同。检测波长:295 nm;柱温:40℃;流速:分析柱1 mL·min-1;半制备柱:2 mL·min-1。进样量:分析柱 10 μL,半制备柱 1 mL。
1.4.3 HPLC分离纯化
先在分析柱上筛选出最适宜的色谱条件,后在半制备柱上进行毒素的分离和纯化,得到2种化合物。冷冻干燥后,用高效液相进行检测。分离纯化结果用Finnigan-MAT.LCQ电喷雾质谱仪进行鉴定。
1.5 对植物病原菌的抑制活性
1.5.1 供试病原真菌
香瓜枯萎病菌 (Fusarium oxysporum),菌种由吉林农业大学菌物研究所提供。
1.5.2 指示菌的培养
首先将试管斜面保存的菌种接种到PDA平板培养基上,等菌种长好后,用直径7 mm的打孔器制成菌块。
1.5.3 供试品对菌丝生长的影响
采用生长速率法[10-12]。取质量浓度为 105 μg·mL-1的粗提物溶液200 μL,混合于100 mL的PDA培养基中,配制以下浓度的含毒培养基,即玫瑰红鹅膏子实体粗毒液:200 μg·mL-1[13]、100 μg·mL-1、50 μg·mL-1;发酵产物:800 μg·mL-1、400 μg·mL-1、200 μg·mL-1;不添加任何供试品的平板培养基作为空白对照。每个样品设置3个重复。将已制好的菌块接种于含毒的平板培养基中,置于26℃的培养箱中培养7 d。然后,用十字交叉法测抑菌率 (%),公式为:
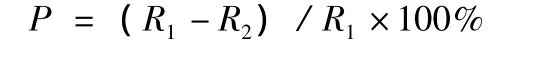
式中:R1为对照菌落直径;R2为处理菌落直径。
1.5.4 数据统计分析
所有数据采用SPSS17.0统计软件进行处理,计数资料采用x±SD表示。p<0.05说明在统计学上呈显著差异,p<0.01说明在统计学上呈极显著差异,有统计学意义。
2 结果与分析
2.1 液体深层培养
2.1.1 不同温度对菌丝体重量的影响
设置20℃、23℃、26℃、30℃、33℃、36℃共计5个不同的温度处理 (温度变幅为±1℃),结果见图1。
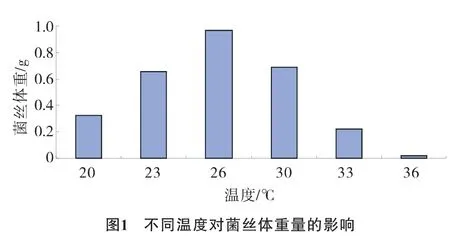
结果表明,玫瑰红鹅膏菌丝体在26℃下培养,菌丝体干物质重量最高,生长状态最好。当温度达到33℃时,菌丝体生长极其缓慢,当温度达到36℃时,菌丝体基本停止生长。可能温度过高会导致菌体内的酶活性降低或者丧失。
2.1.2 不同pH值对菌丝体重量的影响
设置4、5、6、7、8共计5个不同的 pH值处理。用1 mol·L-1的HCl和NaOH调节培养基的pH值,结果见图2。
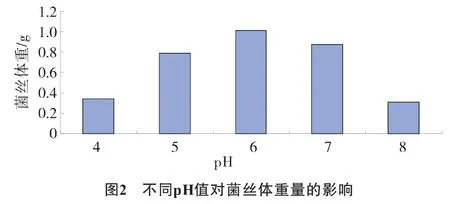
结果表明,玫瑰红鹅膏菌丝体在pH值为6的条件培养时,菌丝体干物质重量最高。
2.1.3 不同转速对菌丝体重量的影响
设置 80 r·min-1、100 r·min-1、120 r·min-1、140 r·min-1、160 r·min-1共计5个不同的转速处理,结果见图3。
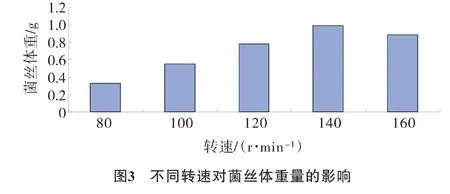
结果表明,玫瑰红鹅膏菌丝体在140 r·min-1振荡培养时,菌丝体干物质重量最高。
2.1.4 Box-Benhnken实验分析
中心组合旋转试验设计及结果见表2。
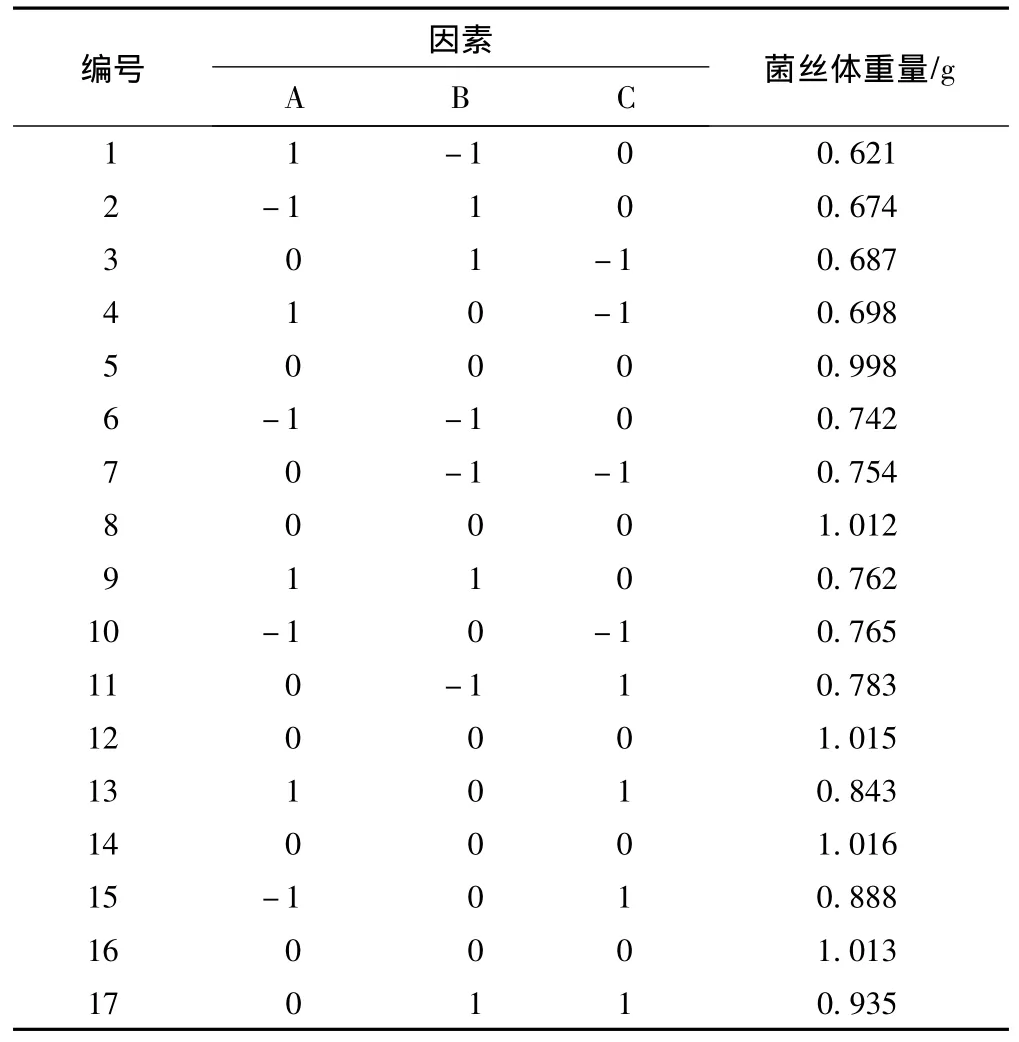
表2 中心组合旋转试验设计及结果
本试验以玫瑰红鹅膏菌丝体干重 (g)为响应变量,以温度 (A)、pH值 (B)和转速 (C)为影响因子,进行 Box-Behnken响应面分析,利用统计软件SAS8.0对试验结果进行统计分析,可建立二次回归方程 (编码后):
Y=+1.00-0.018×A+0.020×B+0.068×C+0.052×A×B+5.500E-003×A×C+0.055×B×C-0.15×A2-0.16×B2-0.061×C2,相关系数 R2=99.67%,修正相关系数 R2Adj=99.24%。
对二次回归方程进行方差分析,结果见表3。

表3 二次回归方程方差分析表
回归模型达到极显著水平 (p<0.01)而误项不显著,说明回归方程与实际情况较吻合,试验误差小,因此可利用该回归方程代替试验真实点对试验结果进行分析。由表3可知,模型的一次项A、B、C极显著;二次项均极显著;交互项AB、BC极显著,AC不显著。这表明各种因素对于菌丝体重量的影响不是简单的线性关系。
2.1.5 因素间的交互作用
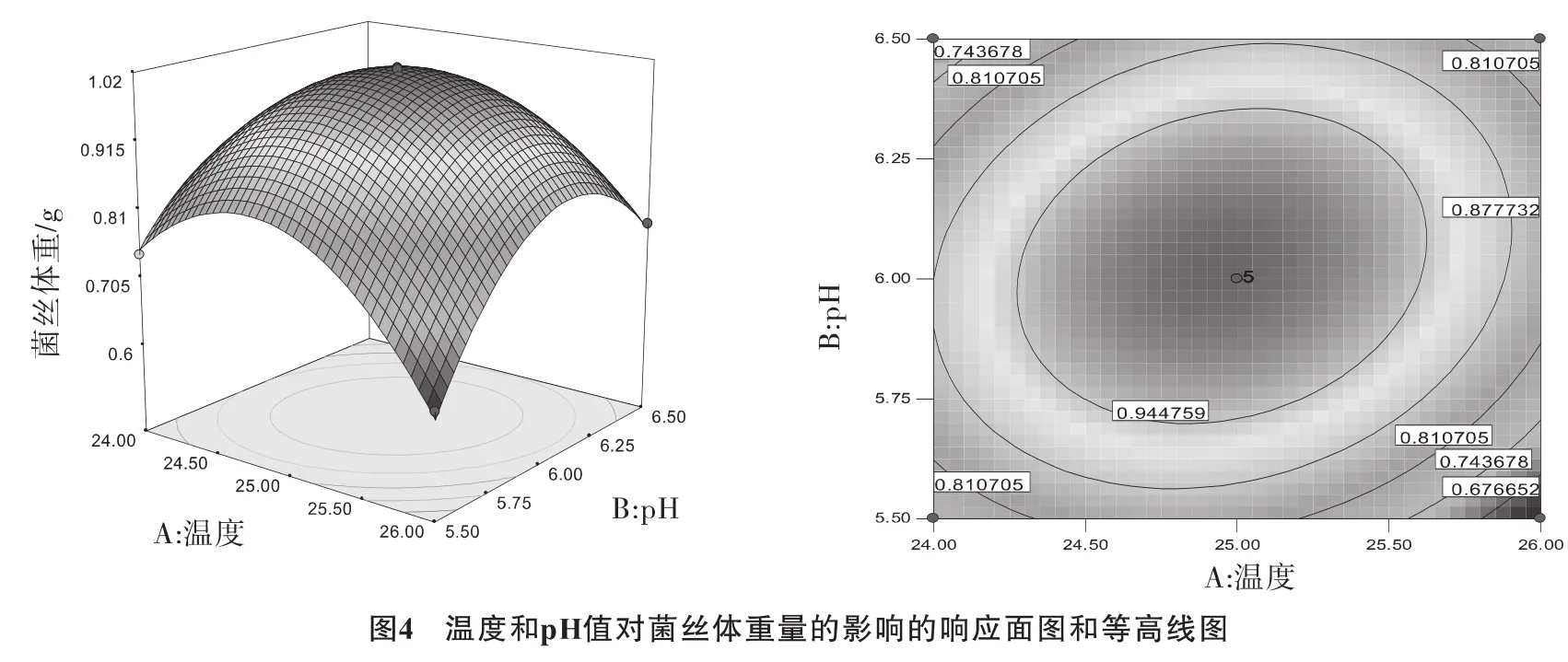
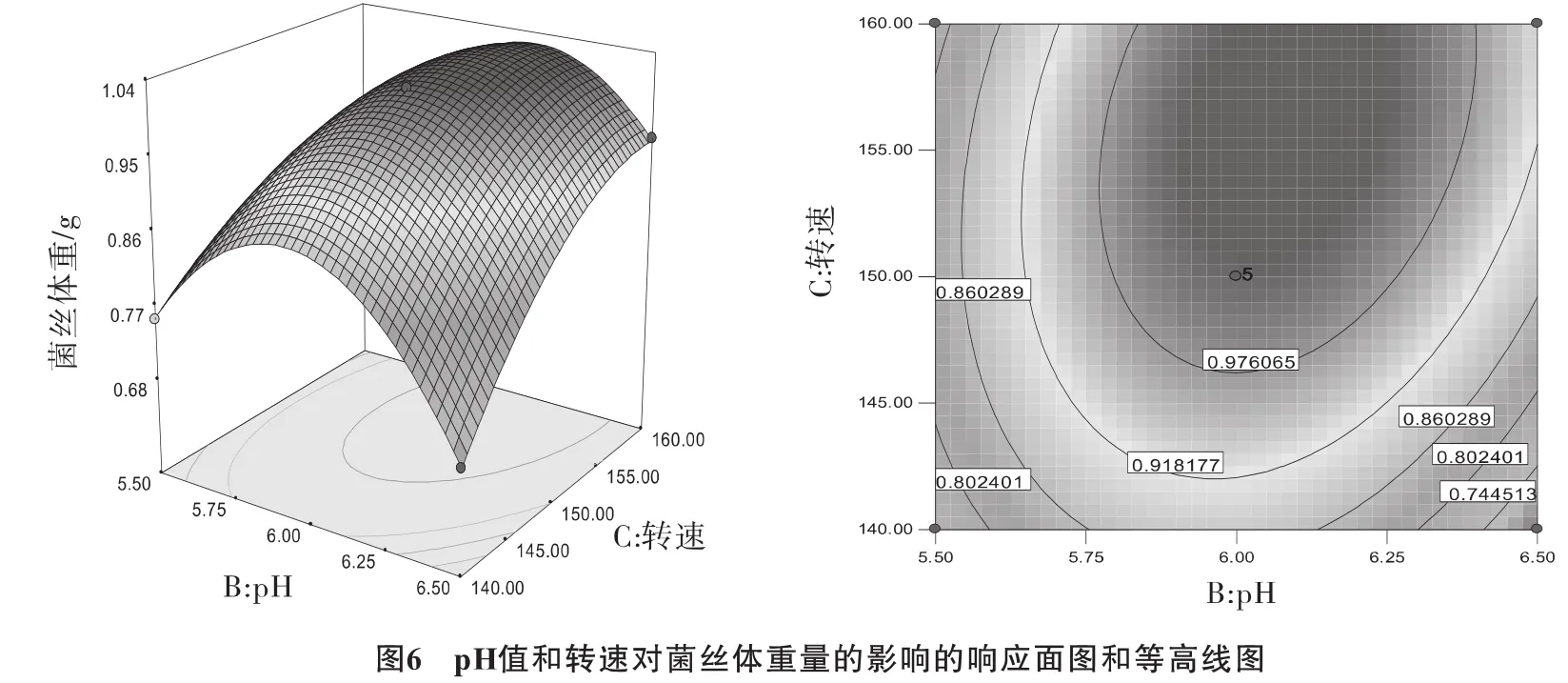
根据回归方程并利用Design-Expert软件作不同因素的响应面分析图和等高线图,温度、pH值和转速三因素及其交互作用对菌丝体重量的影响结果通过图4~图6直接反应出来。
结果表明,等高线的形状可以反映出因素间交互效应的强弱,圆形表示两因素间的交互效应不显著,椭圆形表示显著。
2.1.6 玫瑰红鹅膏发酵条件的优化与结果验证
对方程Y=+1.00-0.018×A+0.020×B+0.018×C+0.052×A×B+5.500E-003×A×C+0.055×B×C-0.15×A2-0.16×B2-0.061×C2,最优培养条件为温度25℃、pH值6、转速为156 r·min-1,其所得玫瑰红鹅膏菌丝体干重为1.034 g。

2.1.7 回归模型验证试验
根据最优培养条件对模型进行验证,3次平行验证试验所得玫瑰红鹅膏菌丝体干重均值为1.054 g,优化后提高了1.02倍,实际值与预测值的误差为+2.8%。表明响应面法优化玫瑰红鹅膏最佳培养条件是有效可行的。
2.2 发酵产物中肽类毒素的检测
将菌丝体粗提物液通过液相进行分离纯化。液相保留时间,因不同的分离条件和不同的色谱柱,保留时间有一定的差异,但是各个化合物在液相上的出峰顺序保持不变。同时根据液相色谱质谱联用仪和内标法确定化合物,得到2个化合物,但是其含量较低。化合物1在分析柱上检测结果如图7所示。
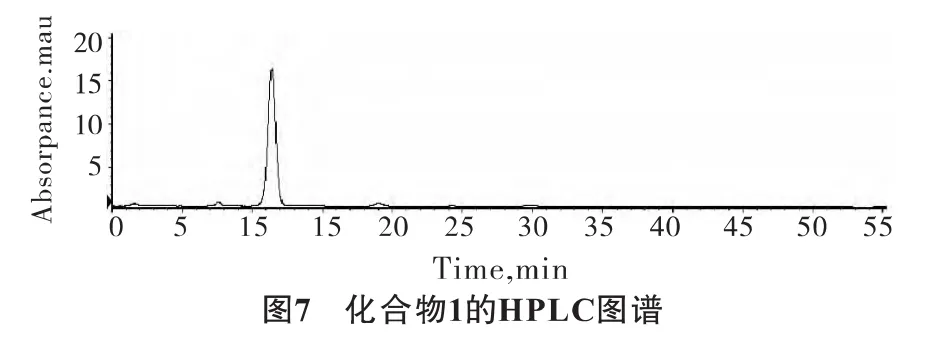
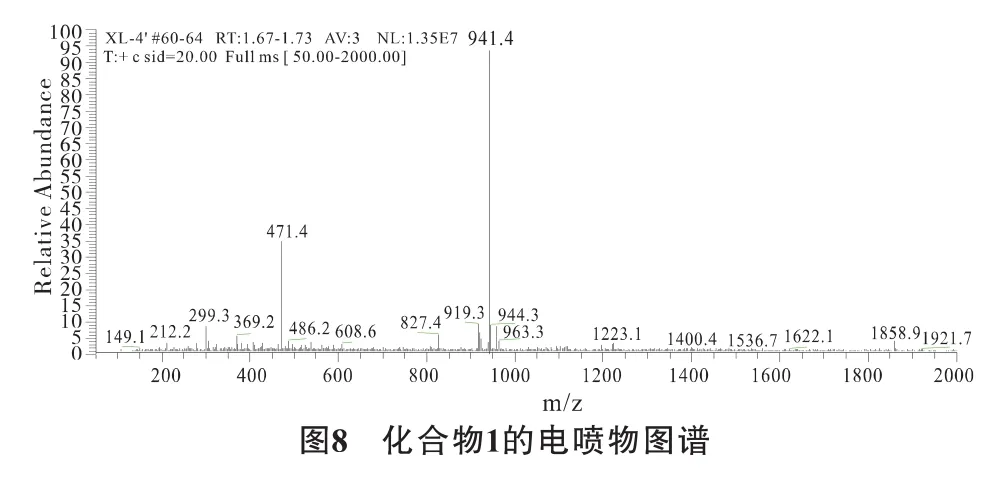
检测化合物1保留时间是11.41 min,纯度较高。电喷雾质谱[M+Na]峰是941,MW是918(图8)。根据色谱保留时间和分子量,判断组分为α-鹅膏毒肽 (α-AMA),分子式为C39H54N10O14S。
化合物2在分析住上检测结果如图9所示,检测化合物2保留时间是7.92 min。电喷雾质谱 [M-H]峰是918,MW是919(图10)。根据色谱保留时间和分子量,判断组分为β-鹅膏毒肽 (β-AMA),分子式C39H53N9O15S。


2.3 对植物病原菌的抑制活性
2.3.1 玫瑰红鹅膏子实体粗毒液对香瓜枯萎病菌的抑制作用
玫瑰红鹅膏子实体粗毒液对香瓜枯萎病菌的抑制作用见表4。
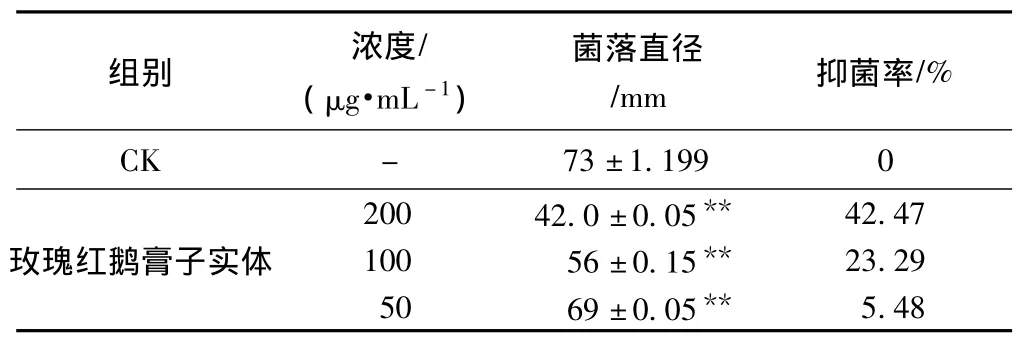
表4 玫瑰红鹅膏子实体粗毒液对香瓜枯萎病菌抑制作用 (n=3)
由表4可以看出,鹅膏粗毒液对香瓜枯萎病菌的抑制作用呈量效关系。浓度为 200 μg·mL-1时抑制率最高,为42.47%,100 μg·mL-1时作用力次之,50 μg·mL-1时抑制率最低,且与空白组对比呈极显著差异 (p<0.01)。
2.3.2 发酵产物对香瓜枯萎病菌的抑制作用
发酵产物对香瓜枯萎病菌的抑制作用见表5。

表5 发酵产物对香瓜枯萎病菌的抑制作用 (n=3)
由表5可知,发酵产物对香瓜枯萎病菌的抑制作用呈量效关系。浓度为800 μg·mL-1时抑制率最高,为 21.29%;400 μg·mL-1时作用力次之,且与空白组对比呈极显著差异(p <0.01);200 μg·mL-1时抑制率为 0。
3 讨论
经过响应面方法优化,获得了最佳培养条件,即温度为25℃,pH值为6,转数为156 r·min-1。此培养条件更适合玫瑰红鹅膏菌丝体的生长。同时,在其发酵产物中检测到2种毒素α-AMA和β-AMA。但是毒素含量较低,如何提高发酵产物中的毒素含量有待于更进一步的研究。
玫瑰红鹅膏子实体粗毒液和发酵产物对香瓜枯萎病菌有不同的抑制作用。当子实体浓度为200 μg·mL-1时抑制率最高,为42.47%。可能是肽类毒素对植物病原菌有抑制作用,因为玫瑰红鹅膏子实体粗毒液和发酵产物中的肽类毒素的含量不同,造成了抑菌效果的差异。鹅膏肽类毒素影响真菌细胞内RNA聚合酶Ⅱ的活性,进而抑制了真菌细胞内DNA和RNA的合成,继而阻碍了蛋白质的合成,从而导致了细胞的死亡[14,15]。其作为新型的生物农药有待于更进一步的研究和应用。
[1]Yang ZL,Wei M,Kottke I,et al.Amanita.//Cairney J.Ectomycorrhizal fungi key genera in profile[M].Berlin:Springer-Verlag,1999(369):201-230.
[2]Kirk PM,Canon PF,Minter DW,et al.Ainsworth& Bisby's dictionary of the fungi 10th [M].UK:The Cambridge University Press,2008.
[3]Zhang ZG,Zhang XY,Li DP.Application of Amanita toxic peptides in life science research [J].Journal of Hygiene Research,1999,28(1):60-63.
[4]赵建,张杰,候若彤,等.鹅膏毒素的研究进展[J].林产化学与工业,2003,23(2):90-96.
[5]张微思,张志国,程霞,等.鹅膏菌属研究进展 [J].中国食用菌,2006,25(6):10-12.
[6]杨祝良.中国鹅膏菌属 (担子菌)的物种多样性[J].云南植物研究,2000,22(2):135-142.
[7]Wieland H.Peptides of poisonous Amanita mushrooms[M].Berlin:Springer-Verlag,1986.
[8]包海鹰,李玉,图力古尔,等.长白山鹅膏属真菌肽类毒素的HPLC分析 [J].菌物系统,2002,21(2):234-238.
[9]包海鹰,图力古尔,李玉.7种鹅膏菌属真菌肽类毒素的HPLC分析 [J].菌物研究,2003,3(1):13-16.
[10]赵永强,张成玲,张薇.4种杀菌剂对烟草根黑腐病菌的室内毒力测定 [J].中国烟草报,2009,15(1):49-51.
[11]Chang HT,Cheng YH,Wu CL,et al.Antifungal activity of essential oil and its constituents from Calocedrus macrolepis var.formosana Florin leaf against plant pathogenic fungi[J].Bioresource Technology,2008,99(14):6266-6270.
[12]李丽娜,纪明山,李艳丽,等.4种植物提取物对植物病原菌的抑菌作用 [J].农药,2006,1(45):61-63.
[13]张焱珍,李家瑞,杨亚玲.抑制植物病原菌的植物提取物筛选[D].昆明理工大学,2011.
[14]张志光,李常明,李东平.几种不同鹅膏菌毒素对真核生物RNA聚合酶Ⅱ抑制作用的比较研究[J].菌物系统,1997,16(4):311-314.
[15]王玉玲,包海鹰,图力古尔,等.玫瑰红鹅膏主要肽类毒素的HPLC测定及其对白色念珠菌的抑制活性 [J].微生物学报,2011,51(9):1205-1211.

