文心兰一个PEBP 家族基因的克隆、表达及载体构建
袁秀云,梁 芳,蒋素华,王默霏,刘 佳,崔 波*
(1.郑州师范学院 生物工程研究所,河南 郑州 450044;2.河南农业大学 生命科学学院,河南 郑州 450002)
PEBP 家族基因广泛存在于细菌[1]、酵母[2]、植物[3]和动物[4-5]中,其编码的蛋白序列与磷脂酰乙醇胺结合蛋白(phosphatidylethanolamine-binding protein,PEBP)和Raf 激酶抑制剂蛋白(Raf kinase inhibitorprotein,RKIP)相似,包含单一保守的PEBP/RKIP 结构域。近年来,从植物中发现了大量的PEBP家族基因,例如在双子叶植物拟南芥[6]、葡萄[7]、番茄[8]和杨树[9]中发现有6~9 个,单子叶植物水稻[10]、小麦[10]和玉米[11]中的分别有19 个、20 个和24 个PEBP 家族基因。通过对植物PEBP 家族基因的系统进化树分析发现,PEBP 基因家族分为FT-like、MFT-like 和TFL1-like 3 个亚家族[11]。在植物PEBP 家族基因的研究中,FT-like 和TFL1-like 基因的研究相对较多,FT-like 基因是植物开花的诱导因子,也被认为可能是植物开花素的组分之一,具有促进开花的作用[12-13],而TFL1-like 基因是花发育的抑制基因,能够维持植物的营养生长和花序的无限生长状态[14-16],而MFT-like 基因在植物中研究还很少,其功能还知之尚少,可能有冗余的成花诱导作用,还可能与种子的发育有关[11,17]。由于PEBP 家族基因在植物发育特别是营养生长到生殖生长发育转变过程中的调控作用及在植物育种中的应用前景,其功能研究及作用机制成为目前研究热点之一。随着拟南芥和水稻等模式植物分子生物学研究的不断深入,人们对PEBP 家族基因在植物发育过程中的作用有了进一步认识,但是不同植物中具有多个PEBP 家族基因,多数基因的功能还不清楚,其蛋白的作用机制还不明确,因此为了更加清楚地了解植物PEBP 家族基因的作用机制,需要深入研究PEBP 家族基因在不同植物中的功能。
文心兰为兰科(Orchidaceae)文心兰属(Oncidium),又名舞女兰,由于其花形优美、花色亮丽,具有良好的观赏价值,近年来在国际及国内花卉市场倍受青睐,是洋兰类常见花卉,花期转变的调控机制是研究的主要内容,也是其栽培和育种的理论基础。Hou 和Yang 从文心兰(O.‘Gower Ramsey’)中鉴定出2 个PEBP 家族基因OnFT 和OnTFL1,与拟南芥的FT 和TFL1 同源,同时能够调控文心兰的成花转变[18]。显然,目前文心兰PEBP 家族基因的研究还在起步阶段,研究结果还不能对文心兰PEBP 家族基因有全面认识。本研究以文心兰杂交品种(Oncidium‘Sweet Sugar’)为材料,利用RT-PCR 技术克隆到一个PEBP 家族基因(OnTF-like),采用RT-qPCR 方法,对文心兰不同时期不同器官中OnTF-like 的表达量进行定量分析,并构建了该基因的正义和反义表达载体。该研究结果有助于进一步阐明PEBP家族基因在文心兰组织中的表达特性及分子调控机制,并为今后通过基因工程技术进行遗传改良和种质创新奠定基础。
1 材料与方法
1.1 试验材料
试验所用文心兰(O.Sweet Sugar)来自郑州师范学院智能温室,用文心兰花蕾期叶片为材料进行基因克隆。另外分别取成苗期(没有花葶抽出)、花蕾期(花葶抽出,有花蕾,无开花)、盛花期(花葶上大部分花蕾盛开)、花后期(开花过程结束,花枯萎脱落)的叶片、根、花葶、花瓣、柱头、萼片等材料进行表达分析。所有材料取后迅速用液氮速冻,于-80 ℃冰箱备用。
1.2 总RNA 的提取及cDNA 第一链的合成
将文心兰不同组织在液氮中研磨至粉状,用Trizol(Invitrogen 公司)试剂提取其总RNA,用琼脂糖凝胶电泳鉴定RNA 的完整性,以核酸蛋白分析仪(Q5000,Quawell,USA)测定其A260,A280值,计算RNA浓度和纯度。以提取的总RNA 为模板,用M-MLV 反转录酶(TaKaRa 公司)合成cDNA,用于基因克隆;用PrimeScriptRT reagent Kit with gDNA Eraser(TaKaRa)反转录成cDNA,将反转录的cDNA 稀释5 倍备用于荧光定量检测。
1.3 OnTF-like 基因序列的克隆与分析
根据GenBank 中已登录AB052943(水稻)、AY705794(小麦)、AK376849(大麦)、NM_001112781(玉米)、GU324590(黑麦)等序列,采用Primer Premier5.0 设计1 对引物,PEBP-F:5'-ATG GCC GGT AGG GAT AGG G-3'和PEBP-R:5'-GCC GTG GGT AGA TCA ATT GTA CAT-3',用于克隆基因的编码区序列。其PCR 反应条件为:94 ℃预变性5 min,94 ℃变性40 s,59.5 ℃复性40 s,72 ℃延伸40 min,35个循环,最后72 ℃延伸10 min。PCR 产物经过凝胶回收,与pMD19-T vector(TAKARA)连接,转化DH5α 感受态细胞,经蓝白斑筛选及PCR 鉴定后送去测序。
已有序列的检索使用GenBank 的Blast 在线分析(http://www.ncbi.nlm.nih.gov/blast/);系统进化树使用MEGA4.0 软件的Neighbor-joining 法建成。
1.4 qRT-PCR 分析
根据基因的全长设计1 对定量引物qRT-F:5'-TCGTGATGGTAGACCCAGATG-3'和qRT-R:5'-GCTCTCATAGCACATCACTTCCT-3';以文心兰的GAPDH 基因(GenBank 登录序列号为:JN981141)作为内参基因,其引物设计为qRT-GF:5'-GCTGCTAAGGCTGTGGGTA-3'和qRT-GF:5'-CTTGCCCTCAGACTCTTCCT-3'。采用SYBR Premix Ex TaqTMⅡkit(TaKaRa),反应体系为25 μL,反应程序为:94 ℃预变性1 min,94 ℃变性15 s,56 ℃退火15 s,72 ℃延伸20 s,40 次循环,每次循环的第3 步进行荧光采集。qRT-PCR 反应在Eppendorf Mastercycler 荧光定量PCR 仪上进行,3 次技术重复,2 次生物学重复,并做阴性对照。通过溶解曲线和扩增曲线确定引物的特异性。试验输出的数据用Microsoft Excel进行分析处理。目的基因相对表达量Rel.Exp=2-ΔΔCt,其中ΔCt=Ct(OnTF-like)-Ct(GAPDH),ΔΔ Ct=(各植物组织ΔCt)-(苗期叶ΔCt)
1.5 OnTF-like 基因正义和反义植物表达载体的构建
将正向引物PEBP-F 的5'端分别引入Bgl II 和Nhe I 限制性内切酶,将反向引物PEBP-R 的5'端分别引入Nhe I 和Bgl II 限制性内切酶,以1.3 步骤中插入OnTF-like 片段的pMD19-T 质粒为模板,进行PCR 扩增,用于构建正义和反义表达载体。PCR 反应程序为:94 ℃变性5 min;94 ℃变性35 s,59.5℃退火35 s,72 ℃延伸40 min,35 个循环;72 ℃延伸10 min。将目的片段连接到pMD19-T 载体上,转入大肠杆菌DH5α 菌株,测序进行ORF 序列验证,得到的阳性质粒分别命名为pMD-OnTF-like-S 和pMD-OnTF-like-A。
以改造的pCAMBIA1301 质粒(修改了Nco I 酶切位点)为表达载体,将pCAMBIA1301 用Bgl II 和Nhe I 限制性内切酶不完全消化,回收pCAMBIA1301 质粒经酶消化后的9 844 bp 的载体片段,再分别将pMD19-OnTF-like-S 和pMD19-OnTF-like-A 质粒用Bgl II 和Nhe I 限制性内切酶彻底消化,获得558 bp的目的基因片段。将回收的表达载体片段与目的基因片段经T4 连接酶16 ℃过夜连接。将连接产物转化DH5α 感受态细胞,筛选阳性菌落,重组质粒命名为1301-OnTF-like-S(正义植物表达载体)和1301-OnTF-like-A(反义植物表达载体),提取质粒后以限制性内切酶Sph I 酶切鉴定,预期获得8 632 bp 和1 757 bp 2 条片段,酶切鉴定正确的质粒再次测序验证。
2 结果与分析
2.1 OnTF-like 基因序列的克隆
以文心兰花蕾期叶片的总RNA 为模板,利用引物PEBP-F 和PEBP-R 进行PCR 扩增,得到预期546 bp 的片段,此片段包含一个531 bp 的开放阅读框,编码177 个氨基酸(图1)。在NCBI 上进行Blastn 分析,发现此序列与大花蕙兰(Cymbidium hybrid,KF669643)、蝴蝶兰(Phalaenopsis hybrid,KC138805)的FT-like 基因有99%的相似性、与萼脊兰(Sedirea japonica,KF669644)和小麦(Triticum aestivum,AY705794)的TaFT 基因有98%的相似性,故将此基因命名为OnTF-like,登录号为KF669642,蛋白登录号为AHB86975。

图1 OnTF-like 基因的核苷酸序列和推测的氨基酸序列Fig.1 The nucleotide acid sequence and deduced amino sequence of OnTF-like gene
2.2 OnTF-like 基因的氨基酸序列比对及其系统发育分析

图2 OnTF-like 蛋白保守结构域Fig.2 OnTF-like conservative protein domain structure
利用NCBI 中的BLASTx 工具把OnTF-like 的核酸序列翻译成氨基酸序列,通过蛋白的功能结构域分析发现,该氨基酸序列包含一个PEBP 功能域(图2)。序列比对分析表明,OnTF-like 的氨基酸序列与小麦TaFT(ACA25439)、山羊草(Aegilops tauschii)FT(ABI34864)、蝴蝶兰FT(AGE45850),萼脊兰SePEBP(AHB86977),大麦(Hordeum vulgare subsp)HvFT1(AAZ38709)的同源性为99%,与黑麦草FT3(Lolium perenne,CBN73215)和草甸羊茅(Festuca pratensis)FT3(CBN73209)的同源性为97%,与高粱(Sorghum bicolor)的预测蛋白PEBP(XP_002436509)同源性为96%,与玉米(Zea mays)ACN15(NP_001106252)同源性为94%,与野生稻(Oryza rufipogon)Hd3a(BAO03052)的同源性为92%。与Hou 和Yang 报道的OnFT(EU583502)核苷酸序列具有69.41%的相似性,氨基酸序列具有78.535 相似性。
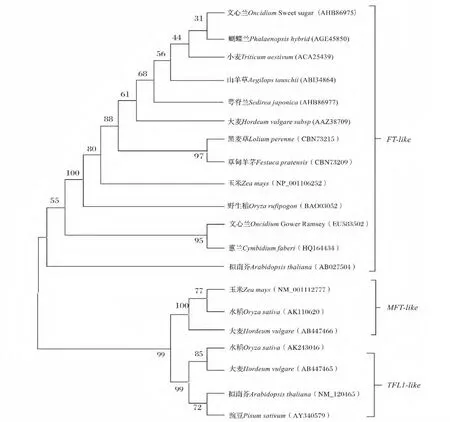
图3 OnTF-like 氨基酸的系统进化树分析Fig.3 Phylogenetic tree of OnTF-like amino acid sequences
为更好地了解OnTF-like 与其它PEBP 家族基因之间的进化关系,选取有代表性的氨基酸序列构建系统进化树(图3)。结果表明所分析的PEBP 蛋白明显分为FT-like、MFT-like 和TFL1-like 3 个亚家族。文心兰OnTF-like 氨基酸属于FT-like 亚家族基因编码,与兰科植物蝴蝶兰(Phalaenopsis hybrid)FT(AGE45850)亲缘关系最近,与双子叶植物拟南芥(Arabidopsis thaliana)的FT(AB027504)亲缘关系最远,而与文心兰(Oncidium Gower Ramsey)的另一FT 基因(EU583502)和蕙兰(Cymbidium faberi)的FT(HQ164434)关系也较远,说明PEBP 亚家族成员存在种属特异性,同时也可以看出同一物种的同一类PEBP 亚家族成员序列存在较大差异,可能与其不同的功能有关。
2.3 OnTF-like 基因的表达分析
为分析文心兰OnTF-like 基因在植株发育过程中不同组织中的表达特性,以成苗期、花蕾期、盛花期和花后期4 个时期的根、叶、花葶及盛花期的花萼、侧瓣、唇瓣和蕊柱等14 个组织的总RNA 为模板,进行实时荧光定量检测。结果见图4,可以看出文心兰OnTF-like 在所有时期的根和花器官组织中没有检测到表达,在盛花期、花后期的叶片和花葶中也没有表达,而在苗期的叶片及花蕾期的叶片和花葶中检测到表达,其中花蕾期的花葶中表达水平最高,苗期的叶片中表达水平最低。由此推测,文心兰OnTF-like 基因参与营养生长向生殖生长的转变,与开花进程有关,而与花器官发育无关。
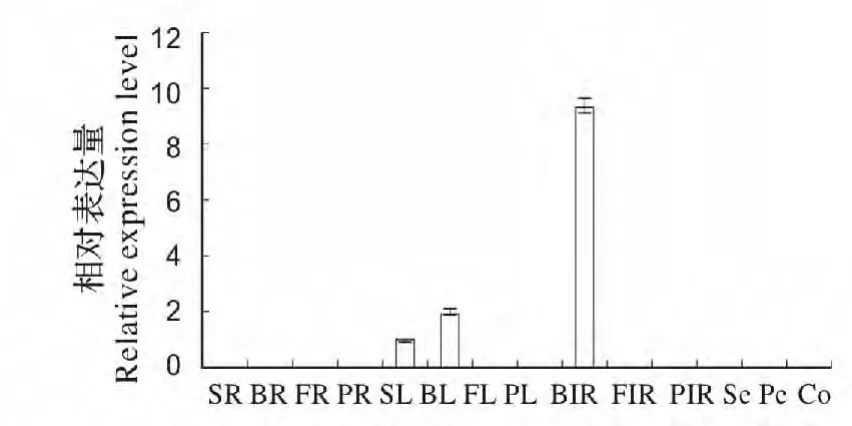
图4 OnTF-like 基因的表达特性分析Fig.4 Analysis on the expression level of OnTF-like gene
2.4 正义和反义植物表达载体的构建
利用引入限制性内切酶Bgl II 和Nhe I 的引物从插入OnFT-like 基因的pMD19-T 克隆载体上扩增ORF 目的片段(图5a),凝胶回收后再次链接pMD19-T,并转化DH5α 感受态细胞,经过筛选得到的阳性质粒pMD19-OnTF-like-S 和pMD19-OnTF-like-A。将pCAMBIA1301 质粒Bgl II 和Nhe I 酶切消化,切胶回收约9 830 bp的片段大片段(图5b),质粒pMD19-OnFT-S 和pMD19-OnFT-A 经Bgl II 和Nhe I限制性内切酶酶切消化后,切胶回收小片段(图5b)。将回收的pCAMBIA1301 载体片段与pMD19-On-FT-S 和pMD19-OnFT-A 的小片段用T4 DNA 连接酶连接,然后转入DH5α 感受态细胞。重组质粒经过Sph I 酶切鉴定(图5c)及测序验证,成功构建了正义植物表达载体1301-pMD19-OnFT-S 和反义植物表达载体1301-pMD19-OnFT-A(图6)。
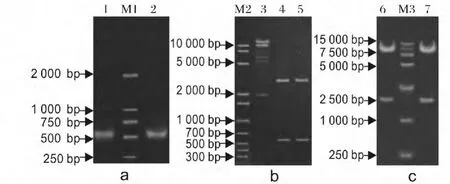
图5 OnFT-like 表达载体的构建及酶切鉴定Fig.5 Construction and restriction enzyme digestion of expression vectors of OnFT-like
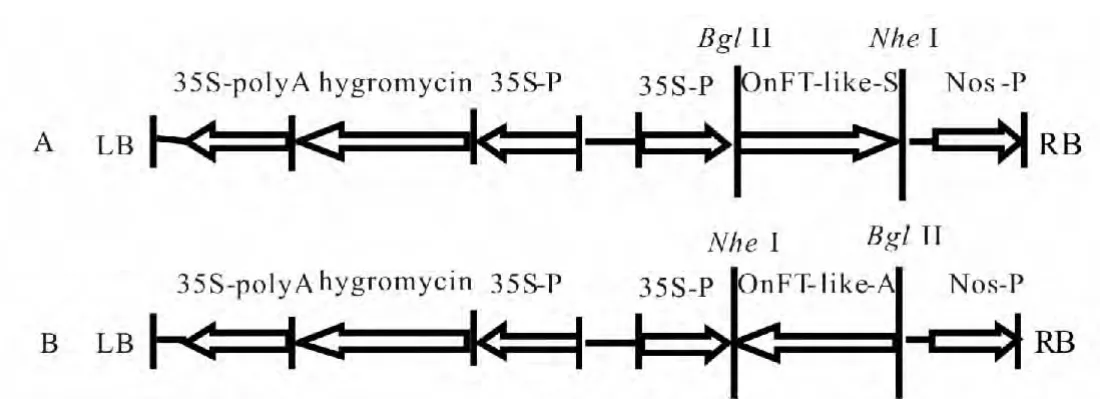
图6 植物表达载体构建示意图Fig.6 The schematic of the plant expression vector construction
3 讨论
本研究通过RT-PCR 的方法,从文心兰杂交种‘Sweet Sugar’中克隆了1 个PEBP 家族基因,该基因编码177 个 氨基酸,具有典型的PEBP 蛋白结构域,氨基酸序列比对分析表明,该基因属于FT-like 亚家族,与许多单子叶植物的FT 类基因具有90%以上的相似性,其中与蝴蝶兰、小麦、黑麦草、山羊草、萼脊兰、大麦等的FT 类基因具有99%以上的相似性;可见该基因的氨基酸序列高度保守。而该基因与曾报道的文心兰(O.Gower Ramsey)OnFT 序列差异相对较大[18],说明了文心兰PEBP 基因的FT-like 亚家族中具有多个成员,这个结果与水稻、玉米和小麦等具有多个PEBP 家族基因结果一致[10-11]。
文心兰OnFT-like 基因在根中没有表达,在成苗期的叶片中有表达,结果与OnFT 的表达分析一致。据报道,文心兰OnFT 基因除了在幼苗期的叶片和成苗期的叶片中表达外,在花蕾及部分花器官中也有表达[18],说明文心兰OnFT 基因与本研究的OnFT-like 基因功能有很大差异,也进一步说明,二者基因序列的差异不仅仅是品种的差异,更主要的是PEBP 家族及FT-like 亚家族基因功能分化的差异,但二者的研究也表明,尽管表达特性有所不同,但都与开花进程有关,说明FT-like 亚家族基因功能也具有保守性。玉米[11]、墨兰[19]、大麦[17]及挪威云杉[20]等多个研究也表明PEBP 家族成员表达特性和功能具有差异,大部分基因能够直接或间接影响开花时间和花序形态,同时其功能也受光周期的影响,而文心兰作为兰科植物,一般认为其开花主要受温度调控,与光周期的关系不大,其开花进程受哪些PEBP 基因的调控及它们在开花进程中是否也受光周期的影响是值得深入研究的课题。
本研究结果表明,文心兰OnFT-like 基因在蕾期花葶中高表达,与开花进程有关,而在盛花期和花后期的花葶中没有检测到表达,又说明不具维持开花的功能,而该基因的具体功能及其调控机制如何,有待于进一步研究。本实验室正在尝试利用正义和反义基因技术研究文心兰OnFT-like 基因的过量表达和反义RNA 干扰对植物发育的影响,最终揭示其在生殖发育中的调控作用。本研究已成功构建正义和反义植物表达载体,为进一步探讨文心兰OnFT-like 基因的功能及调控机制奠定基础,也为创造出更具观赏价值的早花品种提供技术支持。
[1]Serre L,Pereira de Jesus K,Zelwer C,et al.Crystal structures of YBHB and YBCL from Escherichia coli,two bacterial homologues to a Raf kinase inhibitor protein[J].J Mol Biol,2001,310:617-634.
[2]Chautard H,Jacquet M,Schoentgen F,et al.Tfs1p,a Member of the PEBP Family,Inhibits the Ira2p but Not the Ira1p Ras GTPase-Activating Protein in Saccharomyces cerevisiae[J].Eukaryot Cell,2004,3(2):459-470.
[3]Banfield M J,Brady R L.The structure of Antirrhinum centroradialis protein(CEN)suggests a role as a kinase regulator[J].J Mol Biol,2000,297(5):1159-1170.
[4]Banfield M J,Barker J J,Perry AC,et al.Function from structure.The crystal structure of human phosphatidylethanolaminebinding protein suggests a role in membrane signal transduction[J].Structure,1998,6:1245-1254.
[5]Simister P C,Banfield M J,Brady R L.The crystal structure of PEBP-2,a homologue of the PEBP/RKIP family[J].Acta Crystallogr D Biol Crystallogr,2002,58(Pt 6 Pt 2):1077-80.
[6]Mimida N,Goto K,Kobayashi Y,et al.Functional divergence of the TFL1-like gene family in Arabidopsis revealed by characterization of a novel homologue[J].Genes Cells,2001,6:327-336.
[7]Carmona M J,Calonje M,Martinez-Zapater J M.The FT/TFL1gene family in grapevine[J].Plant Mol Biol,2007,63:637-650.
[8]Carmel-Goren L,Liu Y S,Lifschitz E,et al.The SELFPRUNING gene family in tomato[J].Plant Mol Biol,2003,52:1215-1222.
[9]Igasaki T,Watanabe Y,Nishiguchi M,et al.The FLOWER LOCUS T/TERMINAL FLOWER 1 family in Lombardy poplar[J].Plant Cell Physiol,2008,49(3):291-300.
[10]Chardon F,Damerval C.Phylogenomic analysis of the PEBP gene family in cereals[J].J Mol Evol,2005,61:579-590.
[11]Danilevskaya O N,Meng X,Hou Z L,et al.A genomic and expression compendium of the expanded PEBP gene family from maize[J].Plant Physiol,2008,146:250-264.
[12]Pin PA,Nilsson O.The multifaceted roles of FLOWERING LOCUS T in plant development[J].Plant Cell Environ,2012,35(10):1742-1755.
[13]Xiang L,Li X,Qin D,et al.Functional analysis of FLOWERING LOCUS T orthologs from spring orchid(Cymbidium goeringii Rchb.f.)that regulates the vegetative to reproductive transition[J].Plant Physiol Biochem,2012,58:98-105.
[14]Ahn J H,Miller D,Winter V J,et al.A divergent external loop confers antagonistic activity on floral regulators FT and TFL1[J].EMBO J,2006,25(3):605-614.
[15]Imamura T,Nakatsuka T,Higuchi A,et al.The gentian orthologs of the FT/TFL1 gene family control floral initiation in Gentiana[J].Plant Cell Physiol,2011,52(6):1031-41.
[16]Hanano S,Goto K.Arabidopsis TERMINAL FLOWER1 is involved in the regulation of flowering time and inflorescence development through transcriptional repression[J].Plant Cell,2011,23(9):3172-3184.
[17]Kikuchi R,Kawahigashi H,Ando T,et al.Molecular and functional characterization of PEBP genes in barley reveal the diversification of their roles in flowering[J].Plant Physiol,2009,149(3):1341-53.
[18]Hou C J,Yang C H.Functional analysis of FT and TFL1 orthologs from orchid(Oncidium Gower Ramsey)that regulate the vegetative to reproductive transition[J].Plant Cell Physiol,2009,50(8):1544-1557.
[19]Huang W,Fang Z,Zeng S,et al.Molecular cloning and functional analysis of three FLOWERING LOCUS T(FT)Homologous Genes from Chinese Cymbidium[J].Int J Mol Sci,2012,13(9):11385-11398.
[20]Karlgren A,Gyllenstrand N,Källman T,et al.Evolution of the PEBP gene family in plants:Functional diversification in seed plant evolution[J].Plant Physiol,2011,156(4):1967-77.

