重组慢病毒沉默rictor基因对mTORC2/SGK1信号通路及肺泡上皮钠离子通道的调控作用*
钟 曦,秦 克,王导新
(重庆医科大学附属第二医院呼吸内科 400010)
·论 著·
重组慢病毒沉默rictor基因对mTORC2/SGK1信号通路及肺泡上皮钠离子通道的调控作用*
钟 曦,秦 克,王导新△
(重庆医科大学附属第二医院呼吸内科 400010)
目的构建针对mTORC2特异组成蛋白中rictor基因的重组慢病毒沉默载体,研究其对mTORC2/SGK1信号通路的调控机制及其对肺泡上皮细胞钠离子通道的影响,并探讨其在急性呼吸窘迫综合征及急性肺损伤中的作用。方法构建目的基因的rictor干扰质粒及空载质粒并与慢病毒包装体系共转染293T细胞,收集病毒上清液,经离心、浓缩及纯化获取重组慢病毒。测定病毒滴度,感染A549细胞并筛选细胞稳定株,RT-PCR验证目的基因rictor沉默情况。采用PCR和western blot检测该通路中各信号指标表达情况。结果成功构建沉默rictor基因的重组慢病毒并感染A549细胞和获得细胞稳定株。与空白组及对照组相比,shRNA-rictor组中rictor和下游SGK1、α-ENaC、β-ENaC、γ-ENaC mRNA水平均有明显下降(P<0.05)。同时,shRNA-rictor组中rictor和下游SGK1、P-SGK、α-ENaC、β-ENaC、γ-ENaC的蛋白水平较前两组均有明显下降(P<0.05)。结论沉默rictor基因对mTORC2/SGK1信号通路有明显的调控作用,同时从基因和蛋白水平影响肺泡上皮细胞α-ENaC、β-ENaC、γ-ENaC的表达。mTORC2/SGK1可能是调控肺泡上皮细胞对肺泡液的清除能力,同时影响肺水肿形成的重要信号通路。
呼吸窘迫综合征,成人;rictor基因;慢病毒属
急性肺损伤(acute lung injury,ALI)是由各种直接和间接致病因素导致的肺泡细胞及毛细血管内皮细胞损伤,而肺泡周围大量炎症因子浸润造成弥漫性肺间质及肺泡水肿,导致严重的低氧性呼吸功能不全[1]。以往在针对急性肺损伤及呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)的治疗中主要是运用抗感染、抗炎等方法,降低因肺内大量炎性渗出所导致的毛细血管内皮-肺泡上皮屏障功能障碍。部分文献报道,增加肺泡上皮细胞对肺内多余液体的清除能力,也是控制急性肺损伤的恶化及减少难治性低氧血症发生率的有效途径[2]。肺泡Ⅱ型上皮细胞与肺水清除(alveolar fluild clearance,AFC)有密切关系[3],有研究表明,阿米洛利敏感钠离子通道广泛分布于肺泡Ⅱ型上皮细胞中,也是调节肺水交换的重要效应机制[4]。SGK1作为重要的AGC激酶 (protein kinaseA,G,C)可有效调控下游钠离子通道的活化及表达[5],在肺水清除中起到重要作用。本实验研究通过构建重组慢病毒载体沉默mTORC2蛋白复合体中特异性基因rictor,从靶基因干扰方向深入研究rictor-mTORC2复合体,mTORC2/SGK1信号通路对肺上皮钠离子通道(epithelial sodium channel,ENaC)的调控机制。

表1 引物序列
1 材料与方法
1.1 材料 A549细胞购自中国科学院典型培养细胞库。shRNA-rictor,nonsilencing shRNA及慢病毒载体由上海吉凯基因化学公司提供。Trizol RNA提取试剂盒、逆转录试剂盒、PCR引物及DNA marker均由日本TaKaRa公司提供;western blot配胶试剂盒购自西安碧云天生物技术公司。RPMI1640培养基、小牛血清、0.25%胰蛋白酶均购自Gibco公司。rictor单克隆抗体,SGK1及P-SGK单克隆抗体购自美国Immunoway公司;ENa Sodium chanel 单克隆抗体购自英国Abcam公司。β-actin多克隆抗体购自美国Proteintech公司。HRP标记山羊抗兔IgG二抗购自美国Abbkine公司。
1.2 方法
1.2.1 细胞培养 将A549细胞用含有10%小牛血清的RPMI1640培养基培养,并放于37 ℃,5%CO2孵育箱中培养。待细胞融合度达90%以上,成对数生长期时,可进行后续实验。
1.2.2 shRNA-rictor慢病毒感染质粒的设计及构建 根据Genbank数据库中A549细胞rictor基因mRNA序列,经过评估及BLAST系统排除同源cDNA,设计shRNA干扰靶序列5′-AAACTTGTGAAGAATCGTATC-3′;合成shRNA对应的DNA Oligo,退火后形成双链DNA。将其与经过Age I和EcoR I两位点酶切后的GV115载体链接,将链接体转化DH5α感受态细胞,用PCR法对阳性克隆进行鉴定。PCR引物为上游:CCATGATTCCTTCATATTTGC;下游:GTAATACGGTTATCCACGCG。
1.2.3 慢病毒的包装和病毒滴度的测定 病毒包装前24 h,将293T细胞以1×105/mL的密度接种于培养皿中。按Lipofectamine 2000试剂盒说明书提示,将慢病毒质粒包装体系(Lenti-Easy Packaging Mix、GFP shRNA Plasmid及Opti-MEM)与Lipofectamine 2000转染试剂盒按比例稀释混匀并移至293T细胞培养皿中,8 h后弃转染液,用DMEM继续培养72 h后收集病毒上清液,经过滤、离心、浓缩及纯化,保存于-80 ℃冰箱。本实验采用荧光计数法进行病毒滴度测定,将293T细胞以5×103/孔的密度接种于96孔板,贴壁后,将待测病毒以10倍梯度稀释,分别加入96孔板中,96 h后在荧光显微镜下观察GFP表达情况并统计。
1.2.4 重组慢病毒感染A549细胞和筛选细胞稳定株 以密度8×104/孔接种A549细胞于6孔板中,待融合率达30%时,用重组慢病毒感染A549细胞。设空白组、阴性对照组、shRNA-rictor组,每组设计3个复孔。预实验设计感染复数MOI=20、50、100,将终浓度为5 μg/μL的Polybrene和Enhanced infection solution与相应体积的重组慢病毒悬液混匀加入6孔板。3~4 d后荧光显微镜下观察细胞感染率。继续培养感染成功的目的细胞,用嘌呤霉素筛选细胞稳定株。
1.2.5 RT-PCR检测rictor基因及SGK1、ENaC 3个亚基的mRNA表达水平 提取各组A549细胞总RNA,依据DRR047A逆转录试剂盒说明书,逆转录合成cDNA。按照RR901A 扩增试剂盒说明书建立反应体系,PCR 扩增目的和内参基因,引物序列见表1。
1.2.6 western blot检测各组细胞rictor、SGK1、P-SGK及ENaC的蛋白表达水平 提取总蛋白,用BCA检测法进行蛋白定量。各组蛋白样品经凝胶电泳(SDS-PAGE)分离,用湿转法将蛋白转移至硝酸纤维素滤膜(PVDF膜)。用PBST配制5%脱脂奶粉室温封闭1 h,分别加入抗体rictor(1∶800)、SGK1(1∶1 000)、P-SGK1(1∶500)、α-ENaC(1∶500)、β-ENaC(1∶500)、γ-ENaC(1∶500)于抗体孵育盒,4 ℃孵育过夜;PBST(或TBST)洗膜3次,每次10 min。加入HRP标记的二抗(1∶5 000),37 ℃孵育1 h;PBST(或TBST)洗膜3次,每次15 min。ECL试剂盒显色,凝胶系统成像,并用Quantity One软件系统分别分析目的条带与β-actin的比值表示rictor,SGK1,P-SGK1,ENaC的α,β,γ 3个亚基蛋白表达水平。
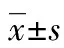
2 结 果
2.1 重组慢病毒阳性克隆的验证、滴度检测并感染目的细胞建立细胞稳定株
2.1.1 阳性克隆的PCR鉴定 将阳性克隆的寡核苷酸序列,经退火、酶切、链接等过程,用PCR法鉴定。重组慢病毒的PCR产物在139 bp,测序结果表明合成的rictor shRNA寡核苷酸序列插入正确,命名为shRNA-rictor。
2.1.2 重组慢病毒滴度检测 将包装好的病毒进行梯度稀释,再感染A549细胞,并利用荧光显微镜检测各孔板中GFP的阳性细胞数量,其shRNA-rictor组慢病毒滴度为1.2×108TU/mL,nonsilencing-shRNA组慢病毒滴度为1.0×108TU/mL。
2.1.3 重组慢病毒感染目的细胞 将包装好的慢病毒感染A549细胞,96 h后荧光显微镜下计数有GFP表达的细胞数量及细胞总数,统计后shRNA-rictor组感染效率约60%,nonsilencing-shRNA组感染效率50%,确定阳性组最佳感染复数MOI为50 TU/mL,表明感染成功(图1)。
2.1.4 嘌呤霉素筛选目的细胞并建立细胞稳定株 将慢病毒感染过的细胞用不同浓度梯度的嘌呤霉素筛选,经预实验后发现0.5 μg/mL是最佳筛选浓度,继续培养细胞并获得纯化的目的细胞,转染效率达90%以上(图2)。
2.1.5 目的细胞中rictor基因mRNA水平的验证及检测 提取各组总RNA,RT-PCR检测显示,相比空白组和阴性对照组,shRNA-rictor组中rictor mRNA表达明显低于前两组(P=0.029)。而空白组与nonsilencing-shRNA比较,rictor mRNA无明显差异(P>0.05),见图3。

A、B:空载组;C、D:shRNA-ricton组。
图1 shRNA-rictor慢病毒载体及空载组感染A549细胞后荧光显微镜下GFP表达情况(200×)

M=marker;*:P<0.05,与对照组比较。
图3 RT-PCR检测各组rictor基因的mRNA表达水平
2.2 RT-PCR法检测检测SGK1,α-ENaC,β-ENaC,γ-ENaC mRNA表达水平 shRNA-rictor组中SGK1 mRNA的表达水平也明显低于空白组及阴性对照组(P=0.026,0.003,0.000,0.003,P<0.05)。以上结论成功证实运用重组慢病毒载体感染A549细胞系进行对目的基因rictor的调控有效,并同时调控下游信号因子SGK1、α-ENaC、β-ENaC、γ-ENaC mRNA表达水平(图4、图5)。

M=DNA Marker;*:P<0.05,与对照组比较。
图4 RT-PCR检测各组A549细胞SGK1的mRNA表达水平
2.3 western blot法检测各组细胞中rictor,SGK1,P-SGK的蛋白表达水平 shRNA-rictor组中rictor,SGK1,P-SGK的蛋白表达水平明显低于空白组及阴性对照组(P=0.002,0.000,0.012;P<0.05)。而空白组与阴性对照组之间各目的蛋白表达水平无明显差异(P>0.05),见图6。
2.4 western blot法检测各组细胞中钠离子通道3个亚基α-ENaC,β-ENaC及γ-ENaC的蛋白表达水平 shRNA-rictor组中的α-ENaC,β-ENaC及γ-ENaC蛋白表达水平明显低于空白组及阴性对照组(P=0.002,0.000,0.001,P<0.05)。而空白组与阴性对照组之间各目的蛋白表达水平无明显差异(P>0.05),见图7。

M=DNA Marker;*:P<0.05与对照组比较;**:P>0.05与空白组比较。
图5 RT-PCR检测各组A549细胞α-ENaC,β-ENaC及γ-ENaC的mRNA表达水平

*:P<0.05,与对照组比较;**:P>0.05,与空白组比较。
图6 western blot法检测各组A549细胞rictor,SGK1,P-SGK的蛋白表达水平

*:P<0.05与对照组比较;**:P>0.05与空白组比较。
图7 western blot法检测各组A549细胞α-ENaC, β-ENaC及γ-ENaC的蛋白表达水平
3 讨 论
急性肺损伤的严重阶段是急性呼吸窘迫综合征,以肺泡毛细血管内皮细胞和肺泡上皮细胞损伤为主要临床表现的综合征,导致严重的肺水肿,肺通气功能障碍,顽固性低氧血症等[6-7]。慢性阻塞性肺疾病恶化的主要原因是肺内大量中性粒细胞、白细胞介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)等炎症介质的浸润及肺水清除能力障碍。所以临床治疗上,通过抗感染、抗炎、利尿等治疗的同时,采用其他可能的途径提高肺水清除能力,维持毛细血管内皮-肺泡上皮屏障的稳定平衡是改善低氧血症,重度肺源性心脏病,及降低ALI/ARDS死亡率的另一种手段。
雷帕霉素靶蛋白(mTOR)是一种丝氨酸/苏氨酸蛋白激酶,以mTORC1及mTORC2两种形式存在于生物体中。mTORCl由mTOR、PRAS40、Raptor和mLST8/GpL组成。mTORC2包括mTOR、PRR5、mLST8/GpL、rictor和mSINl。不同于其它亚基,rictor是mTORC2中的特异性组成部分。据文献证实,rictor与culin-1 链接组成E3泛素连接酶,可增加下游SGK1的泛素化,同时SGK1可反作用于rictor磷酸化位点T1135[8-9]。因此,rictor-mTORC2复合体与SGK1之间存在紧密的双向调控机制。本实验通过沉默rictor基因后,发现SGK 磷酸化位点Ser422明显下调,证明SGK1是受PI3K/mTORC2通路的调控。这一结果和国际上的观点是保持一致的。
有国内外文献报道,参与调节肺泡内液体转运主要是通过ENaC,Na+-K+-ATPase,水通道蛋白(AQP)等方式实现[10]。其中ENaC离子通道是一种跨膜蛋白,其属于阿米洛利敏感性电压门控通道。主要位于肺泡上皮细胞顶侧膜,由α、β、γ 3种亚基构成的多聚体。而α亚基发挥了最主要的生物学功能,负责钠离子的重吸收利用,及调节细胞内外环境。在通过敲除α-ENaC基因的小鼠实验中发现,多数实验组在40 h后死于急性肺水肿引起的呼吸衰竭[11]。一方面,ENaC在位于上皮细胞基底膜的Na+-K+-ATPase帮助下参与水跨膜转运和肺水清除[12]。另一方面,国际上大部分相关研究表明,ENaC的活性是受到SGK1下游nedd4信号因子的直接调控。而对于nedd4如何调控ENaC的内部机制的讨论尚不统一,有部分文献证明,mTORC2/SGK1信号通路可激活下游nedd4-2的WWP2磷酸化位点,以降低nedd4家族中E3泛素连接酶对ENaC的负向调控[13-14]。因此,可推测SGK1与nedd4-2可能是通过磷酸化和泛素化的协同作用调控ENaC活性。本团队也将在以后的研究中对这一机制做更深入的探讨。
本课题组前期通过大量体内,体外研究已证明,采用mTORC1的抑制剂雷帕霉素干预时,检测钠离子通道蛋白表达无明显改变,而采用mTORC1及mTORC2双效抑制剂PP242干预时,钠离子蛋白表达有明显下降。同时,组织学检测提示肺组织水肿情况加重。而利用糖皮质激素、胰岛素、表皮生长因子等药物调控PI3k/mTOR/SGK1信号通路,可明显上调钠离子通道对肺泡液的转运能力[15-16]。以上结果提示,PI3K/mTORC2/SGK1信号通路是调控ENaC的主要途径。而慢病毒是一种以HIV病毒为基础发展而来的免疫缺陷性逆转录病毒。相比早期的脂质体,质粒等转染载体,它具有稳定性,高敏感性,易感性等优势[17-18]。近年重组慢病毒shRNA技术被广泛应用于内源性基因分析,信号转导通路研究。本实验通过设计目的基因rictor干扰序列,构建shRNA质粒及重组慢病毒载体,并成功感染目的细胞建立稳定株,沉默mTORC2中特异性基因rictor,从基因层面准确证明mTORC2/SGK1是调控ENaC离子通道的高特异性信号通路,同时进一步深入探讨了rictor-mTORC2蛋白复合体对钠离子通道的内部调控机制。从分子生物学的角度,有效的证明mTORC2/SGK1信号通路是调节钠通道的关键。并推断此信号通路可能是影响肺水清除的有效途径。此实验结论为提高肺水清除能力,纠正急性肺水肿的临床研究提供了部分理论基础,同时也为拓展ALI和ARDS临床治疗方向提供了一定的理论思路。
[1]Li H,Qiang Y,Wang L,et al.Repair of lipopolysaccharide-induced acute lung injury in mice by endothelial progenitor cells,alone and in combination with simvastatin[J].Chest,2013,144(3):876-886.
[2]Wang Q,Lian QQ,Li R,et al.Lipoxin A(4) activates alveolar epithelial sodium channel,Na,K-ATPase,and increases alveolar fluid clearance[J].Am J Respir Cell Mol Biol,2013,48(5):610-618.
[3]Planes C,Randrianarison NH,Charles RP,et al.ENaC-mediated alveolar fluid clearance and lung fluid balance depend on the channel-activating protease 1[J].EMBO Mol Med,2010,2(1):26-37.
[4]Kellenberger S,Hoffmann-Pochon N,Gautschi I,et al.On the molecular basis of ion permeation in the epithelial Na+channel[J].J Gen Physiol,1999,114(1):13-30.
[5]Pao AC.SGK regulation of renal sodium transport[J].Curr Opin Nephrol Hypertens,2012,21(5):534-540.
[6]Orfanos SE,Mavrommati I,Korovesi I,et al.Pulmonary endothelium in acute lung injury:from basic science to the critically ill[J].Intensive Care Med,2004,30(9):1702-1714.
[7]Rafat N,Dacho C,Kowanetz G,et al.Bone marrow-derived progenitor cells attenuate inflammation in lipopolysaccharide-induced acute respiratory distress syndrome[J].BMC Res Notes,2014(7):613.
[8]Dibble CC,Asara JM,Manning BD.Characterization of Rictor phosphorylation sites reveals direct regulation of mTOR complex 2 by S6K1[J].Mol Cell Biol,2009(29):5657-5670.
[9]Gao D,Wan L,Inuzuka H,et al.Rictor forms a complex with Cullin-1 to promote SGK1 ubiquitination and destruction[J].Mol Cell,2010,39(21):797-808.
[10]Sartori C,Matthay MA.Alveolar epithelial fluid transport in acute lung injury:new insights[J].Eur Respir J,2002,20(5):1299-1313.
[11]Hummler E,Barker P,Gatzy J,et al.Early death due to defective neonatal lung liquid clearance in alpha-ENaC-deficient mice[J].Nat Genet,1996,12(3):325-328.
[12]Zecevic M,Heitzmann D,Camargo SM,et al.SGK1 increases Na,K-ATP cell-surface expression and function in Xenopus laevis oocytes[J].Pflugers Arch,2004,448(1):29-35.
[13]Wiemuth D,Lott JS,Ly K,et al.Interaction of serum-and glucocorticoid regulated kinase 1 (SGK1) with the WW-domains of Nedd4-2 is required for epithelial sodium channel regulation[J].PLoS One,2010,5(8):12163.
[14]Snyder PM,Steines JC,Olson DR.Relative contribution of Nedd4 and Nedd4-2 to ENaC regulation in epithelia determined by RNA interference[J].J Biol Chem,2004,279(6):5042-5046.
[15]Deng J,Wang DX,Deng W,et al.Regulation of alveolar fluid clearance and ENaC expression in lung by exogenous angiotensin Ⅱ[J].Respir Physiol Neurobiol,2012,181(1):52-61.
[16]He J,Qi D,Wang DX,et al.Insulin upregulates the expression of epithelial sodium channel in vitro and in a mouse model of acute lung injury:Role of mTORC2/SGK1 pathway[J].Exp Cell Res,2015,31(1):164-175.
[17]Aoki Y,Cioca DP,Oidaira H,et al.RNA interference may be more potent than antisense RNA in human cancer cell lines[J].Clin Exp Pharmacol Physiol,2003,30(1):96-102.
[18]Wiznerowicz M,Trono D.Conditional suppression of cellular genes:lentivirus vector-mediated drug-inducible RNA interference[J].J Virol,2003,77(16):8957-8961.
Regulating effect of recombinant lentivirus silencing rictor gene on mTORC2/SGK1 signal pathway and pulmonary alveolar epithelial sodium ion channel*
ZhongXi,QinKe,WangDaoxin△
(DepartmentofRespiratoryMedicine,SecondAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400010,China)
ObjectiveTo construct recombinant lentivirus silence vector aiming at rictor gene in mTORC2 specific protein,and to investigate its regulation on mTORC2/SGK1 signal pathway and the effect on pulmonary alveolar epithelial sodium ion channel,as well as the role in acute respiratory distress syndrome(ARDS) and acute lung injury.MethodsThe interfering vector plasmid and empty vector plasmid of target gene rictor were constructed,which and the lentivirus packaging system were co-transfected to 293T cells.The viral supernatant was collected,centrifuged,concentrated and purified for obtaining recombinant lentivirus.The virus titer was detected and the virus was infected to A549 cells.Stable cell lines were screened.RT-PCR was used to confirm the silencing situation of target gene rictor.The expression situation of various signal indexes in this pathway was detected by PCR and Western blot.ResultsThe recombinant lentivirus of silence gene rictor was successfully constructed and transfected to A549 cell for obtaining stable cell lines.Compared with blank and control groups,the mRNA levels of rictor,downstream SGK1 and α-,β-and γ-ENaC in the shRNA-rictor group were significantly decreased (P<0.05).Meanwhile,the protein levels of rictor,downstream SGK1,P-SGK and α-,β-and γ-ENaC in the shRNA-rictor group were significantly decreased compared with the other two groups(P<0.05).ConclusionSilence rictor gene has the obvious regulation effect on mTORC2/SGK1 signal pathway,meanwhile affects the expression of pulmonary alveolar epithelial cellular α-,β-and γ-ENaC at gene and protein level.It is speculated that mTORC2/SGK1 may be an important signal pathway for regulating the clearance capacity of pulmonary alveolar epithelial cells on pulmonary alveolar fluid and simultaneously affecting the pulmonary edema formation.
respiratory distress syndrome,adult;rictor gene;lentivirus
10.3969/j.issn.1671-8348.2015.26.001
国家自然科学基金资助项目(81270141)
:钟曦(1984-),硕士,主治医师,主要从事呼吸危重症临床及基础研究。△
,E-mail:weanger2008@163.com。
R563.8
A
1671-8348(2015)26-3601-04
2015-04-08
2015-06-01)

