杠柳新苷T作用东方粘虫幼虫中肠细胞的免疫定位研究
左佳妮,孙文聪,冯明星,胡兆农,吴文君
(西北农林科技大学 农药研究所,陕西 杨凌 712100)
杠柳新苷T作用东方粘虫幼虫中肠细胞的免疫定位研究
左佳妮,孙文聪,冯明星,胡兆农,吴文君
(西北农林科技大学 农药研究所,陕西 杨凌 712100)
【目的】 明确杠柳新苷T作用后在东方粘虫幼虫中肠肠壁细胞中的分布,探讨其杀虫作用机制。【方法】 鉴于杠柳新苷T对东方粘虫幼虫具有明显的胃毒活性,而对小地老虎幼虫无杀虫活性,采用胶体金免疫电镜技术,比较观察了杠柳新苷T处理的东方粘虫幼虫和小地老虎幼虫中肠肠壁细胞的变化。【结果】 东方粘虫幼虫经杠柳新苷T处理后,胶体金颗粒首先出现在微绒毛上,且密度随着处理时间延长而逐渐增大,最终破坏微绒毛;同时,胶体金颗粒在细胞内的细胞器膜上也有出现,并损伤细胞器。小地老虎幼虫经杠柳新苷T处理后,中肠肠壁细胞及细胞器均没有明显变化,其上也没有发现胶体金颗粒的存在。【结论】 杠柳新苷T对东方粘虫幼虫和小地老虎幼虫的选择性与其在2种试虫中肠肠壁细胞上的特异性结合存在显著差异有关,杠柳新苷T作用东方粘虫幼虫后的初始结合部位可能是其中肠肠壁细胞,推测杠柳新苷T的靶蛋白可能存在于中肠肠壁细胞膜及细胞器膜上。
杠柳新苷T;东方粘虫;小地老虎;中肠肠壁细胞;免疫定位
近年来,化学农药大量使用导致的农药毒害和生态环境持续破坏已经引起全世界关注[1],因此创制安全高效的“生物合理农药”(biorational pesticides)或“环境相容性农药”(environment compatible pesticides),是符合科学发展观的必由之路[2]。天然产物往往由于其结构新颖、活性独特以及对环境安全等一系列优点,成为当今世界新农药创制的重要途径,具有广泛的应用前景[3],如市面上已经存在的印楝素、杀虫剂Bt、核型多角体病毒(NPV)及抗菌素等[4]。
国内外已系统研究了杠柳(PeriplocasepiumBunge)的化学成分及其药理学特性[5]。但在农用活性方面国内仅有杠柳相关粗提物活性的报道,如杠柳根皮的粗提液对小菜蛾幼虫的活性主要表现为胃毒和拒食,而对菜青虫幼虫仅表现为拒食活性[6-7];杠柳根皮的正丁醇粗提液对粘虫幼虫及麦二叉蚜具有毒杀作用[8]。
西北农林科技大学农药研究所近10多年来对杠柳根皮的杀虫活性成分及其致毒机理进行了比较系统的研究,分离得到一系列具有杀虫活性的杠柳新苷类化合物[9-10];该类化合物对小菜蛾、粘虫和菜青虫的幼虫均表现为较强的胃毒作用,但对小地老虎无任何活性[11-12]。之后以对该类化合物不敏感的小地老虎幼虫作为对照,研究了杠柳毒素对敏感的东方粘虫幼虫中肠肠壁细胞的影响,推测昆虫中肠可能是其作用部位[13],推断该类化合物可能为一类新型的“昆虫消化毒剂”。据此,以高杀虫活性的化合物杠柳新苷T为抗原制备了其多克隆抗体[14]。
本研究利用胶体金免疫定位技术,以杠柳毒素T处理的小地老虎幼虫中肠肠壁细胞为对照,对杠柳毒素T在东方粘虫幼虫中肠肠壁细胞内的分布进行免疫定位,旨在为进一步阐明杠柳毒素T对东方粘虫幼虫的作用机制奠定基础。
1 材料与方法
1.1 试验动物
小地老虎(Agrotisypsilon)、东方粘虫(Mythimnaseparata)均由本实验室养虫室提供,室内人工饲养多代,挑选6龄粘虫饥饿24 h后供试。
1.2 供试药剂及主要仪器
杠柳新苷T(纯度大于95%),由本实验室提供,用丙酮将其配成10 mg/mL供试。
LKBU型超薄切片机及JEM-22000EX 透射电子显微镜。
1.3 处理方法
以载毒叶碟法饲喂试虫:在小麦叶片(0.5 cm×0.5 cm)上涂布1 μL 10 mg/mL供试药剂,待溶剂挥发干后,将试虫与叶片一起放入培养皿中,处理后5,8,10 h取样,对照组试虫以涂布1 μL丙酮的小麦叶片进行相同处理。
1.4 抗 体
一抗:鼠抗杠柳新苷T的多克隆抗体,由西北农林科技大学农药研究所提供[14],其稀释倍数为1∶10。
二抗:15 nm胶体金标记羊抗鼠IgG,购自TED PELLA公司,其稀释倍数为1∶20。
1.5 样品制备及染色方法
(1)将对照及处理5,8,10 h后的试虫,冰浴中迅速解剖中肠,用生理盐水清洗除掉残渣;(2)前固定用40 mL/L戊二醛,沉底后清洗用2.5%戊二醛;洗净锇酸,避光固定30~40 min,此步试验在4 ℃下进行;(3)清除残留固定液:0.1 mol/L的磷酸盐缓冲液(PBS)冲3次,5 min/次;(4)清除残留PBS,1%的锇酸固定40~50 min;(5)清除固定液:0.1 mol/L PBS冲3次,10 min/次;(6)梯度脱水:体积分数30%,50%,70%,80%,90%(2次)及100%(3次)丙酮,10 min/次;(7)脱水后,用1∶1的渗透液(纯Epon812环氧树脂包埋剂与100%丙酮)渗透2 h;接着2∶1的渗透液(纯包埋剂与100% 丙酮)渗透2 h;最后在纯包埋剂中轻微摇动过夜;(8)渗透后,将其定向包埋在包埋模具中,在37 ℃、45 ℃和60 ℃的温箱中分别聚合16 h、24 h和48 h;(9)用超薄切片机切片,并放于镍网上;(10)将镍网切片进行1 h封闭(1%明胶及1%BSA);(11)将其孵育在第一抗体上(1∶10,一抗稀释液稀释),在室温下孵育2 h;(12)3次BSA洗涤,2次PBS洗涤(10 min/次);(13)孵育1 h:切片与稀释的胶体金标记的羊抗鼠二抗(用PBS 1∶20稀释);(14)3次二抗稀释液清洗,10 min/次;(15)2次双蒸水清洗,10 min/次,晾干;(16)染色8 min(醋酸双氧铀);(17)染色5 min(柠檬酸铅);(18)用透射电镜观察并拍照。 对照组处理方法:第11步用1% BSA替换一抗与镍网切片进行孵育;其他步骤同处理组。对照组和处理组在相同批次下进行。
2 结果与分析
2.1 杠柳新苷T作用东方粘虫的免疫定位
杠柳新苷T处理东方粘虫5 h后,在微绒毛上分布着极少量的胶体金颗粒,中肠细胞内细胞质密度下降和内质网扩张;处理后8 h,微绒毛上胶体金颗粒的数量增多,细胞内部也可看到少量胶体金颗粒的分布,中肠肠壁细胞可见到线粒体肿胀,个别线粒体的内脊和双层膜变得模糊;处理后10 h,大量的胶体金颗粒出现在细胞的微绒毛上及细胞内部,大部分细胞器也受到严重损伤。从处理时间来看,随着处理时间的延长,胶体金颗粒出现得越来越多,范围也越来越广,并且大部分存在于粘虫中肠肠壁细胞膜上。而对照组粘虫幼虫的中肠细胞膜系统上及细胞内部均没有发现胶体金颗粒,中肠细胞也没有明显的病变(图1)。
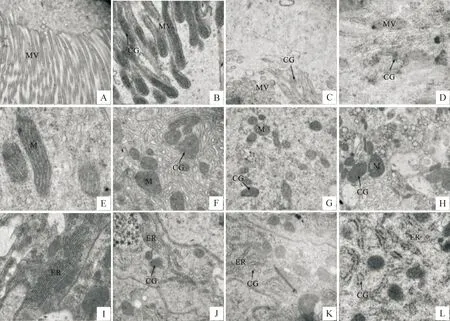
图1 杠柳新苷T对东方粘虫中肠肠壁细胞超微结构的影响A.对照微绒毛(10 000×);B.处理5 h微绒毛(40 000×);C.处理8 h微绒毛(40 000×);D.处理10 h微绒毛(40 000×);E.对照线粒体(80 000×); F.处理5 h线粒体(40 000×);G.处理8 h线粒体(40 000×);H.处理10 h线粒体(40 000×);I.对照内质网(40 000×);J.处理5 h内质网(40 000×);K.处理8 h内质网(40 000×);L.处理10 h内质网(40 000×);MV.微绒毛;M.线粒体;ER.内质网;CG.胶体金颗粒
2.2 杠柳新苷T作用小地老虎的免疫定位
经杠柳新苷T处理5,8,10 h后,小地老虎幼虫的中肠细胞处理组和对照组均没有发现胶体金颗粒的存在,中肠肠壁细胞及细胞器均无明显病变(图2)。结果说明,小地老虎幼虫中肠肠壁细胞上没有结合杠柳新苷T。

图2 杠柳新苷T对东方小地老虎中肠肠壁细胞超微结构的影响 A.对照微绒毛(10 000×);B.处理5 h微绒毛(40 000×);C.处理8 h微绒毛(40 000×);D.处理10 h微绒毛(40 000×);E.对照线粒体(80 000×);F.处理5 h线粒体(40 000×);G.处理8 h线粒体(40 000×);H.处理10 h线粒体(40 000×);I.对照内质网(40 000×);J.处理5 h内质网(40 000×);K.处理8 h内质网(40 000×);L.处理10 h内质网(40 000×);MV.微绒毛;M.线粒体;ER.内质网;CG.胶体金颗粒
3 讨 论
免疫胶体金技术(IGG)具有灵敏度高和分辨力强等优点[15]。本研究首先利用杠柳毒素T的多克隆抗体及其蛋白容易标记的特性对杠柳新苷T进行了间接性的标记,同时,采用IGG方法与杠柳毒素T进行了体内结合,结果表明杠柳新苷T主要在粘虫幼虫中肠肠壁细胞膜系统(细胞膜和细胞器膜)上有结合;另外,对细胞的结构本身也造成了相当大的损伤。此前杠柳毒素NW对粘虫中肠作用的超微结构和荧光定位研究表明,杠柳毒素NW对粘虫中肠细胞膜及其细胞器膜的破坏是其主要的致毒机制,并推断昆虫中肠肠壁细胞膜可能是杠柳毒素NW的结合位点[13]。本研究在初步证实上述推测的可靠性以外,还进一步明确了杠柳毒素能够与东方粘虫中肠肠壁细胞的细胞膜及细胞器膜结合,这些膜系统上可能存在其结合的特异性蛋白。
免疫电镜组织定位技术在研究中最常用的方法有2种,一是采用不同大小的胶体金颗粒作标记的包埋后双重标记法;另一种是包埋前免疫电镜染色法与包埋后胶体金标记法相结合的双重标记法[16-17]。本研究借鉴了苦皮藤素V免疫电镜组织定位中采用的方法[18],结果表明杠柳新苷T在细胞内部也可以结合,分析可能原因为,一是杠柳毒素T与粘虫中肠细胞膜上的结合蛋白可以特异结合,通过特殊的离子通道进入到细胞的内部;二是杠柳新苷T与粘虫中肠细胞膜上的结合蛋白结合后,直接导致中肠细胞膜破裂,打破了中肠内外的离子平衡。但是,具体的作用机制目前还不清楚。
“消化毒剂”的概念自1997年提出[19]后,已经有不少关于消化毒剂的报道,消化毒剂的致毒机理最可能是,其对试虫中肠细胞膜和内膜系统具有破坏作用。采用免疫电镜组织定位技术发现,苦皮藤素V在中毒粘虫的中肠上皮细胞上有结合[18],动物源杀虫活性物质斑蝥素对粘虫消化系统起作用主要是导致了粘虫中肠细胞膜和内膜系统的破坏[20]。本研究结果表明,杠柳毒素的作用位点位于试虫中肠细胞膜及其内膜系统上。尽管这些研究表明,消化毒剂的作用位点位于试虫中肠细胞膜及其内膜系统上,但是它们与中肠细胞膜特异性结合以及其与膜的结合位点仍不清楚,因此,对于杠柳毒素T在膜上的结合位点或者其在试虫中肠上的作用靶标仍待进一步研究。
4 结 论
杠柳新苷T对东方粘虫幼虫和小地老虎幼虫的选择性与其在2种试虫中肠肠壁细胞上的特异性结合存在显著差异有关,杠柳新苷T作用东方粘虫幼虫后的初始结合部位可能是其中肠肠壁细胞,推测杠柳新苷T的靶蛋白可能存在于中肠肠壁细胞膜及细胞器膜上。
[1] 张巨勇.化学农药的危害及我国应采取的对策 [J].云南环境科学,2004,23(2):23-26.
Zhang J Y.Hazard of chemical pesticide and countermeasures [J].Yunan Environmental Science,2004,23(2):23-26.(in Chinese)
[2] Matthews G A.Pesticides:Health,safety and the environment [M].London:Blackwell Publishing Ltd.,2006.
[3] Dubey N K,Shukla R,Kumar A,et al.Prospects of botanical pesticides in sustainable agriculture [J].Current Science,2010,98(4):479-480.
[4] 陈明华.生物源农药简介 [J].化学教育,2010(2):10-12.
Chen M H.Brief introduction of biological pesticides [J].Journal of Chemical Education,2010(2):10-12.(in Chinese)
[5] Chu S S,Jiang G H,Liu W L,et al.Insecticidal activity of the root bark essential oil ofPeriplocasepiumBunge and its main component [J].Natural Product Research,2012,26(10):926-932.
[6] 朱九生,乔雄梧,王 静,等.杠柳的不同溶剂提取分离物对小菜蛾幼虫的拒食和毒杀作用 [J].农药学学报,2004,6(2):48-52.
Zhu J S,Qiao X W,Wang J,et al.Study on antifeedant and insecticidal activities of extracts and fractions fromPeriplocasepiumBunge againstPlutellaxylostella(L.) [J].Chinese Journal of Pesticide Science,2004,6(2):48-52.(in Chinese)
[7] 朱九生,乔雄梧,王 静,等.杠柳根皮乙醇粗提物对菜青虫的拒食作用及其防治效果 [J].昆虫知识,2004,41(6):548-552.
Zhu J S,Qiao X W,Wang J,et al.Antifeedant effect and control efficacy of ethanol crude extracts from the root bark ofPeriplocasepiumagainst imported cabbage worm,Pierisrapae[J].Entomological Knowledge,2004,41(6):548-552.(in Chinese)
[8] 史清华,马养民,秦虎强.杠柳根皮挥发油化学成分及对麦二叉蚜的毒杀活性初探 [J].西北植物学报,2006,26(3):620-623.
Shi Q H,Ma Y M,Qin H Q.Chemical components and insecticidal activity of essential oil inPeriplocasepiumroot bark toSchizaphisgraminum[J].Acta Botanica Boreali-Occidentalia Sinica,2006,26(3):620-623.(in Chinese)
Li Y,Zhang J W,Yang H,et al.Studies on insecticidal constituents fromPeriplocasepiumBunge [J].Acta Agriculturae Boreali-Occidentalia Sinica,2006,15(5):90-94.(in Chinese)
Li Y,Bai X M,Yang H.Preliminay study on the insecticidal activity of periplocosides A [J].Acta Agriculturae Boreali-Occidentalia Sinica,2007,16(4):239-240.(in Chinese)
[11] 赵彦超,师宝君,胡兆农.杠柳毒素NW的杀虫活性 [J].昆虫知识,2008,45(6):950-952.
Zhao Y C,Shi B J,Hu Z N.The insecticidal activity of periplocoside NW [J].Entomological Knowledge,2008,45(6):950-952.(in Chinese)
[12] 何 玲,赵 娟,师宝君,等.杠柳杀虫组分F3-28对东方粘虫和小地老虎幼虫中肠消化酶活性的影响 [J].昆虫学报,2010,53(11):1248-1255.
He L,Zhao J,Shi B J,et al.Effects of insecticidal fraction F3-28 fromPeriplocasepiumon the activities of digestive enzymes in the midgut of larvae ofMythimnaseparataandAgrotisypsilon(Lepidoptera:Noctuidae) [J].Acta Entomologica Sinica,2010,53(11):1248-1255.(in Chinese)
[13] 赵 娟.杠柳毒素NW的分离及对东方粘虫和小地老虎幼虫中肠组织的影响 [D].陕西杨凌:西北农林科技大学,2010.
Zhao J.Studies on the separation,ultrastructure effect onMythimnaseparataandAgrotisypsilonof periplocoside NW [D].Yangling,Shaanxi:Northwest A&F University,2010.(in Chinese)[14] 高履桐.杠柳新苷T的分离及多克隆杭体的制备 [D].陕西杨凌:西北农林科技大学,2012.
Gao L T.Separation and preparation of polyclonal antibody of periplocoside T [D].Yangling,Shaanxi:Northwest A&F University,2012.(in Chinese)
[15] Hayat M A.Colloidal gold:Principles,methods,and applications [M].San Diego:Academic Press Inc.,2012.
[16] Thaxton C S,Georganopoulou D G,Mirkin C A.Gold nanoparticle probes for the detection of nucleic acid targets [J].Clinica Chimica Acta,2006,363(1):120-126.
[17] 王海芳,夏本秀一,安部静子,等.痕量元素与DNA体内和体外结合的多种示踪法研究 [J].核化学与放射化学,1999,21(2):124-127.
Wang H F,Shuichi E,Shizuko A,et al.Multitracer study oninvivoandinvitrobinding of trace elements with mouse liver DNA [J].Journal of Nuclear and Radiochemistry,1999,21(2):124-127.(in Chinese)
[18] 祁志军.苦皮藤素V受体的免疫定位及东方粘虫中肠cDNA文库构建 [D].陕西杨凌:西北农林科技大学,2007.
Qi Z J.Immunolocalization of the Celangulin V receptor and the construction of cDNA library of the midgut ofOrientalarmyworm,MythimnasepatataWalker (Lepidoptera:Notuidae) [D].Yangling,Shaanxi:Northwest A&F University,2007.(in Chinese)
[19] 吴文君,姬志勤,胡兆农.天然产物与消化毒剂 [J].农药,1997,36(6):6-9.
Wu W J,Ji Z Q,Hu Z N.Natural products and digestive poison [J].Pesticides,1997,36(6):6-9.(in Chinese)
[20] 张雅林,周 越,张志勇.斑蝥素对粘虫和小菜蛾幼虫中肠组织的影响 [J].昆虫学报,2003,46(3):272-276.
Zhang Y L,Zhou Y,Zhang Z Y.Effect of cantharidin on the midgut of the orient armyworm (Mythimnaseparata) and diamondback moth (Plutellaxylostella) [J].Acta Entomologica Sinica,2003,46(3):272-276.(in Chinese)
Immunolocalization of periplocoside T fromPeriplocasepiumBunge in larvae midgut of oriental amyworm,MythimnaseparataWalker (Lepidoptera:Noctuidae)
ZUO Jia-ni,SUN Wen-cong,FENG Ming-xing,HU Zhao-nong,WU Wen-jun
(PesticideResearchInstitute,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
【Objective】 The objective of this research was to figure out the distribution of periplocoside T (PST) in midgut cell ofMythimnaseparatalarvae after treatment by PST and explore its action mechanism.【Method】 Since PST has stomach toxicity toM.separatalarvae while has no activity toAgrotisypsilonlarvae,the changes of midgut wall cells of these two insects after treatment with PST were observed comparatively using immune-electron microscopy (TEM).【Result】 After treatment with PST,gold particles appeared on the microvilli layer of the midgut ofM.separatalarvae firstly.The density of gold particles gradually increased and destructed microvilli layer severely at last.Meantime,gold particles also appeared on the intracellular organelles membrane and the organelles were also destructed.For the control ofA.ypsilonlarvae,there was no effect and no gold particle appeared.【Conclusion】 The selectivity of PST to these insects was related to the significant difference of its special binding with these two insects.The midgut intestinal wall cells may be the original binding site of PST.It was speculated that the target protein of PST may exist on cell membranes and organelles membranes.
periplocoside T (PST);Mythimnaseparata;Agrotisypsilon;midgut cells;immuno-localization
时间:2015-10-13 08:46
10.13207/j.cnki.jnwafu.2015.11.017
2014-03-28
国家自然科学基金项目(31171868);国家公益性行业(农业)科研专项(200903052)
左佳妮(1990-),女,甘肃庆阳人,硕士,主要从事昆虫毒理学研究。E-mail:zoey@nwsuaf.edu.cn
胡兆农(1970-),男,甘肃临夏人,教授,博士生导师,主要从事天然产物农药和昆虫毒理学研究。 E-mail:huzhaonong@nwsuaf.edu.cn
S432.2
A
1671-9387(2015)11-0118-05
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20151013.0846.034.html

