稻绿核菌胞外多糖抗氧化活性和培养基优化
吕仕琼,于瑞婷,董雪娇,林锋科,徐 丹,岳 阳,赖道万,周立刚
中国农业大学农学与生物技术学院,北京 100193
稻曲病(Rice false smut)是危害水稻穗部的真菌病害,其病原为稻绿核菌(有性态:Villosiclava virens;无性态:Ustilaginoidea virens),稻曲病会严重影响水稻的产量和品质[1,2]。稻绿核菌能产生稻曲菌素(Ustiloxins)和稻绿核菌素(Ustilaginoidins)等次生代谢产物,具有多种生物活性和应用开发潜力。稻曲菌素为环肽类化合物,主要表现为细胞毒和抗肿瘤活性[3-5]。稻绿核菌素为二萘并-γ-吡喃酮类化合物(Bis-naphtho-γ-pyrones),具有细胞毒活性[6]、抗菌活性[7,8]、HIV 整合酶抑制活性[9]等。
在大规模发酵培养稻绿核菌UV-2 制备稻曲菌素和稻绿核菌素的同时,本研究对该真菌产生的多糖及其抗氧化活性进行了研究,制备得到菌丝水提多糖(WPS)、菌丝碱提多糖(SPS)和胞外多糖(EPS),其中胞外多糖具有较好的抗氧化活性。进一步对生产胞外多糖的培养基进行优化,有效提高了胞外多糖的得率,为将来大规模培养稻绿核菌生产活性物质提供了依据。
1 材料与方法
1.1 实验材料
稻绿核菌(Vilosiclava virens)UV-2 菌株(下同)为稻曲病病原,由江苏省农业科学院植物保护研究所陈志谊研究员提供。稻绿核菌于4 ℃下保存在马铃薯-葡萄糖-琼脂(PDA)培养基上。
1.2 仪器与试剂
Power Wave HT 多孔板分光光度计(美国BioTek 公司)、TU-1810 分光光度计(北京普析通用仪器有限责任公司)、FreeZone 冰冻干燥机(美国Labconco 公司)、DELTA-320 型pH 计(Mettler Toledo 仪器上海有限公司)、LS-B55L 型立式压力蒸汽灭菌锅(江阴滨江医疗仪器厂)、FLC-3 型超净工作台(哈尔滨东联电子技术开发有限公司)、AL-104 型电子分析天平(Mettler Toledo 仪器上海有限公司)、DRP-9162 型恒温培养箱(上海森信实验仪器有限公司)、TS-8 型转移脱色摇床(海门市其林贝尔仪器制造有限公司)、RE50 型旋转蒸发仪(上海亚荣生化仪器厂)、KQ5200DE 型数控超声波清洗器(昆山市超声仪器有限公司)等。所用试剂均为分析纯。
1.3 多糖的制备
1.3.1 稻绿核菌的发酵培养
从保种管中挑起少许菌丝接种到PDA 平板上活化10 d 左右,挑取活化的菌丝接种于250 mL 的三角瓶中,每瓶装100 mL 马铃薯-葡萄糖(PD)培养液,于28 ℃,150 rpm 摇培7 d 左右,作为种子培养液备用。
每1 L 稻绿核菌的发酵培养液中含:葡萄糖40 g、蛋白胨10 g、FeSO4·7H2O 0.05 g、MgSO4·7H2O 0.2、K2HPO40.6、NaCl 0.6 g,初始pH 值为7.0。250 mL 三角瓶中装发酵培养液100 mL,接种10 个大小一致的菌丝球。于28 ℃、150 rpm 暗培养25 d后收获,共200 瓶,发酵液总体积20 L。收获的发酵液经抽滤,获得菌丝和菌液。经冰冻干燥后的菌丝(203.9 g)用于提取菌丝水提多糖(WPS)和碱提多糖(SPS)。菌液(20 L)浓缩至1 L,用于制备胞外多糖(EPS)。
1.3.2 稻绿核菌菌丝水提多糖的制备
真菌菌丝水提多糖(WPS)的制备参考Li 等的方法[10]。具体步骤如下:将冻干的稻绿核菌菌丝研碎,经脱脂后,晾干,称取一定量(100 g),添加蒸馏水,水料比约为30∶1(v/w),置于热回流提取器内,90 ℃条件下提取3 次,每次2 h。离心后残渣用于菌丝碱提多糖的提取,上清液合并,减压浓缩到小体积,向浓缩的提取液中加入3 倍体积的无水乙醇,4℃醇沉48 h。离心(17418 g)15 min 后,去除上清液,用乙醇和丙酮反复洗涤沉淀,得菌丝水提粗多糖,再经脱脂、脱蛋白、脱色和透析处理,最终收集透析袋中的溶液,经浓缩、冰冻干燥,获得稻绿核菌UV-2 菌丝水提多糖(0.26 g)。
1.3.3 稻绿核菌菌丝碱提多糖的制备
真菌菌丝碱提多糖(SPS)的制备参考Li 等的方法[10],具体步骤如下:将上述已提取菌丝水提多糖的菌丝残渣(约100 g),在1 M 的NaOH 溶液中室温浸提24 h。离心去除残渣,收集上清液,减压浓缩到小体积,向浓缩得提取液中加入3 倍体积的无水乙醇,4 ℃醇沉48 h。离心(17418 g)15 min 后,去除上清液,用乙醇和丙酮反复洗涤沉淀,得菌丝碱提粗多糖,再经脱脂、脱蛋白、脱色和透析处理,最终收集透析袋中的溶液,经浓缩、冰冻干燥,获得稻绿核菌UV-2 菌丝碱提多糖(0.31 g)。
1.3.4 稻绿核菌胞外多糖的制备
真菌胞外多糖(EPS)的制备参考Li 等的方法[11],具体步骤如下:向浓缩的菌液中加入3 倍体积的无水乙醇,4 ℃醇沉48 h。离心(17418 g)15 min 后,去除上清液,用乙醇和丙酮反复洗涤沉淀,得胞外粗多糖,再经脱脂、脱蛋白、脱色和透析处理,最终收集透析袋中的溶液,经浓缩、冰冻干燥,获得稻绿核菌UV-2 胞外多糖(5.48 g)。
1.4 多糖含量的测定
采用蒽酮-硫酸法测定糖含量[12]。首先配制浓度为1.0 mg/mL 的葡萄糖母液,稀释至系列梯度浓度的标准溶液,浓度范围为0.02~0.12 mg/mL。然后,吸取2 mL 葡萄糖溶液于试管中,置于冰浴中,随即添加5 mL 浓度为0.2%的蒽酮-硫酸溶液,迅速摇匀。在沸水浴中反应15 min 后,迅速转移至冰浴中终止反应,室温静置15 min。用分光光度计在最大吸收波长620 nm 下测定各个反应液吸光值。标准曲线为Y=5.4143X+0.0982 (R2=0.9949):Y为620 nm 下的吸光值,X 为实际反应的葡萄糖量(mg)。称取一定量的多糖样品(EPS、WPS、SPS),配制成适当浓度的溶液,实验步骤同于标准品葡萄糖。通过测定620 nm 下的吸光值,即可计算出糖含量。
1.5 多糖抗氧化活性的测定
1.5.1 Fe3+还原能力的测定
参考Fan 等方法[13]。首先,配制以下4 种溶液备用:浓度为0.2 M pH 6.6 的磷酸缓冲溶液100 mL;浓度均为1%的铁氰化钾水溶液和三氯化铁水溶液各50 mL;浓度为10%的三氯乙酸溶液50 mL。接着,配制系列梯度浓度样品溶液,阳性对照为2,6-二叔丁基-4-甲基苯酚(Butylated hydroxytoluene,BHT)。Fe3+还原能力的测定步骤如下:向96 微孔板中依次加入50 μL 样品溶液,20 μL 1%的铁氰化钾和30 μL 磷酸缓冲溶液,振荡混匀,在50 ℃下反应20 min。待冷却至室温,反应孔中再加入70 μL 10%的三氯乙酸溶液和10 μL 1%三氯化铁溶液。振荡混匀,室温反应10 min。测定其在700 nm 下的吸光值。
1.5.2 羟基自由基(·OH)清除能力测定
参考Thirunavukkarasu 等方法[14]。配制浓度2 mg/mL 的FeSO4·7H2O 100 mL;1.5 mg/mL 的水杨酸(Salicylic acid)溶液150 mL;配制1%的H2O2溶液;配制系列梯度浓度样品溶液,以抗坏血酸(Ascorbic acid,AA)作为阳性对照,乙醇作为阴性对照。反应体系如下:首先,向微孔板中依次加入25 μL 2 mg/mL 的FeSO4·7H2O 溶液,50 μL 1%的H2O2溶液,50 μL 1.5 mg/mL 的水杨酸溶液和50 μL 样品溶液,振荡混匀,37 ℃反应1 h。然后用微孔板分光光度计测定其在525 nm 下的吸光值。每个处理4个重复。

D0:添加50 μL 蒸馏水代替样品液反应体系的吸光值;D1:添加50 μL 样品液反应体系的吸光值;D2:50 μL 乙醇代替50 μL 水杨酸溶液时反应体系的吸光值。
建立以供试样品浓度(μg/mL)为横坐标(X),·OH 清除率(%)为纵坐标(Y)的线性回归方程Y=aX+b,以此求得样品·OH 清除能力的有效中浓度EC50。
1.6 Plackett-Burman 实验
采用Plackett-Burman(P-B)实验优化培养基组成[15],生产稻绿核菌胞外多糖(EPS)。发酵培养基为:葡萄糖、蛋白胨、FeSO4·7H2O、MgSO4·7H2O、K2HPO4、NaCl、pH 调至7.0。胞外多糖的制备过程同1.3.4,糖含量的测定同1.4。以稻绿核菌胞外多糖的得率(mg/L)作为唯一检测指标。胞外多糖得率(mg/L)=EPS 干重(g/L)× EPS 糖含量(%)。使用Expert-Design 8.0 软件,选用Plackett-Burman实验设计筛选主效因子。本研究设计了7 个因子,共进行12 组实验,每组实验重复4 次。表1 中为PB 实验中研究的7 个变量及其水平。按照Plackett-Burman 实验配制各种培养基,分装于250 mL 三角瓶中,每瓶装入100 mL 相应配比的培养液,高压蒸汽灭菌15 min,待其冷却后接种。种子培养基及接种量及其培养条件如1.3.1 所示。收获后,制备稻绿核菌EPS,计算其得率。

表1 Plackett-Burman 实验中的变量及其水平Table 1 Levels and values of the variables tested in Plackett-Burman design
1.7 单因素实验
葡萄糖单因素实验:研究了葡萄糖分别为40、50、60、70、80 和90 g/L,蛋白胨为10 g/L,FeSO4·7H2O 为0.05 g/L,MgSO4·7H2O 为0.2 g/L,K2HPO4为0.6 g/L,NaCl 为0.6 g/L,初始pH 调至7.0 条件下稻绿核菌EPS 的得率。从而确定中心组合设计(CCD)中主效因子葡萄糖的取值范围。
蛋白胨单因素实验:研究了蛋白胨分别为5、10、15、20、25 和30 g/L,葡萄糖为50 g/L,FeSO4·7H2O 设为0.05 g/L,MgSO4·7H2O 为0.2 g/L,K2HPO4为0.6 g/L,NaCl 为0.6 g/L,初始pH 调至7.0 条件下稻绿核菌EPS 的得率。从而确定CCD中主效因子蛋白胨的取值范围。
1.8 中心组合实验
通过P-B 实验和单因素实验,筛选出了稻绿核菌发酵培养基的主效成分葡萄糖和蛋白胨及其取值范围。在此基础上利用Expert Design 8.0 软件进行中心组合设计(Central composite design,CCD)。CCD 实验中的变量及其水平见表2。
本研究中,采用二因素五水平CCD 实验进行优化,共设计13 组实验,各变量及其取值范围见表7。以X1,X2分别代表葡萄糖和蛋白胨的实际取值,x1、x2代表对应的编码值。X 与x 之间用以下关系式表示:xi=(Xi-X0)/ △X,i=1、2,xi为Xi的编码值,X0为Xi的中心点,△X 变量X 取值步长。利用Expert Design 8.0 软件可以建立EPS 得率为因变量,葡萄糖和蛋白胨为自变量的二次多项式回归模型,可用如下公式表示:

其中,Y 为目标响应预测值,a0为常数项,x1和x2为自变量;a1和a2为线性相关系数,a3为交互作用相关系数,a4和a5为平方相关系数。

表2 中心组合设计中的变量及其水平Table 2 Values of the variables tested in CCD and their levels
1.9 统计分析
所有的处理均设置三个重复,结果用平均值±标准差表示,并通过SAS version 8.2 软件进行显著性差异分析,当P ≤0.05 时,表明各处理间差异达到显著水平。
2 结果与分析
2.1 多糖的制备
通过摇瓶发酵培养获得稻绿核菌发酵液,经抽滤,得菌丝和菌液,菌丝经冰冻干燥得203.9 g 干重,将冻干的菌丝粉碎,用于菌丝水提多糖(WPS)和碱提多糖(SPS)的制备。菌液(20 L)用于胞外多糖(EPS)的制备。多糖制备结果见表3。

表3 稻绿核菌多糖的制备Table 3 Preparation of the polysaccharides from V.virens
2.2 多糖的抗氧化活性
一般采用清除自由基的效率和还原能力的大小为检测指标,从离体或整体水平上衡量多糖抗氧化作用的强弱[16]。本研究对多糖的Fe3+的还原能力和羟基自由基(·OH)清除能力进行了检测。3 种多糖(WPS、SPS、EPS)对Fe3+还原能力和·OH 清除能力分别见图1 和表4。如果多糖对Fe3+还原能力越强,反应液在700 nm 处的吸收值就越大,3 种多糖中,胞外多糖(EPS)对Fe3+的还原能力最强,其次是菌丝碱提多糖(SPS),菌丝水提多糖(WPS)对Fe3+的还原能力最弱(图1)。

图1 稻绿核菌多糖对Fe3+的还原能力Fig.1 Fe3+ reducing activity of the polysaccharides from V.virens
EPS 对·OH 表现出较好的清除能力,其EC50值为169.2 μg/mL,优于阳性对照抗坏血酸(EC50值为705.5 μg/mL)。SPS 未检测出对·OH 的清除能力(表4)。

表4 稻绿核菌多糖清除·OH 自由基的有效中浓度Table 4 Median effective concentration (EC50)of the polysaccharides from V.virens for scavenging ·OH radical.
2.3 生产胞外多糖的培养基优化
2.3.1 培养基主效因子的筛选
为了有效提高稻绿核菌UV-2 胞外多糖(EPS)的得率,根据基本培养基组分(葡萄糖、蛋白胨、硫酸亚铁、硫酸镁、磷酸氢二钾、氯化钠),通过Plackett-Burman 设计,筛选出培养基中影响EPS 生产的主效因子。运用Design-Expert 8.0.6 进行实验设计(表5)。按该实验设计配制相应的培养基用于稻绿核菌UV-2 的发酵培养,得到每种培养基中的EPS得率(mg/L)。对实验所得响应值进行方差分析(表6),被筛选的7 个因子中,葡萄糖和蛋白胨对稻绿核菌UV-2 的EPS 得率有着较为显著的影响(P<0.05),其它5 个因子(硫酸亚铁、硫酸镁、磷酸氢二钾、氯化钠)对EPS 产率的影响不明显。因此,葡萄糖和蛋白胨作为主效因子用于后续实验研究。
2.3.2 单因素实验
为了进一步筛选出主效因子(葡萄糖和蛋白胨)在中心组合设计(CCD)中的中心点及相应取值范围,针对葡萄糖和蛋白胨设计单因素实验,以实现EPS 得率的最大化。
如图2A 所示,随着葡萄糖浓度的增加,EPS 的得率呈现先增加后减少的趋势。当葡萄糖的浓度由40 g/L 梯度增加到80 g/L 时,EPS 的得率呈迅速上升趋势。当葡萄糖浓度达到80 g/L 的时候,EPS 的得率达到最大值(748.00 mg/L),随着浓度进一步增加,EPS 的得率有所下降,但仍处于较高的水平。因此,将葡萄糖的浓度设定在70~90 g/L 范围内,较有利于稻绿核菌UV-2 胞外多糖的分泌。由此设定CCD 实验中葡萄糖浓度在中心点水平为80 g/L,“-1”水平和“+1”水平分别为70 g/L 和90 g/L。

表5 Plackett-Burman 实验设计及其实验结果Table 5 Plackett-Burman experimental matrix and the results

表6 Plackett-Burman 实验设计筛选结果的显著性分析Table 6 Analysis of variance (ANOVA)for responses from the Plackett-Burman screening test
如图2B 所示,随着蛋白胨浓度的增加,EPS 的得率呈现先增加后减少的趋势。当蛋白胨的浓度由5 g/L 梯度增加到15 g/L 时,EPS 的得率呈迅速上升趋势。当蛋白胨浓度达到15 g/L 的时候,EPS 的得率达到最大值(553.00 mg/L),随着浓度进一步增加,EPS 的得率反而有所下降,但还是处于较高的水平。因此将蛋白胨的浓度设定在10~20 g/L 范围,较有利于稻绿核菌UV-2 胞外多糖的分泌。由此设定CCD 实验中蛋白胨浓度在中心点为15 g/L,“-1”水平和“+1”水平分别为10 g/L 和20 g/L。
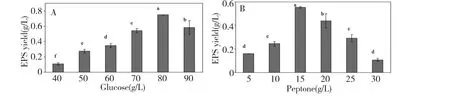
图2 单因素实验中葡萄糖(A)和蛋白胨(B)对稻绿核菌胞外多糖得率的影响Fig.2 Effects of glucose (A)and peptone (B)on EPS yield of V.virens in the single-factor experiments
2.3.3 中心组合实验结果
运用Design-Expert 8.0.6 软件分析CCD 实验的数据(如表7 所示),建立EPS 得率与葡萄糖、蛋白胨之间的二次多项回归模型。运用该模型可以预测在这两个变量取值范围内任意一点所对应的EPS 得率。
用编码值建立的二次多项式回归模型如下:

其中Y 为EPS 的得率,x1、x2为葡萄糖(X1)和蛋白胨(X2)相对应的编码值。
将编码值转换成实际值建立的二次多项式回归模型如下:

运用Design-Expert 8.0.6 对该二次多项式进行方差分析,结果如表8 所示。采用Fisher’s F 检验发现,该模型具有较高的F 值(45.91)和极低的P值(<0.0001),说明所建立的模型显著。该模型的决定系数(R2)和校正系数adj-R2近1,说明该模型的相关关系极显著。该模型的失拟估计Lack of fit经F 分别为0.9735 和0.9434,相对应的相关系数R和adj-R 分别为0.9851 和0.9743,经检验,F 值较低,为5.09,p>F 的概率为0.0752(>0.05),说明失拟估计不显著。此外,该模型的变异系数CV(%)仅为7.11。综上所述,较高的相关系数,不显著的Lack of fit,以及较低的CV (%)值说明所建立的二次多项回归模型合理可靠。比对CCD 实验中该模型的预测值与实验值(如表7 所示)之间的关系,发现两者之间不存在显著差异,证明该模型具有较好的拟合度。

表7 CCD 实验及其结果Table 7 CCD experimental matrix and the results

表8 二次多项式模型的方差分析结果Table 8 Analysis of variance (ANOVA)for the fitted quadratic polynomial model
对该二次多项模型的二次项系数进行显著性分析,结果如表9 所示。采用F 检验,所得结果F 值越大,p 值越小,则该二次项对Y 值的影响越显著。分析结果表明,除二次项“x1x2”(即葡萄糖与蛋白胨之间的交互作用)外,其余二次项对EPS 的得率均具有显著作用。
2.3.4 响应面分析
图3 为稻绿核菌胞外多糖EPS 得率随着变量葡萄糖和蛋白胨浓度的变化而变化的3D 响应面图和与之相对应的2D 等高线图。从图3 中可以看出,葡萄糖和蛋白胨的浓度以及二者之间的交互作用对EPS 得率具有显著的影响。EPS 的得率随着葡萄糖和蛋白胨浓度的增加均表现出先上升后下降的趋势,但葡萄糖和蛋白胨两者之间的交互作用对EPS 的得率影响不显著,这一点可以通过2D 等高线图(图3B)中心呈较规则的圆形得以推出。3D 响应面图(图3A)的最高点即为EPS 得率的最大值点,该点投射到其正下方时位于中心等高线内,即2D 中心等高线范围内的区域。由此,可以推测出EPS 得率最大时葡萄糖和蛋白胨浓度取值范围分别为82.5~86.2 g/L 和13.5~15.0 g/L。
2.3.5 稻绿核菌产胞外多糖最佳培养条件的验证
根据已经建立的二次多项式回归模型Y=855.20+92.03x1-82.67x2+12.25x1x2-110.04x12-216.54x22 求Y 最大值,可以确定相对应变量x1和x2的取值。预测结果如表10 所示。根据模型,当培养基中葡萄糖的浓度为84.08 g/L,蛋白胨为14.11 g/L 时,EPS 得率达到最大值,为881.40 mg/L。应用模型预测出的最佳培养基进行实验验证(n=5),得到EPS 得率的实验值为917.80 mg/L,是未优化前(87.00 mg/mL)的10.55 倍。通过t 检验对EPS 得率的预测值与实验值进行显著性差异分析,发现差异并不显著。证明该模型具有较高的实际拟合度,可用于指导稻绿核菌EPS 得率的调控。

表9 二次多项式模型的系数及其显著性分析Table 9 Regression coefficient estimates and their significance test of quadratic polynomial model

图3 稻绿核菌EPS 得率与葡萄糖和蛋白胨浓度的响应面图(A)和相应的等高线图(B)Fig.3 Response surface plot (A)and contour plot (B)of the EPS yield of V.virens versus the tested variables glucose and peptone

表10 稻绿核菌产胞外多糖最佳培养条件和得率Table 10 The optimal cultured conditions for EPS production of V.virens
3 结论
本研究采用Fe3+还原能力和羟基自由基清除能力抗氧化模型对稻绿核菌菌丝水提多糖(WPS)、菌丝碱提多糖(SPS)和胞外多糖(EPS)的抗氧化活性进行了评价,EPS 表现出较好的抗氧化活性,WPS抗氧化活性中等,稻绿核菌多糖的理化性质和其他生物活性(如免疫调节活性等)值得进一步研究。为了有效提高发酵培养液中EPS 的得率,通过Plackett-Burman 设计,筛选出培养基中影响EPS 生产的主效因子为葡萄糖和蛋白胨。通过单因素实验,确定中心组合设计(CCD)中葡萄糖和蛋白胨浓度的取值范围分别为70~90 g/L 和10~20 g/L。采用CCD 和响应面分析(RSM)优化了对稻绿核菌EPS 得率具有显著影响的葡萄糖和蛋白胨的浓度,建立了EPS 得率与这两个研究变量之间的二次回归模型。通过求解该模型EPS 得率最大时对应变量的取值,当培养基中葡萄糖浓度为84.08 g/L,蛋白胨浓度为14.11 g/L 时,EPS 得率达到最大值,为881.40 mg/L。应用模型预测出的最佳培养基条件进行实验验证(n=5),得到EPS 得率的实验值为917.80 mg/L,是优化前(87.00 mg/L)的10.55 倍,且抗氧活性与优化前无显著性差异(数据未列出)。由于EPS 是分泌到胞外的代谢产物,有利于产物的提取和制备、便于连续培养和降低生产成本等,从而有效促进代谢产物的生产。研究结果为今后培养稻绿核菌大规模生产胞外多糖,以及对稻绿核菌代谢产物综合开发和利用提供了依据。
1 Tanaka E,Ashizawa T,Sonoda R,et al.Villosiclava virens gen.nov.,comb.nov.,the teleomorph of Ustilaginoidea virens,the causal agent of rice false smut.Mycotaxon,2008,106:491-501.
2 Wang F,Zhang S,Liu MG,et al.Genetic diversity analysis reveals that geographical environment plays a more important role than rice cultivar in Villosiclava virens population selection.Appl Environ Microbiol,2014,80:2811-2820.
3 Li Y,Koiso Y,Kobayashi H,et al.Ustiloxins,new antimitotic cyclic peptides:interaction with porcine brain tubulin.Biochem Pharmacol,1995,49:1367-1372.
4 Lv SQ(吕仕琼),Liu H(刘浩),Zhang JL(赵江林),et al.Research progress of ustiloxins.Chin Agric Sci Bull (中国农学通报),2010,14:265-268.
5 Shan T,Sun W,Wang X et al.Purification of ustiloxins A and B from rice false smut balls by macroporous resins.Molecules,2013,18:8181-8199.
6 Koyama K,Ominato K,Natori S et al.Cytotoxicity and antitumor activities of fungal bis (naphtho-γ-pyrone)derivatives.J Pharmacobio-Dyn,1988,11:630-635.
7 Lu S,Tian J,Sun W,et al.Bis-naphtho-γ-pyrones from fungi and their bioactivities.Molecules,2014,19:7169-7188.
8 Lu S,Sun W,Meng J,et al.Bioactive bis-naphtho-γ-pyrones from rice false smut pathogen Ustilaginoidea virens.J Agric Food Chem,2015,63:3501-3508.
9 Singh SB,Zink DL,Bills GF,et al.Four novel bis-(naphthoγ-pyrones)isolated from Fusarium species as inhibitors of HIV-1 integrase.Bioorg Med Chem Lett,2003,13:713-717.
10 Li P,Mou Y,Shan T,et al.Effects of polysaccharide elicitors from endophytic Fusarium oxysporium Dzf17 on growth and diosgenin production in cell suspension culture of Dioscorea zingiberenesis.Molecules,2011,16:9003-9016.
11 Li P,Xu L,Mou Y,et al.Medium optimization for exopolysaccharide production in liquid culture of endophytic fungus Berkleasmium sp.Dzf12.Int J Mol Sci,2012,13:11411-11426.
12 Wang Z,Luo D,Ena C.Optimization of polysaccharides extraction from Gynostemma pentaphyllum Makino using uniform design.Carbohyd Polym,2007,69:311-317.
13 Fan Y,Ge Z,Luo A.In vitro antioxidant activity of polysaccharide from Gardenia jasminoides Ellis.J Med Plants Res,2011,5:2963-2968.
14 Thirunavukarasu P,Ramanathan T,Ramkumar L,et al.The antioxidant and free radical scavenging effect of Avicennia officibalis.J Med Plants Res,2011,5:4754-4758.
15 Xu CP,Kim SW,Hwang HJ,et al.Application of statistically based experimental designs for the optimization of exo-polysaccharide production by Cordyceps militaris NG3.Biotechnol Appl Biochem,2002,36:127-131.
16 Ye M (叶明),Li SY(李世艳),Zhang L (张利兵),et al.Fermentation and polysaccharide antioxidative activity of a Libertella strain.Acta Microbiol Sin (微生物学报),2008,48:1398-1402.

