一株产耐酸性α-淀粉酶菌株的鉴定及其酶学性质研究
杨艳红,李世川,兰世玉,朱 巍
重庆理工大学药学与生物工程学院生物工程系,重庆 400054
α-淀粉酶(α-1,4-葡聚糖-4-葡聚糖水解酶,EC3.2.1.1)以随机作用方式切断淀粉、糖原、寡聚或多聚糖分子内的α-1,4 糖苷键,生成糊精、低聚糖和单糖,广泛用于粮食加工、酿造、纺织品、制药、饲料、石油开采等行业[1],在工业生产中占有极其重要的地位。目前,工业上,都是采用微生物发酵法大规模生产α-淀粉酶,是用途较广泛的一种酶制剂,占据了整个酶制剂市场份额的25%左右[2,3]。
目前,国内外市场中常用的中温和高温α-淀粉酶的适用pH 范围一般为6.0~8.0,在酸性条件下其酶活性明显降低,已不能满足一些酸性条件下淀粉原料的深加工工艺的要求[4,5]。如我国淀粉原料的深加工过程一般需要经过液化和糖化,液化过程中使用的淀粉酶其最适的pH 在6.0 左右,但在随后的糖化过程中,糖化酶的最适pH 在5.0 左右,这就会出现在淀粉液化后要耗费大量酸碱来调pH,而耐酸性淀粉酶的开发将有助于解决液化酶和糖化酶最适pH 存在差异的这个难题。耐酸性α-淀粉酶是一类可以在较低pH 值条件下水解淀粉的酶类,最适pH 一般为4.0~5.5[6],可使淀粉原料深加工工艺中的液化和糖化在同一pH 条件进行,进而简化工艺,节约成本。另外,耐酸性α-淀粉酶还可以用于高麦芽糖浆的生产、开发新型助消化剂以及工业废液处理等多个领域,能有效减少加工工艺过程中化学试剂的消耗[7],降低副产物的形成,减少环境污染,具有重大经济、社会效益[2]。
解淀粉芽孢杆菌,枯草芽孢杆菌,地衣芽孢杆菌,脂肪嗜热芽孢杆菌在工业生产中被认为是最好的α-淀粉酶生产菌株[8]。本文主要对实验室分离的一株产高活性酸性α-淀粉酶的野生菌株进行鉴定和酶学性质研究,以期为该酸性α-淀粉酶的工业应用提供研究基础。
1 材料与方法
1.1 菌种
AF1,本实验室分离。
1.2 培养基和试剂
生长培养基:马铃薯20.0 g,蔗糖3.0 g,蛋白胨2.5 g,尿素0.33 g,NaCl 1.0 g,蒸馏水100 mL,pH 7.0。
发酵培养基:马铃薯20.0 g,蔗糖2.0 g,蛋白胨3.0 g,尿素0.33 g,NaCl 1.0 g,蒸馏水100 mL,pH 7.0。
菌种鉴定培养基:参见《常见细菌系统鉴定手册》[9]。
Lysis Buffer for Microorganism to Direct PCR 9164 购自Takara(日本);16S rDNA Bacterial Identification PCR Kit RR176 购自Takara(日本);Takara MiniBEST DNA Fragment Purification Kit Ver.4.0 购自Takara(日本)。
1.3 分离菌株的鉴定
1.3.1 生理生化鉴定
参照《常见细菌系统鉴定手册》[9]和《现代微生物学实验技术》[10]进行。
1.3.2 16S rDNA 序列测定
把AF1 培养至对数期,严格按照Lysis Buffer for Microorganism to Direct PCR(Code No.9164,Takara)操作说明进行操作,获得含基因组DNA 的裂解液,然后以裂解液为模板,按Takara 16S rDNA Bacterial Identification PCR Kit(Code No.RR176,Takara)进行PCR 反应,PCR 产物用Takara MiniBEST DNA Fragment Purification Kit Ver.4.0(Code No.9761,Takara)进行回收纯化。纯化产物送Invitrogen 公司进行全序列测序。测序引物Seq forward、Seq internal 和Seq reverse 来自于Takara 16S rDNA Bacterial Identification PCR Kit(Code No.RR176,Takara)。将序列通过NCBI 网站中的BLAST 程序与GenBank 中的核酸数据进行对比分析。根据比对结果,从数据库中选取与所分析的细菌基因序列同源性较高的已知相关序列,采用MEGA 6.0 软件进行多重序列比对分析,用邻接法(Neighbor-Joining,NJ)构建系统发育树,用Bootstrap 检验,且Bootstrap 值为1000。
1.4 α-淀粉酶活力测定[11,12]
酶活力定义:在合适温度下,l mL 酶液1 min 内催化底物转变为产物变化0.01 个吸光值定义为1个酶活力单位。
α-淀粉酶活力测定采用碘比色改良法进行,具体操作步骤如下:分别吸取5.0 mL 0.4%的可溶性淀粉溶液和一定pH 的0.2 mol/L 磷酸氢二钠—柠檬酸缓冲溶液5.0 mL 于样品和空白对照试管中,在一定温度恒温水浴中预热平衡5 min。然后在样品管中加入适度稀释待测酶液2.0 mL,同时空白对照管中加入煮沸的酶液2.0 mL(或加同体积的缓冲液2.0 mL),用秒表记录时间,摇匀,准确酶解反应5 min 后立即吸取反应液1.0 mL,加入到预先盛有0.5 mL 盐酸(0.1 mol/L)和5.0 mL 稀碘液(需当天配制,取原碘液2.0 mL,加碘化钾20 g,加蒸馏水溶解定容至500 mL,贮于棕色瓶内)的试管中,摇匀,冰浴中终止反应,于580 nm 波长下,用10 mm 比色皿迅速测定其吸光度值(OD)。以1.0 mL 水代替1.0 mL 反应液为参比对照。

OD0为空白对照吸光度值,OD 为样品吸光度值,2 为酶液体积(mL),5 为反应时间(min)。
1.5 α-淀粉酶酶液制备
将斜面菌种接种到新鲜斜面培养基上,37 ℃活化培养24 h 后,挑取1 环接种到装有50 mL 生长培养基的250 mL 三角瓶中,37 ℃、200 rpm 培养,待OD600值达到5.0 时,按1%接种量接入发酵培养基中培养40 h,发酵液于12000 rpm 离心5 min,取上清液作为酶液,用于各种酶学性质研究。
1.6 α-淀粉酶酶学性质研究
1.6.1 酶反应最适温度测定
按照上述酶活力测定方法,保持其他条件恒定,分别在40、50、55、60、65、70、75、80、85、90 ℃测定酶活,以温度为横坐标,相对酶活力为纵坐标绘制曲线,得到酶反应最适温度。以最高酶活力为100%,计算相对酶活力。
1.6.2 酶反应最适pH 测定
按照上述酶活力测定方法,保持其他条件恒定,分别在pH 3.0、3.6、4.0、4.6、5.0、5.6、6.0、7.0、8.0 测定酶活,以pH 为横坐标,相对酶活为纵坐标绘制曲线,得到酶反应最适pH。以最高酶活力为100%,计算相对酶活力。
1.6.3 酶的热稳定性
将酶液分别在50、60、70、80、90、100 ℃的条件下,分别保温5,10、20、30、45、60 min 后,迅速置于冰水中冷却后,在上述确定的最适反应温度和pH条件下测定剩余酶活。以保温时间为横坐标,相对酶活为纵坐标,绘制曲线。以未处理的原酶液的酶活力为100%,计算相对酶活力。
1.6.4 酶的pH 稳定性
用磷酸氢二钠—柠檬酸缓冲液将酶液调pH 分别为4.0、4.6、5.0、6.0、7.0、8.0,放置5、10、20、30、45、60 min 后,调节pH 至最适反应pH 值,再测酶活。
在上述确定的最适反应温度和pH 条件下测定剩余酶活。以保温时间为横坐标,相对酶活为纵坐标,绘制曲线。以未处理的原酶液的酶活力为100%,计算相对酶活力。
1.6.5 金属离子对酶稳定性影响
分别配制10 mmol/L 的Na+、K+、Li+、Ba2+、Fe3+、Ca2+、Mg2+、Cu2+,EDTA 共九种离子的母液。取酶液,分别加入不同离子母液,得到金属离子终浓度2.5 mmol/L 的酶液,在室温放置60 min 后,在上述确定的最适反应温度和pH 条件下测定酶活。观察不同金属离子作用下的剩余酶活,以不含金属离子的原酶液的酶活力为100%,计算相对酶活力。
2 结果与分析
2.1 菌株鉴定
2.1.1 形态学特征
菌株AF1 在LB 培养基上生长良好,形成圆形菌落,乳白色,不透明,表面干燥粗糙,有隆起,边缘不规则。菌体形态为杆状、单生,革兰氏染色呈阳性,芽孢呈椭圆形,端生(见图1)。

图1 AF1 的形态学特征Fig.1 Morphological characteristics of AF1 cells
2.1.2 生理生化特征
生理生化试验结果见表1。综合供试菌株AF1的形态特征及生理生化特性,《常见细菌系统鉴定手册》中相应属、种的有关性状,可将AF1 菌归入芽孢杆菌属(Bacillus)。

表1 菌株AF1 生理生化特征Table 1 Biochemical and physiological characteristics of strain AF1

2.1.3 16S rDNA 序列和系统发育分析
AF1 的16S rDNA 的基因全序列长度为1475 bp,在GenBank 中的登录号为:KM373520。将获得的基因序列在GenBank 数据库中进行Blast 同源性比对分析,结果表明,AF1 的16S rDNA 序列与许多Bacillus amyloliquefaciens 和Bacillus subtilis 相似性均为99%。从中选取部分同源性较高的菌种,用MEGA 6.0 构建的系统发育树分析,发现AF1 与Bacillus amyloliquefaciens subsp plantarum FZB42 聚在一个进化分支上,如图2。

图2 菌株AF1 16S rDNA 全序列构建的系统发育树Fig.2 Phylogenetic neighbor-joining tree based on 16S rDNA sequence of strain AF1
综合上述AF1 菌株的形态、生理生化特征,以及16S rDNA 的系统发育树的分析,确定AF1 菌株为芽孢杆菌属的解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。
2.2 α-淀粉酶酶学性质研究
2.2.1 酶反应最适温度
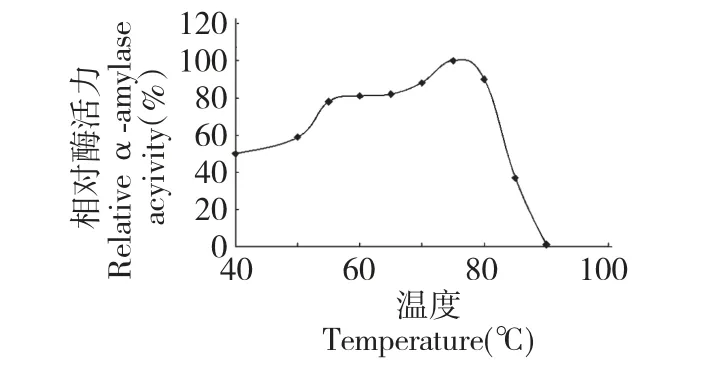
图3 温度对酶活力的影响Fig.3 Effect of temperature on α-amylase activity
在不同温度条件下,pH 5.0 时测定α-淀粉酶活力。如图3 显示,此菌株的α-淀粉酶反应的最适温度是75 ℃,在55~80 ℃之间相对酶活较高,在40~75 ℃范围内酶活力随温度上升而升高,75 ℃时酶活力达到最高,随后酶活力随温度上升而下降。
2.2.2 酶反应最适pH
在不同pH 条件下,75 ℃时测定α-淀粉酶的活力。如图4 所示,菌株AF1 所产的α-淀粉酶的活力受酸碱度影响较大,在偏酸条件下酶活力较高。其最适pH 为5.0,在pH 4.5~6.5 之间,相对酶活在80%以上。
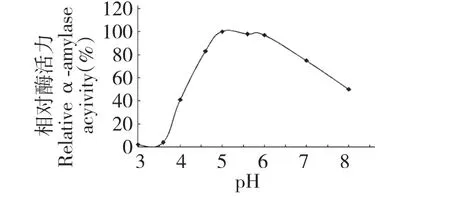
图4 pH 对酶活力的影响Fig.4 Effect of pH on α-amylase activity
2.2.3 酶热稳定性研究
酶液在不同温度保温不同时间后测定酶液活力,结果见图5。在1 h 内,60 ℃以下,该酶相对比较稳定,剩余酶活力80%以上,而70 ℃以上,酶活力下降很快,到80 ℃时,保温仅30 min,剩余酶活力为0。
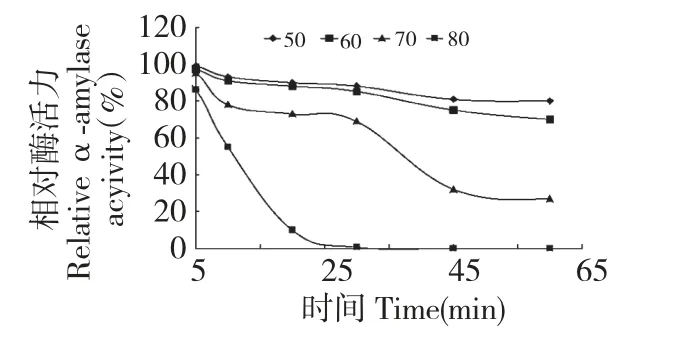
图5 温度对酶的稳定性影响Fig.5 Effect of temperature on enzyme stability
2.2.4 酶pH 稳定性
将酶液用不同pH 的缓冲液处理不同时间后,测定各剩余酶活,结果如图6 所示。该酶在pH 5.0~7.0 处理1 h 后,剩余酶活≥80%,非常稳定。在pH≤4.6 和pH≥8.0 时,处理1 h 后,剩余酶活则不足50%。

图6 pH 对酶的稳定性影响Fig.6 Effect of pH on enzyme stability
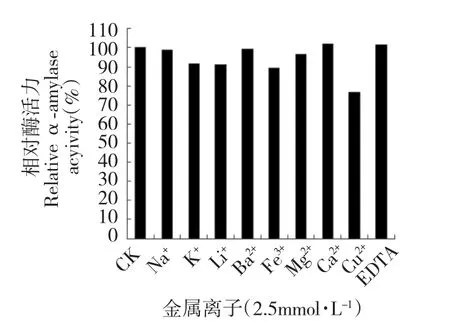
图7 金属离子对酶稳定性的影响Fig.7 Effect of metal ions on enzyme stability
2.2.5 金属离子对酶的稳定性影响
取酶液,分别加入一定浓度的不同离子母液,得到金属离子终浓度2.5 mmol/L 的酶液,在室温放置60 min 后测定酶活,结果见图7。Cu2+对酶活有明显的抑制作用,酶活力降至76%;K+、Li+、Fe3+则对酶活有轻微抑制作用,只降低10%左右;而其他金属离子Na+、Ca2+、Ba2+、Mg2+和EDTA 则对酶活没有明显的影响。
3 讨论
当代淀粉加工业中,α-淀粉酶在pH 6.8,Ca2+稳定的条件下发挥活性,而天然淀粉的pH 为3.2~4.5 之间,所以为了适合α-淀粉酶的最适pH,首先得将淀粉溶液的pH 提高到5.8~6.2,而且要添加Ca2+去维持酶的稳定性。这些步骤降低了生产效率和增加了成本,因此,耐酸性α-淀粉酶的研究和开发具有重要意义[8]。现阶段,国内外所筛选到的产耐酸性α-淀粉酶的菌株主要为芽孢杆菌和曲霉,如酸热脂环酸芽孢杆菌(B.acidocaldarius)A-2[13],酸热脂环酸芽孢杆菌(B.acidocaldarius)ATCC2709[14,地衣芽孢杆菌(B.licheniformis)[15],黑曲霉(Aspergillus niger)[16],白曲霉(Aspegillus kawachii)[17],嗜热脂肪芽孢杆菌(Bacillus steorothermopilius)[18]等,最适pH 4.5~5.5 之间,最适温度在30~60 ℃之间[19],但初始酶活力均不高,且某些缺乏可靠的安全性,无法满足实际生产的需要。本文中AF1 菌株为解淀粉芽孢杆菌(Bacillus amyloliquefacien),是一种与枯草芽孢杆菌亲缘性很高的细菌,对人畜无毒无害,不污染环境。AF1 菌株产生的α-淀粉酶最适作用温度为75 ℃,比常见的α-淀粉酶最适温度在30~60 ℃之间要高一些,可以降低淀粉从糊化到液化的冷却过程中大量的冷量损耗,还可以增加液化速度。AF1 的耐酸性α-淀粉酶最适反应pH 为5.0,与淀粉加工过程中的糖化酶偶联作用,可避免pH的调节,从而精简工序,节约成本。该酶在pH 5.0~7.0 范围内酶活比较稳定,Cu2+对酶活有明显的抑制作用,Na+,Ca2+,Ba2+,Mg2+和EDTA 则对酶活没有明显的影响。目前,工业上所用的商品化α-淀粉酶多数需要依赖Ca2+来维持稳定性和活性,但是高果糖浆生产工艺中的Ca2+会抑制葡萄糖异构酶的作用[4,5],因此,开发不依赖Ca2+的α-淀粉酶具有更好的发展前景。目前国内外已有部分研究者选育筛选了不依赖Ca2+的α-淀粉酶菌株[20-22],本研究中的α-淀粉酶是一种不依赖于Ca2+的耐酸性α-淀粉酶,在淀粉加工过程中,不仅不用加Ca2+以维持酶的活性,同时可以将其与糖化酶偶联作用,避免pH调节,能够实现在弱酸性条件下淀粉液化和糖化同步进行,从而精简工序,节约成本。
1 Wang JL(王建玲),Chen ZX(陈志鑫),Liu YH(刘逸寒),et al.Screening,identification and characterization of an acid α-amylase producing strain and optimization of its fermentable condition.Biotechnol Bull (生物技术通报),2014,4:159-163.
2 Shi FF(石方方),Jiao GB(焦国宝),Ding CH(丁长河),et al.Research progress on the acid-resistant thermostable α-amylase.China Food Addit(中国食品添加剂),2014,4:171-176.
3 Prakash O,Jaiswal N.Erratum to:α-amylase:an ideal representative of thermostable enzymes.Appl Biochem Biotechnol,2010,162:2123-2124.
4 Hashida M,Bisgaard-Frantzen H.Protein engineering of new industrial amylases.Trends Glycosci Glycotechnol,2000,12:389-401.
5 Shaw A,Bott R,Day AG.Protein engineering of α-amylase for low pH performance.Curr Opin Biotechnol,1999,10:349-352.
6 Richardson TH,Tan X,Frey G,et al.A novel,high performance enzyme for starch liquefaction discovery and optimization of a low pH,thermostable α-amylase.J Biol Chem,2002,277:26501-26507.
7 Sajedi RH,Naderi-Manesh H,Khajeh K,et al.A Ca-independent α-amylase that is active and stable at low pH from the Bacillus sp.KR-8104.Enzyme Microb Technol,2005,36:666-671.
8 Yao Q(姚清),Chen JH(陈建华).Research progress on new type α-amylase.Pharm Biotechnol (药物生物技术),2013,20:557-559.
9 Dong XZ(东秀珠),Cai MY(蔡妙英).Common Bacteria Manual System Identification(常见细菌系统鉴定手册).Beijing:Science Press,2001.370-385.
10 Zhu XF(朱旭芬).Modern Experimental Technique of Microbiology(现代微生物学实验技术).Hangzhou:Zhejiang University Press,2011.198-229.
11 Yoo YJ,Hong J,Hatch RT.Comparison of α-amylase activi-ties from different assay methods.Biotechnol Bioeng,1987,30:147-151.
12 Qin Y(秦艳),Wang QY(王青艳),Lu Y(陆雁),et al.Isolation of acidic α-amylase-producing strain and its enzymatic properties.Liquor-Making Sci Technol (酿酒科技),2009,12:17-20.
13 Kanno M.A Bacillus acidocaldarius alpha-amylase that is highly stable to heat under acidic conditions.Agric Biol Chem,1986,50:23-31.
14 Crabb WD,Mitchinson C.Enzymes involved in the processing of starch to sugars.Trends Biotechnol,1997,15:349-352.
15 Oziengbe EO,Onilude AA.Production of a thermostable αamylase and its assay using Bacillus licheniformis isolated from excavated land sites in Ibadan,Nigeria.Bayero J Pure Appl Sci,2012,5:132-138.
16 Okolo BN,Ezeogu LI,Mba CN.Production of raw starch digesting amylase by Aspergillus niger grown of native starch sources.J Sci Food Agric,1995,69:109-115.
17 Sudo S,Ishikawa T,Sakamoto Y,et al.Characteristics of acid-stable α-amylase production by submerged culture of Aspergillus kawachii.J Ferment Bioeng,1993,76:105-110.
18 Kamasaka H,Sugimoto K,Takashi K,et al.Bacillus stearothermophilus neopullulanase selective hydrolysis of amylase to maltose in the presence of amylopectin.Appl Environ Micro,2002,68:1658-1664.
19 Sharma A,Satyanarayana T.Microbial acid-stableα-amylase:Characteristics,genetic engineering and applications.Process Biochem,2013,48:201-211.
20 Hashemi M,Shojaosadati SA,Razavi SH,et al.The efficiency of temperature-shift strategy to improve the production of αamylase by Bacillus sp.in a solid-state fermentation system.Food Bioproc Technol,2012,5:1093-1099.
21 Hu JE(胡建恩),Cao Q(曹茜),Yang F(杨帆),et al.Optimizing of fermentation conditions for high cell density cultivation and high hyperthermophilic α-amylase expression in recombinant E.coli.Food Sci(食品科学),2012,33:219-225.
22 Wang CH(王成华),Shen NK(申乃坤),Qin Y(秦艳),et al.Purification and characterization of complete and truncated forms of Ca2+independent α-amylase.Chin J Bioproc Eng(生物加工过程),2012,10(5):44-49.

