辛癸基葡糖苷辅助提取暴马丁香中橄榄苦苷的工艺优化
王 化,周丽萍,李梦莎,朱良玉,张 悦*
1黑龙江省科学院自然与生态研究所;2东北林业大学,哈尔滨 150040
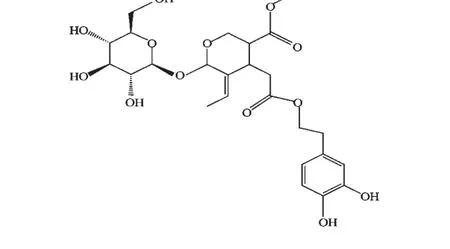
图1 橄榄苦苷分子结构图Fig.1 Chemical structure of oleuropein
橄榄苦苷(Oleuropein)是一种无毒的裂环烯醚萜苷类化合物(见图1),是暴马丁香的主要活性成分之一。近年来,国内、外学者对橄榄苦苷的研究不断深入,已发现其诸多药理活性,主要包括:抗氧化[1]、抗炎[2]、抗动脉粥样[3]、抗癌[4]、抗病毒等活性,及对心脏损害的保护[5]、降糖[6]、降血脂作用[7],广泛应用于医药、化妆品等领域。
目前橄榄苦苷的提取方法主要为溶剂浸提法、超声提取法和微波提取法[8-10],未见应用表面活性剂辅助提取的研究报道。实验采用的烷基糖苷(APG)类化合物是由葡萄糖和天然脂肪醇合成的一种性能较全面的新型非离子表面活性剂,兼具阴离子和普通非离子表面活性剂的特性,具有较高表面活性和相溶性,更重要的是具有良好的生态安全性,安全无毒、易降解,是当今国际公认的首选“绿色”功能性表面活性剂[11]。研究烷基糖苷类表面活性剂对于辅助提取暴马丁香树枝中橄榄苦苷的影响,考察不同因素与目的产物得率的关系,得出最佳提取工艺参数,为实现节能环保的橄榄苦苷工业生产提供参考。
1 材料与仪器
暴马丁香树枝于2014年5 月采集于东北林业大学,60 ℃干燥,并通过粉碎机粉碎至40 目,置于阴凉干燥处备用;橄榄苦苷对照品(≥98%,AW7860,天津一方科技有限公司);烷基糖苷系列表面活性剂(≥50%,临沂市兰山区绿森化工有限公司);甲醇(色谱纯),乙醇(分析纯),去离子水自制。
超声波清洗器(KQ3200DE,昆山市超声仪器有限公司);Waters e2695-2998 高效液相色谱检测系统;C18色谱柱(4.6mm × 150mm,5 μm,Waters 公司)。
2 实验方法
2.1 橄榄苦苷含量测定方法
2.1.1 标准品制备
精确称取橄榄苦苷对照品4 mg,用甲醇溶解并定容于1 mL 量瓶中,得橄榄苦苷质量浓度为4 mg/mL 的对照品储备液,分别精密稀释为浓度2、1、0.4、0.2、0.1、0.04、0.02 mg/mL 的工作溶液。
2.1.2 样品制备
分别称取暴马丁香树枝粉末1.00 g,置于50 mL 烧杯中,各加入一定体积的不同浓度含有烷基糖苷系列表面活性剂的乙醇溶液,放置于超声波辅助提取器中进行提取,提取完成后将提取液1 mL 于离心管中,12000 rpm,离心15 min,取上清液体置于液相进样瓶中,待测。
2.1.3 HPLC 色谱条件
柱温30 ℃,流动相甲醇-0.5%磷酸水溶液(36∶64),检测波长205 nm,流速1 mL/min,进样量10 μL,橄榄苦苷出峰时间为16.174 min。
2.1.4 橄榄苦苷得率计算
橄榄苦苷得率(%)=橄榄苦苷质量(g)/暴马丁香样品质量(g)×100% 。
2.2 橄榄苦苷提取的单因素试验
实验中选取了6 个因素分别为:APG 型号、乙醇体积分数、APG 添加量、提取温度、提取时间、料液比,分别改变以上6 个因素进行超声波法提取试验。
2.2.1 APG 型号
称取暴马丁香树枝粉末1.00 g,按照温度为40℃,料液比例1∶15 g/mL,在体积分数为45%的乙醇溶液中分别加入APG06、APG08、APG10、APG0810、APG0814,添加量为0.5%,超声提取时间40 min,提取液经离心后进行HPLC 检测,按公式计算橄榄苦苷得率,重复3 次。
2.2.2 乙醇体积分数
称取暴马丁香树枝粉末1.00 g,按照温度为40℃,料液比例1∶15 g/mL,分别在体积分数为0%、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%的乙醇溶液中加入APG0810,添加量为0.5%,超声提取时间40 min,提取液经离心后进行HPLC 检测,按公式计算橄榄苦苷得率,重复3 次。
2.2.3 APG 添加量
称取暴马丁香树枝粉末1.00 g,按照温度为40℃,料液比例1∶15 g/mL,在体积分数为80%的乙醇溶液中加入APG0810,添加量分别为0.2%、0.5%、1.0%、2.0%、3.0%,超声提取时间40 min,提取液经离心后进行HPLC 检测,按公式计算橄榄苦苷得率,重复3 次。
2.2.4 提取温度
称取暴马丁香树枝粉末1.00 g,按照料液比例1 ∶15 g/mL,提取溶剂为80% 的乙醇溶液中添加0.5%的APG0810,超声温度分别为20、30、40、50、60、70 ℃,提取时间40 min,提取液经离心后进行HPLC 检测,按公式计算橄榄苦苷得率,重复3 次。
2.2.5 料液比例
称取暴马丁香树枝粉末1.00 g,按照提取溶剂为80%的乙醇溶液中添加0.5%的APG0810,超声温度40 ℃,料液比例分别为1 ∶10、1 ∶15、1 ∶20、1∶25、1∶30 g/mL,提取时间40 min,提取液经离心后进行HPLC 检测,按公式计算橄榄苦苷得率,重复3次。
2.2.6 提取时间
称取暴马丁香树枝粉末1.00 g,按照提取溶剂为80%的乙醇溶液中添加0.5%的APG0810,超声温度40 ℃,料液比例为1∶20 g/mL,提取时间分别为10、20、30、40、50、60 min,提取液经离心后进行HPLC 检测,按公式计算橄榄苦苷得率,重复3 次。
2.3 响应面法优化橄榄苦苷提取工艺
在橄榄苦苷单因素提取试验的基础之上,根据Design-Expert 8.0.6 中Box-Benhnken 设计原理,选取影响橄榄苦苷得率的3 个主要因素:乙醇体积分数、提取温度和提取时间进行响应面优化组合,因素水平设计见表1。

表1 响应面设计因素水平表Table 1 Factors and levels in the response surface design
3 结果与讨论
3.1 橄榄苦苷标准曲线
根据HPLC 结果可以得出橄榄苦苷质量(X)与峰面积(Y)的线性关系拟合标准曲线公式:Y=30087930X +1212258(R2=0.9992),线性范围0.02~4.00 mg/mL。橄榄苦苷标准品与样品高效液相色谱图如图2 所示。
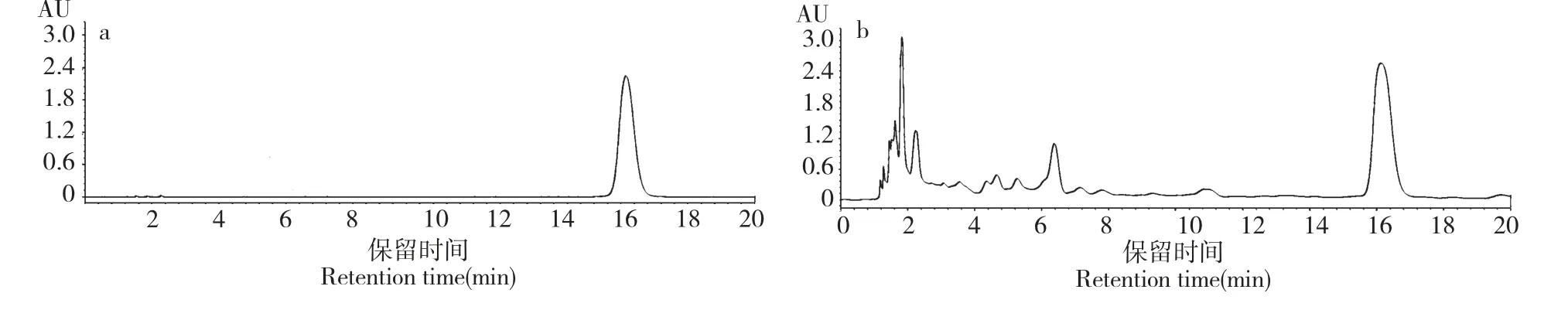
图2 橄榄苦苷标准品(a)及暴马丁香树枝提取液(b)的HPLC 色谱图Fig.2 HPLC chromatograms of oleuropein standard (a)and S.amurensis branch (b)
3.2 不同单因素对橄榄苦苷提取得率的影响
6 个不同因素对橄榄苦苷提取得率的影响如图3 所示。
5 种不同型号APG 添加到乙醇中辅助提取橄榄苦苷结果见3a。APG06、APG08 和APG10 三种型号烷基糖苷表面活性剂的添加并未显著提高橄榄苦苷的得率,而APG0810、APG0814 均明显提高了橄榄苦苷的得率,与乙醇提取得率相比分别提高了7.45%、5.21%,表明含有复合碳素分布的烷基糖苷化合物比仅含有单一碳素分布的烷基糖苷化合物更易降低固-液相界面张力,增大有机物质的溶解、渗出能力,提高提取率。因此,选取APG0810 辅助提取橄榄苦苷。
图3b 为体积分数为0~100%乙醇溶液进行超声提取试验的结果。乙醇体积分数为80% 时,橄榄苦苷得率最高可达3.94%;乙醇体积分数超过80%时,得率反而下降。原因是当乙醇体积分数达到80%,溶剂与橄榄苦苷极性相近,当超过体积分数80%时,溶剂的极性降低,导致橄榄苦苷得率也降低。因此,响应面试验选择体积分数70%~90%的乙醇。
选择不同APG0810 添加量试验结果如图3c 所示。当APG0810 添加量达到0.5%时,橄榄苦苷提取效果已达到较好水平——3.94%,再增加添加量对橄榄苦苷得率无显著影响。APG0810 用量太大,不仅会增加生产的成本,还会使生产过程中产生较多泡沫,增加分离难度,因此选取添加0.5% 的APG0810 较为适宜。
由图3d 可见,在20~40 ℃范围内,橄榄苦苷得率随提取温度升高而显著增加,40~60 ℃之间橄榄苦苷得率缓慢增加,因此,响应面试验选择提取温度为40~60 ℃进行。
改变料液比例进行超声提取试验,得到结果如图3e 所示。料液比例在1∶10~1∶20 g/mL 范围之内,橄榄苦苷得率显著提高,其原因可能为随料液比例的增加,橄榄苦苷的传质动力也增加,使原料粉末中更多的橄榄苦苷融入乙醇中。当料液比例继续升高时,橄榄苦苷得率没有显著变化。以节约溶剂因素考虑,将提取料液比例设定为1∶20 g/mL。
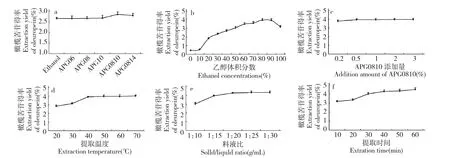
图1 APG 型号(a)、乙醇体积分数(b)、APG0810 添加量(c)、提取温度(d)、料液比(e)及提取时间(f)对橄榄苦苷得率的影响Fig.1 Effects of APG types (a),ethanol concentration (b),adding amount of APG0810 (c),extraction temperature (d),solid/liquid ratio (e)and extraction time (f)on the extraction yields of oleuropein
图3f 为提取时间试验结果。在设定时间范围内,橄榄苦苷得率一直随提取温度升高而增加,提取时间60 min 时,橄榄苦苷得率最高达4.52%,但提取40 min 时,橄榄苦苷得率为4.29%,两者之间未达到显著性差异,建议考虑生产中时间和超声能量的消耗,将响应面试验提取时间定为30~50 min。
3.3 响应面法优化橄榄苦苷提取工艺条件
根据响应面试验结果,对响应值(橄榄苦苷得率/Y)与各因素(乙醇体积分数/A、提取温度/B、提取时间/C)进行回归拟合,得到橄榄苦苷提取得率回归方程:
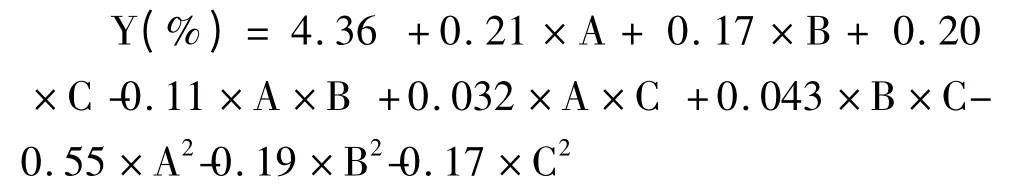
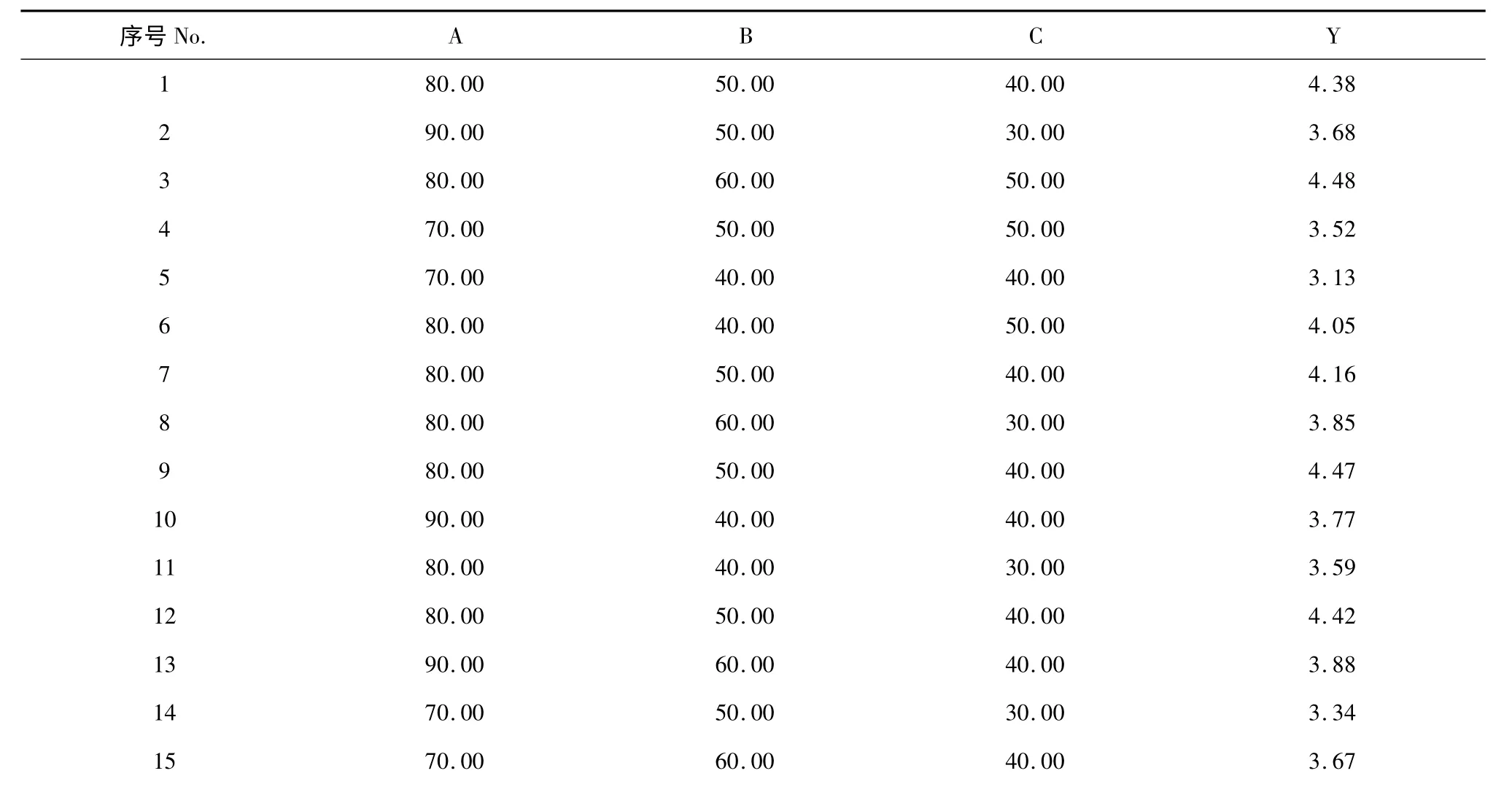
表2 响应面分析设计及实验结果Table 2 Design and experimental result of response surface methodology

序为:乙醇体积分数>提取时间>提取温度。
橄榄苦苷提取得率的回归统计分析结果如表3所示。拟合方程的各个变量对橄榄苦苷的得率影响的显著程度可以通过P 值进行判断[12]。P 的值越小,表明对应变量影响的显著性水平越高,当P≤0.05 时达到显著水平,P≤0.01 时达到极显著水平。此方程P<0.01,表明回归模型具有显著性。失拟项F=1.08,P=0.4527>0.05,表明实验设计合理,拟合效果好。各因素对提取暴马丁香中橄榄苦苷得率的影响大小顺序为:乙醇体积分数>提取时间>提取温度。
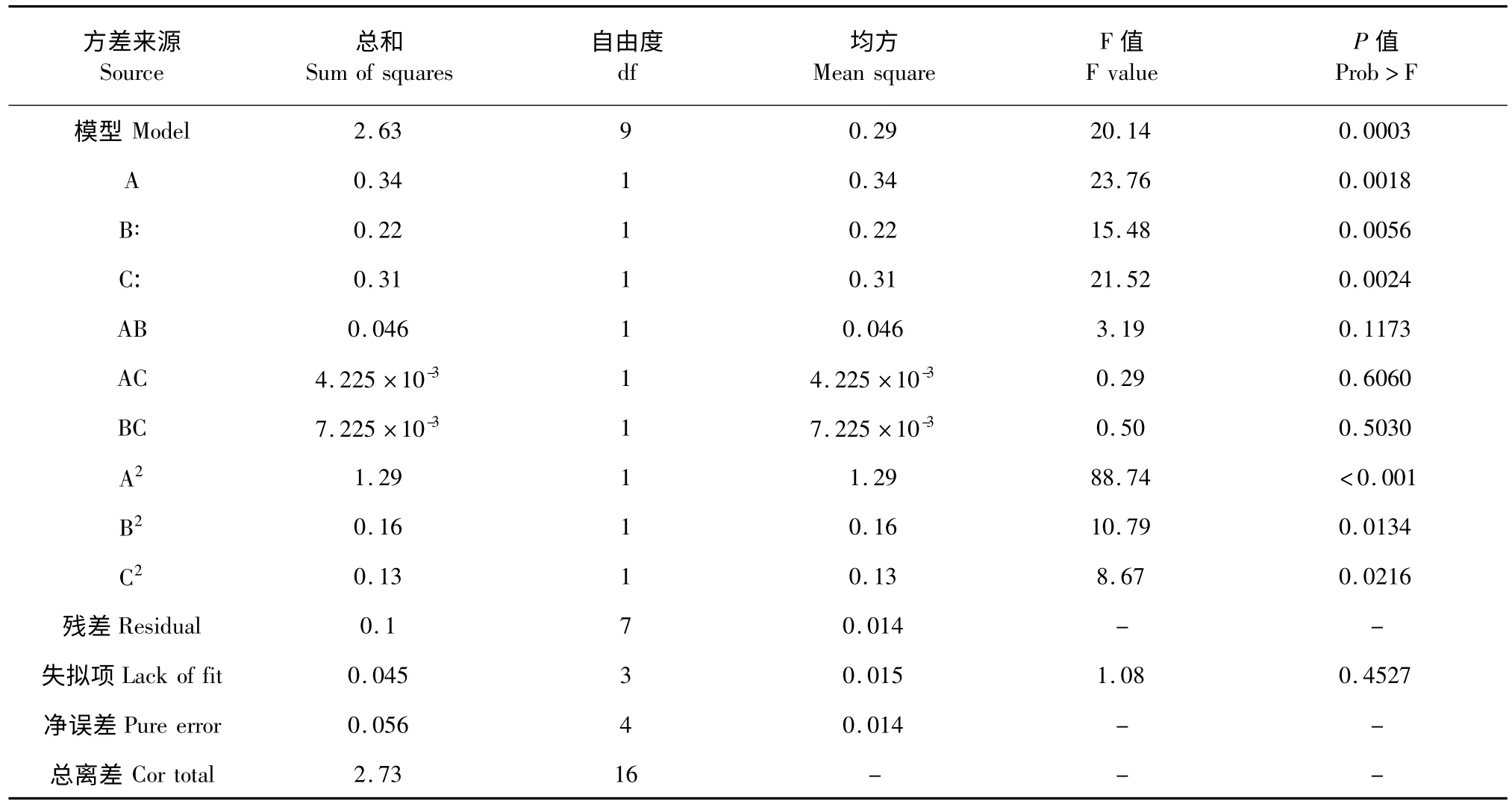
表3 回归模型方差分析Table 3 ANOVA for response surface quadratic model
由二次回归模型得到三个响应曲面图,见图4。橄榄苦苷得率的响应曲面均为开口向下凸面,且中心在考察区域之内,表明在考察区域范围内存在响应值的最大值。通过Design-Expert 软件分析,提取暴马丁香中橄榄苦苷的最佳条件为:乙醇体积分数81.62%,提取温度54.61 ℃,提取时间46.43 min,橄榄苦苷得率为4.48%。

图4 各因素对橄榄苦苷得率的影响的响应面图Fig.4 Response surface plots showing interactive effects of different factors on the yield of oleuropein
对优化所得最佳条件进行验证实验,为方便操作,选取各条件临近整数值,具体为:称取暴马丁香树枝粉末1.00 g,按照提取溶剂为80%的乙醇溶液中添加0.5%的APG0810,超声提取温度55 ℃,料液比例为1∶20 g/mL,提取时间为46 min,提取液经离心后进行HPLC 检测,计算橄榄苦苷得率,重复5次。实际测得橄榄苦苷得率为4.41±0.11%,与模型预测值之间误差为1.59%。
4 结论
辛癸基葡糖苷辅助提取暴马丁香树枝中橄榄苦苷的优化工艺条件为:提取溶剂为80%的乙醇溶液中添加0.5%的APG0810,超声提取温度55 ℃,料液比例为1∶20 g/mL,提取时间为46 min,橄榄苦苷得率为4.41±0.11%。
暴马丁香中橄榄苦苷的高效制备技术研究既可以为医药、化妆品等领域提供新的植物资源,又能为暴马丁香资源的精深加工利用提供技术支持,促进暴马丁香资源合理利用基础上,开发高值化产品,有利于推动林下经济的发展。
1 Visioli F,Poli A,Galli C.Antioxidant and other biological activities of phenols from olives and olive oil.Med Res Rev,2002,22:65-75.
2 Visioli F,Bellosta S,Galli C.Oleuropein,the bitter principles of olives,enhances nitric oxide production by mouse macrophages.Life Sci,1998,62:541-546.
3 Carluccio MA,Siculella L,Ancora MA,et al.Olive oil and red wine antioxidant polyphenols inhibit endothelial activation:antiatherogenic properties of mediterranean diet phytochemicals.Arterioscler Thromb Vasc Biol,2003,23:622-629.
4 Owen RW,Giacosa A,Hull WE,et al.Olive oil consumptionand health:the possible role of antioxidants.Lancet Oncol,2000,1:107-112.
5 Andreadou I,Sigala F,Iliodromitis EK,et al.Acute doxorubicin cardiotoxicity is successfully treated with the phytochemical oleuropein through suppression of oxidative and nitrosative stress.J Mol Cell Cardiol,2007,42:549-558.
6 Al-Azzawie HF,Alhamdani MS.Hypoglycemic and antioxidant effect of oleuropein in alloxan-diabetic rabbits.Life Sci,2006,78:1371-1377.
7 Andreadou I,Iliodromitis EK,Mikros E,et al.The olive constituent oleuropein exhibits anti-ischemic,antioxidative,and hypolipidemic effects in anesthetized rabbits.J Nutr,2006,36:2213-2219.
8 Wang CZ (王成章),Gao CX (高彩霞),Ye JZ (叶建中),et al.Study on seasonal variation of oleuropein content in olive leaves by HPLC.Chem Ind Forest Prod(林产化学与工业),2008,28(6):39-43.
9 Dang JZ (党建章),Huang ZL (黄志立),Zhang ZA (张志安),et al.Different extraction of oleuropein from Oleseuropaea leaves.J Shenzhen Poly (深圳职业技术学院学报),2006,5(4):34-36.
10 Xie PJ (谢普军),Huang LX (黄立新),Zhang CH (张彩虹),et al.Optimization of ultrasound-assisted extraction of oleuropein from Oleseuropaea L.leaf using response surface methodology.Nat Prod Res Dev (天然产物研究与开发),2012,24:939-944.
11 Shang HJ (尚会建),Duan XN(段晓娜),Li H (李慧),et al.Research status and prospects of alkyl polyglycoside.Mod Chem Ind (现代化工),2013,33(11):28-31.
12 Ye CL,Jiang CJ.Optimization of extraction process of crude polysaccharides from Plantago asiatica L.by response surface methodology.Carbohydr Polym,2011,84:495-502.

