响应面优化生姜茎叶总黄酮提取工艺及其抗氧化活性研究
王宗成,蒋玉仁,刘小文,姜红宇,何福林*
1湖南科技学院湘南优势植物资源综合利用湖南省重点实验室,永州 425100;2 中南大学化学化工学院,长沙 410083
生姜(Zingiber officinale Roscoe)是姜属植物姜的根茎,是一种极为重要的香辛味调料,同时还是一味重要的中药材,我国卫生部将其公布为首批药食兼用植物资源之一,其具有散寒解表,温中止吐,回阳通脉,燥湿消痰的功效,经中医传统炮制方法可将生姜变成干姜、炮姜等不同作用的中药材[1]。生姜的化学成分复杂,目前,研究已确认含挥发油、姜辣素(姜酚)、黄酮类等化学成分达200 余种[2,3]。有关生姜生物活性物质的功效研究越来越广泛,具有抗氧化、抗衰老、降血脂、抗肿瘤、降血糖、抑菌、护肤美容等多方面的生物活性[4]。这些多样性的活性为开发功能性的生姜药品、保健品、调味品、化妆品和绿色农药等提供了巨大的潜力与空间[5,6]。生姜中含有丰富的黄酮类化合物,其黄酮类化合物具有较强的抗氧化活性,并强于柠檬酸和抗坏血酸[7]。从生姜块茎中提取黄酮类化合物的报道较多[7-9],生姜皮中黄酮类化合物的提取也有报道[6],而有关生姜茎叶中活性物质的提取及研究还未见报道,生姜茎叶少许鲜嫩部位作为家畜食物,大部分丢弃在地里,形成了极大的资源浪费。因此,从废弃的生姜茎叶中提取有效成分,充分开发生姜茎叶的用途,变废为宝,提高生姜的附加值,优化自然资源,无论从经济效益还是社会效益来看,都具有长远的意义。本实验对生姜茎叶中总黄酮提取工艺和抗氧化活性进行研究,以期探明生姜茎叶中黄酮的含量、提取工艺的优化条件和抗氧化活性强弱,为生姜茎叶开发抗氧化保健食品或天然抗氧化剂,提高生姜废弃物加工的综合利用提供理论参考。
1 材料与方法
1.1 原料与仪器
1.1.1 原料与试剂
生姜茎叶,采自湖南永州,经清洗,60 ℃真空烘箱中烘干粉碎后过60 目筛;芦丁标准品,中国药品生物制品检定所生产(批号:100080-200707);乙醇、氢氧化钠、亚硝酸钠、硝酸铝、铁氰化钾、三氯乙酸、三氯化铁、硫酸亚铁、水杨酸、双氧水、L-(+)-抗坏血酸(Vc)、2,6-二叔丁基对甲酚(BHT)等均为分析纯试剂。
1.1.2 主要仪器设备
UV-1750 型紫外可见分光光度计,日本岛津公司;RE-52B 旋转蒸发仪,上海亚荣生化仪器厂;SHB-Ⅲ循环水式多用真空泵,郑州长城科工贸有限公司;TE124S 电子天平,北京赛多利斯仪器系统有限公司;离心机(LD4-2A),北京医用离心机厂;中兴FW-200 高速万能粉碎机,北京中兴伟业仪器有限公司;集热式磁力搅拌器,郑州长城科工贸有限公司。
1.2 试验方法
1.2.1 标准曲线的绘制
精密称取在120 ℃减压干燥至恒重的芦丁对照品5.0 mg 至50 mL 容量瓶中,加70%乙醇稀释至刻度,摇匀,得到对照溶液(含芦丁0.1 mg/mL)。再精密吸取对照品溶液0.0、1.0、2.0、3.0、4.0、5.0与6.0 mL,分别置于10 mL 容量瓶中,分别加入5%NaNO2溶液0.3 mL,摇匀,放置6 分钟后各加入10% Al(NO3)3溶液0.3 mL,摇匀,放置6 min,再分别加入4% NaOH 溶液4.0 mL,再加水至刻度,摇匀,放置10 min,在510 nm 波长处测定吸光度,绘制出标准曲线。以吸光度(A)为纵坐标,芦丁浓度(C,mg/mL)为横坐标,制作标准曲线,回归方程为:A=11.257 C +0.0193,R2=0.9992,在0.01~0.06 mg/mL 质量浓度范围内有良好的线性关系。
1.2.2 单因素实验
准确称取10.0 g 干燥粉碎的生姜茎叶粉,用一定浓度的乙醇,在设定的实验条件下(考察料液比、提取次数、乙醇浓度、提取温度和提取时间五个因素)回流提取,将提取液抽滤,将滤渣按第一次提取条件再提取一定次数,合并滤液浓缩至约30 mL,转移至50 mL 容量瓶中,用70%乙醇定容至刻度,摇匀作为样品溶液。取样品溶液1.0 mL,转移至10 mL 容量瓶中,再用70%乙醇定容至刻度,摇匀,取该溶液2.0 mL,置于10 mL 容量瓶中,按照标准曲线绘制方法操作,测定吸光度,根据标准曲线计算出测定稀释后样品溶液总黄酮浓度C。然后计算样品中总黄酮的提取率,总黄酮提取率单位mg/g 以mg芦丁当量/g 生姜茎叶干粉质量计算。

式中,C 为稀释后样品溶液总黄酮浓度(mg/mL);N 为稀释倍数:50;V 为最初样品定容体积(50 mL);m 为样品质量(10.0 g)。
1.2.3 响应面实验
在单因素实验的基础上,选取出乙醇浓度(A)、提取温度(B)和提取时间(C)3 个对生姜茎叶黄酮提取影响比较显著的因素,在固定料液比1∶30、提取次数2 次的条件下,根据Box-Benhnken 实验设计原理,以总黄酮提取率为响应值,采用经典的三因素三水平的响应面实验表,进行响应面试验确定生姜茎叶中黄酮提取的最佳工艺[10,11]。Box-Benhnken试验设计因素水平见表1。
1.2.4 抗氧化活性测定
1.2.4.1 生姜茎叶黄酮总还原能力的测定
根据标准曲线计算出被测定样品溶液总黄酮浓度,然后再稀释成不同黄酮浓度进行抗氧化活性测定。参照Vaquero 等[12]的方法稍作修改,在10 mL试管中依次加入2.5 mL pH 为6.6 的磷酸缓冲溶液,1.0 mL 不同浓度提取液和1.0 mL 质量分数为1%的铁氰化钾溶液,摇匀,50 ℃水浴加热20 min,急速冷却,再加入2.5 mL 质量分数为10%的三氯乙酸溶液在3000 rpm 的转速下离心10 min,取上清液5 mL 与4 mL 的蒸馏水和1.0 mL 质量分数为1%的三氯化铁溶液,混匀后静置10 min,于可见光700 nm 处测定吸光值,蒸馏水调零,吸光度越大,说明还原能力越强。以Vc 和BHT 作为对照。

表1 响应面实验因素水平表Table 1 Factors and levels of response surface design
1.2.4.2 生姜茎叶黄酮清除羟基自由基能力测定
参照Smironff 等[13]的方法并加以改进。在10 mL 比色试管中依次加入6 mmol/L FeSO4溶液2.0 mL、不同质量浓度的待测液2.0 mL、6 mmol/L 的H2O2溶液2.0 mL,摇匀静置10 min,再加入6 mmol/L 的水杨酸溶液2.0 mL,摇匀,静置30 min后于510 nm 处测其吸光度;做3 次平行实验,取平均值。阳性对照用Vc 和BHT 同法操作。
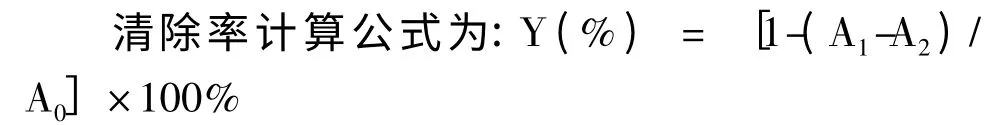
式中,A0为空白对照;A1为某质量浓度黄酮类组分的吸光度;A2为无水杨酸时的吸光度。
2 结果与讨论
2.1 单因素实验
2.1.1 提取次数对提取率的影响
取样品10.0 g,乙醇浓度70%,料液比1∶30,恒温70 ℃,按每次120 min 回流提取,分别提取1、2、3、4 次提取测定生姜茎叶总黄酮含量,考察提取次数对生姜茎叶总黄酮提取率的影响。实验结果表明,提取次数越多提取率越大,实际上,提取2 次时生姜茎叶总黄酮已基本溶出较完全,为了节省时间和节约溶剂,从工业成本和提取周期角度来看,选取提取2 次。
2.1.2 料液比的对提取率的影响
取样品10.0 g,乙醇浓度70%,料液比分别为1∶10、1∶20、1∶30、1∶40、1∶50 提取,恒温70 ℃,回流提取两次,每次120 min 的条件提取测定生姜茎叶总黄酮含量,考察料液比对生姜茎叶总黄酮提取率的影响。结果如图1A 所示,在一定范围内随着料液数值的增大黄酮的提取率呈增加趋势,虽然料液比为1∶50 时,提取率最大,但料液比超过1∶30 后,提取率基本稳定,考虑到生产成本,宜选取料液比1∶30。

图1 料液比(A)、乙醇浓度(B)、提取温度(C)及提取时间(D)对总黄酮提取率的影响Fig.1 Effect of solid-to-liquid ratio (A),ethanol concentration (B),extraction temperature (C)and extraction time (D)on the yield of total flavonoids
2.1.3 乙醇浓度对提取率的影响
取样品10.0 g,分别以50%、60%、70%、80%、90%的乙醇溶液为提取溶剂,料液比1∶30,恒温70℃,回流提取两次,每次120 min 的条件提取测定生姜茎叶总黄酮含量,考察乙醇浓度对生姜茎叶总黄酮提取率的影响。结果如图1B 所示,提取率随乙醇浓度递增呈先增后减的变化趋势,在乙醇浓度为70%左右时,提取生姜茎叶总黄酮的效果更佳。可能是由于随着乙醇体积分数增大,黄酮类化合物达到饱和,同时一些醇溶性杂质、色素、亲酯性强的成分溶出量增加,这些成分与黄酮类化合物竞争同乙醇-水分子结合,从而导致黄酮类化合物的提取率下降。
2.1.4 提取温度对提取率的影响
取样品10.0 g,乙醇浓度70%,料液比1∶30,回流提取两次,每次120 min,分别于50、60、70、80、90℃的条件提取测定生姜茎叶总黄酮含量,考察提取温度对生姜茎叶总黄酮提取率的影响,结果如图1C所示,提取率先随着提取温度的提高而提高,在提取温度为80 ℃时,生姜茎叶总黄酮的提取率达到最高。在初始阶段,随着提取温度的升高黄酮类化合物提取率升高,但是温度过高可能引起黄酮类化合物结构被氧化导致其提取率降低。
2.1.5 提取时间对提取率的影响
取样品10.0 g,乙醇浓度70%,料液比1∶30,恒温80 ℃,回流提取两次,分别每次回流提取30、60、90、120、150 min 的条件提取测定生姜茎叶总黄酮含量,考察提取时间对生姜茎叶总黄酮提取率的影响。图1D 显示提取时间在60~120 min 之间温度对生姜茎叶总黄酮提取率的总体影响不是很大,提取时间达90 min 以后提取率不增反而减少了。这可能是提取时间太长,某些黄酮类化合物分解所致。
2.2 响应面设计试验结果及分析
2.2.1 Box-Benhnken 设计方案及试验结果
从单因素实验结果可知,乙醇浓度(A)、提取温度(B)和提取时间(C)3 个因素对生姜茎叶黄酮提取影响比较显著,因此在固定料液比1∶30、提取次数2 次的条件下,选取这三个因素作为影响因子,以总黄酮提取率为响应值,进行响应面试验。试验设计及试验结果见表2。

表2 响应面分析试验设计及结果Table 2 Response surface design arrangement and experimental results
采用Design expert 8.0.6 软件对表2 中实验结果进行多项拟合回归,得到生姜茎叶黄酮提取率(Y)对乙醇浓度(A)、提取温度(B)、提取时间(C)的二次多项回归模型方程为:

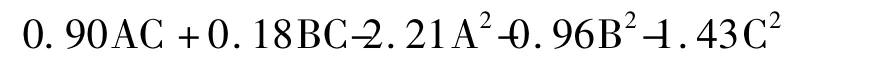
2.2.2 响应面回归模型的方差分析
为了检验回归方程的有效性,进一步确定各因素对总黄酮提取率的影响程度,对回归模型进行了方差分析,结果见表3。
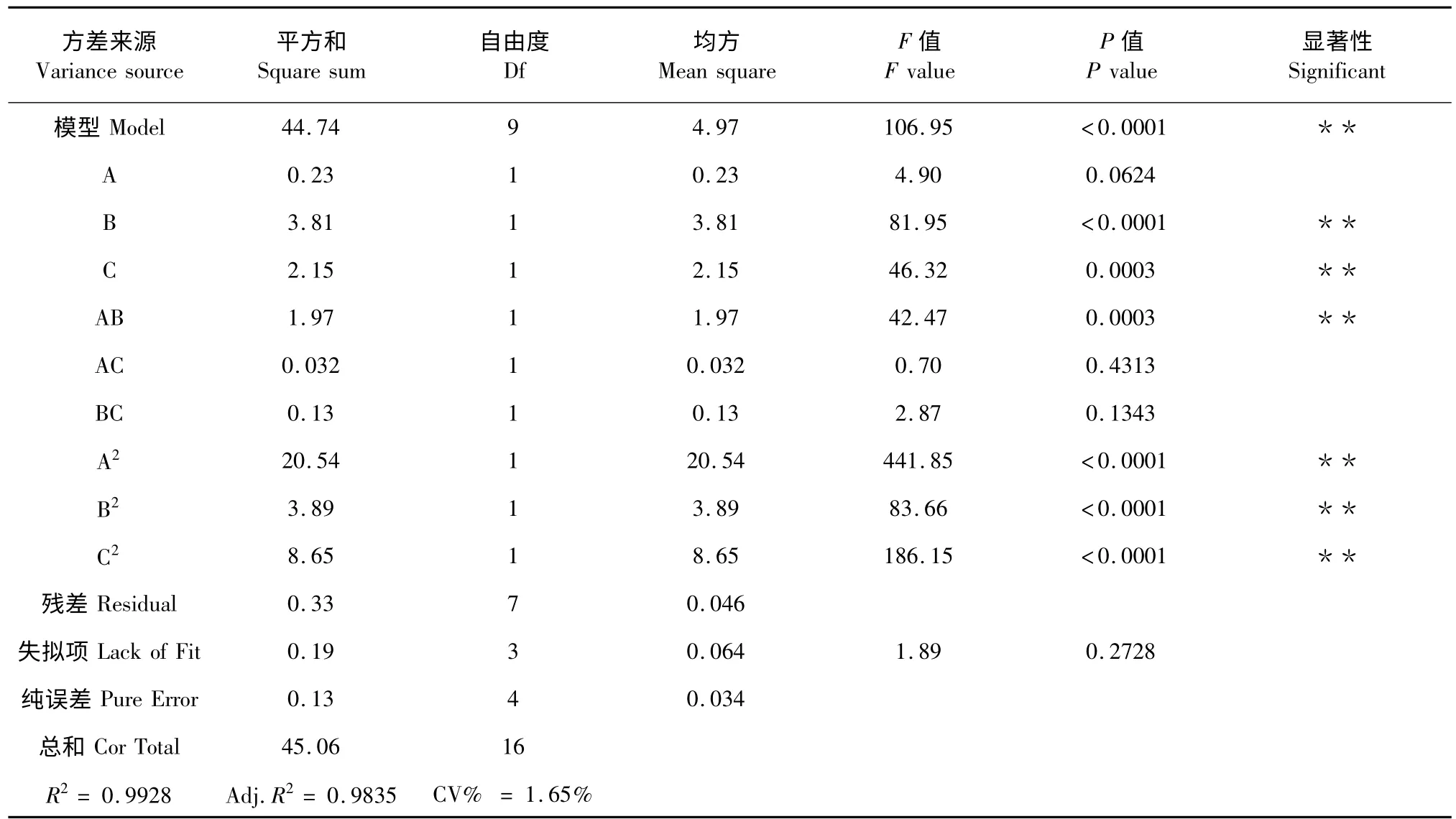
表3 响应面设计回归方程的方差分析Table 3 ANOVA for response surface quadratic model
从表3 可知,模型的F=106.95、P<0.0001,差异极显著;失拟项的P 值为0.2728>0.05,差异不显著,说明方程对实验有较好的拟合性,实验误差较小。相关系数R2=0.9928 和调整系数Adj.R2=0.9835 也表明模型拟合程度较好,响应值的变化有98.35%来源于所选因素,即来源于乙醇浓度、提取温度和提取时间,说明模型拟合度好,回归方程能很好的描述各因素与响应值之间的关系,该实验方法可靠[10,11]。变异系数(CV)为1.65%说明模型的重现性很好,该模型可用于优化生姜茎叶总黄酮提取的工艺条件。
回归模型中一次项B 和C,交互项AB,二次项A2、B2和C2的P 值均小于0.01,说明提取温度、提取时间、乙醇浓度和提取温度的交互项以及3 个因素的二次项都具有显著影响;而其他交互项、乙醇浓度及缺失项显著性较差。表明实验因素对响应值不是简单的线性关系,而是一种非线性关系[11]。
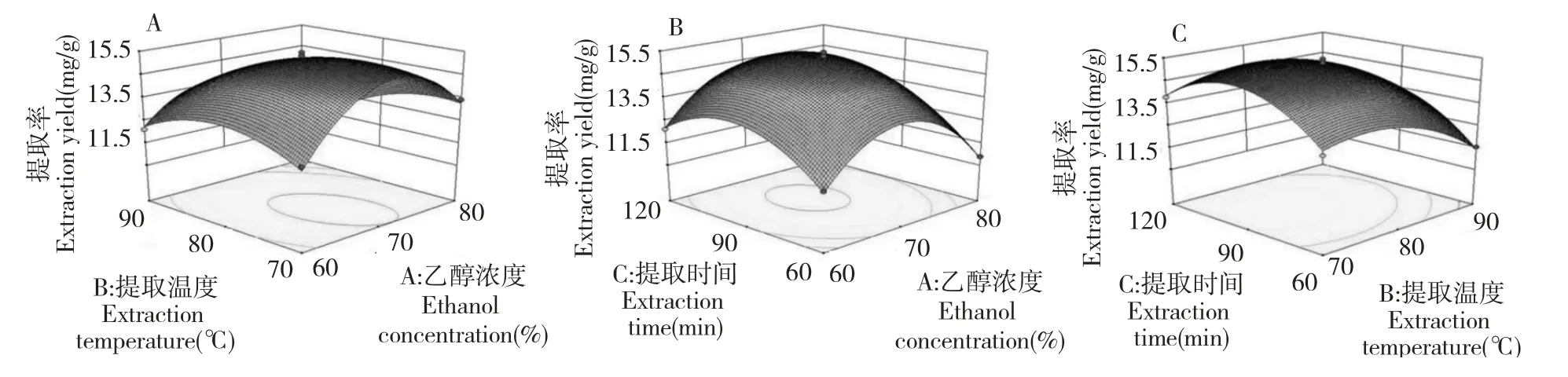
图2 各提取因素之间的交互作用影响Fig.2 Response surface plots showing the mutual effects of different factors on the yield of polysaccharides
响应曲面坡度越陡峭,表明响应值对于操作条件的改变越敏感,反之曲面坡度越平缓,操作条件的改变对响应值的影响也就越小[11]。图2 直观地反映了各因素交互作用对响应值的影响,乙醇浓度和提取温度交互作用曲面陡峭,表明其对总黄酮提取率的交互作用明显。各因素的效应关系为:B(提取温度)>C(提取时间)>A(乙醇浓度)。
2.2.3 最佳工艺条件
用Design-expert 8.0.6 软件对二次多项式回归方程进行计算,得到最佳的提取条件为乙醇浓度70.21%、提取温度76.50 ℃、提取时间94.77 min,预测提取率为15.39 mg/g。但考虑到实际操作的局限性,将乙醇回流提取生姜茎叶黄酮的提取工艺修正为∶乙醇浓度70%、提取温度76 ℃、提取时间95 min。根据此条件并在料液比1∶30、提取次数2次条件下进行了3 次平行验证实验,得到黄酮的实际平均提取率为15.42±0.09 mg/g,与理论预测值15.39 mg/g 接近,表明此响应面法得到的回归模型具有一定的可靠性。
2.3 抗氧化活性测定
2.3.1 生姜茎叶黄酮总还原能力的测定
以VC和BHT 作为对照,测定了生姜茎叶黄酮的总还原能力,结果如图3 所示,在测定浓度范围内,生姜茎叶黄酮、VC和BHT 的还原能力随着浓度的增大逐渐增强;生姜茎叶黄酮具有良好的还原能力,其总还原能力在测定范围内强于BHT,弱于VC。
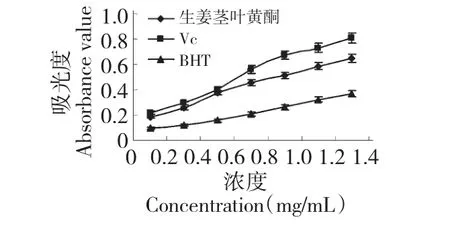
图3 生姜茎叶黄酮、BHT 和抗坏血酸的还原能力Fig.3 Reducing ability of flavonoid extract of Z.officinale stem and leaves,BHT and Vc
2.3.2 生姜茎叶黄酮清除羟基自由基能力测定
以VC和BHT 作为对照,测定了生姜茎叶黄酮清除羟基自由基能力,结果如图4 所示,在测定范围内,生姜茎叶黄酮、VC和BHT 对羟基自由基的清除能力随浓度的增大而增大,根据测定结果求出线性回归方程,计算出IC50,生姜茎叶黄酮和VC清除羟基的IC50分别为0.50 mg/mL 和0.27 mg/L,BHT 清除羟基的IC50约为2.31 mg/mL。可见,生姜茎叶黄酮对羟基自由基具有较高清除作用,清除活性比VC弱,但强于BHT。

图4 生姜茎叶黄酮、BHT 和抗坏血酸对羟基自由基的清除能力Fig.4 Scavenging effects of flavonoid extract of Z.officinale stem and leaves,BHT and Vc on hydroxyl radical
3 结论
利用响应面设计优化提取生姜茎叶中总黄酮的工艺,得到的最佳工艺条件为:乙醇浓度70%、提取温度76 ℃、提取时间95 min,在此条件下理论提取率为15.39 mg/g,与实测值15.42±0.09 mg/g 基本相符,说明本实验的模型拟合程度高,准确有效,可用于生姜茎叶黄酮提取工艺的优化筛选。
体外抗氧化活性表明,生姜茎叶总黄酮具有较强的抗氧化能力,与相同浓度的Vc 和BHT 比较,生姜茎叶黄酮总还原能力和清除羟基自由基的能力比VC弱,但强于BHT,且随着浓度的增大,其清除能力增强。由此可见,生姜茎叶总黄酮作为抗氧化保健食品或天然抗氧化剂具有广阔的开发前景。
1 Mo KJ (莫开菊),Liu S (柳圣),Chen C (程超).Study on antioxidant activity of the Ginger flavonoid.Food Sci (食品科学),2006,27:110-115.
2 Jolad SD,Lantz RC,Solyom AM,et al.Fresh organically grown ginger (Zingiber officinale):composition and e?ects on LPS-induced PGE2production.Phytochemistry,2004,65:1937-1954.
3 Zou L (邹磊).Bioactive compounds in Zingiber officinale Rosc.Chin Brew (中国酿造),2009,28(12):6-9.
4 Kubra IR,Rao LJM.An impression on current developments in the technology,chemistry,and biological activities of Ginger (Zingiber officinale Roscoe).Crit Rev Food Sci Nutr,2012,52:651-688.
5 Liu QH (刘庆海).Blending technique and brewing technique of Ginger liquor.Mod Food Sci Technol (现代食品科技),2006,22:82-83.
6 Xu QL (许庆陵),Zhou YQ (周勇强),Zhan Y (战宇),et al.Research on extraction technology of flavonoid from Ginger peel.Mod Food Sci Technol (现代食品科技),2012,28:998-1001.
7 Yang Y (杨洋).Extraction of flavonoids from Ginger and determination of its antioxidant activity.Chin Condiment (中国调味品),2002,7:18-23.
8 Zhang RY (张如意),Zhu J (朱静).Study on the extraction of flavonoid from Ginger.Food Fermentation Technol (食品与发酵科技),2010,46:89-92.
9 Liu LL (刘玲玲),Lou LJ (娄伦蛟),Hu XP (胡欣培),et al.Microwave extraction technology of flavonoids from Ginger.J Shanxi Agric Sci (山西农业科学),2010,38(6):21-23.
10 Su DL (苏东林),Dan Y (单杨),Li GY (李高阳),et al.Studies on optimization of the technology for extracting total flavonoids from citrus peel by response surface methodology.J Chin Inst Food Sci Technol (中国食品学报),2009,9(3):71-77.
11 Lin JY (林建原),Ji LH (季丽红).Optimization of flavonoids from Ginkgo biloba using response surface analysis.J Chin Inst Food Sci Technol (中国食品学报),2013,13(2):83-90.
12 Vaquero MJR,Serravalle LRT,Nadra MCM,et al.Antioxidant capacity and antibacterial activity of phenolic compounds from argentinean herbs infusions.Food Control,2010,21:779-785.
13 Smirnoff N,Cumbes QJ.Hydroxyl radical scavenging activity of compatible solutes.Phytochemistry,1989,28:1057-1060.

