响应面法优化纤维素酶协同提取沙棘籽粕原花青素的工艺研究
欧阳健,金家宏,王洪伦
1中国科学院西北高原生物研究所,西宁 810001;2中国科学院大学,北京 100049;3 伽蓝(集团)股份有限公司,上海 200233
沙棘(Hippophae rhamnoides L.)是胡颓子科沙棘属植物,为灌木或乔木,青藏高原是沙棘的起源地,青海是沙棘的重要分布区。沙棘资源具有分布广、品种多和耐旱强等特点,仅青海省内,天然沙棘林面积5.3 万hm2,人工林面积7.3 万hm2,未成林造林面积达7.4 万hm2,具有很大的产业开发潜力[1]。沙棘籽粕为沙棘籽超临界CO2萃取油脂后的工业废料,经检测其蛋白质含量为20%,糖分为11.35%,脂肪为10.9%,总植物碱2.92 mg/kg,总黄酮502 mg/kg,另外还富含氨基酸、维生素等生物活性成分[2]。
现代药理学研究表明[3-5],沙棘具有抗肿瘤、抗心血管疾病和免疫调节等生物活性,尤其是沙棘中所含的原花青素类化合物具有较强的抗氧化及免疫调节等生理功能[6-9]。原花青素[10]是一类具有特殊分子结构的生物黄酮,是由不同数量的儿茶素和表儿茶素结合形成的聚合物,其中2~5 倍体被称为低聚原花青素,大于5 倍体的称为高聚原花青素。体外药理试验表明,原花青素是一种高效的抗氧化剂,它的抗自由基氧化能力是维生素E 的50 倍,维生素C 的20 倍,并且它在体内的半衰期长达6.67±0.95 h[11,12]。原花青素类化合物主要存在于大多数植物的果实、种子等组织中,对植物有着重要的保护作用[13]。沙棘果实被工业利用后的渣粕中仍含有较高的原花青素,以沙棘籽粕为原料研究原花青素的提取工艺,对沙棘资源的开发具有一定意义。
目前,以沙棘籽粕为原料进行原花青素的提取工艺研究较少,金海英[14]等研究了沙棘籽原花青素提取的单因素实验,张弛[15]等对沙棘果原花青素的分离纯化进行了研究,梅金龙[16]等研究了沙棘籽粕原花青素提取纯化工艺。此外,禹华娟[17]等研究了莲房原花青素的酶辅助提取工艺。纤维素酶协同超声对沙棘籽粕原花青素的提取相关工艺未见报道。因此,本研究拟研究纤维素酶协同超声提取沙棘籽粕原花青素的工艺,采用香草醛-盐酸法[18]测定原花青素的含量并计算原花青素提取得率。通过单因素及响应面法对原花青素的提取工艺进行筛选优化,为沙棘籽粕原花青素的生产利用提供一定的理论基础。
1 材料与方法
1.1 材料、仪器与试剂
沙棘籽粕,于2013年取自青海康普生物科技股份有限公司提取籽油后籽粕;儿茶素标准品,购自成都曼思特生物科技有限公司;纤维素酶,BBL 公司,酶活力15000 U/g。
UV-759 型紫外-可见光分光光度计、PHS-3C 型pH 计,上海精密科学仪器有限公司;优普超纯水器,成都超纯水有限公司;超微粉碎机,浙江省温岭市创力药材器械厂。
甲醇、盐酸、香草醛均为分析纯,天津百世化工有限公司。
1.2 方法
1.2.1 材料制备
将沙棘籽粕粉碎过60 目筛,得到试验材料,放置于冰箱冷冻备用。
1.2.2 原花青素含量的测定[18]
1.2.2.1 标准曲线的绘制
配制儿茶素标准溶液,浓度为1.2 mg/mL。分别量取1.0、2.0、3.0、4.0、5.0 mL,然后定容至10 mL。准确量取各浓度儿茶素标准溶液1.0 mL,加入1%香草醛甲醇溶液2.5 mL 和8%盐酸甲醇溶液2.5 mL,摇匀,避光,在30±1 ℃下,恒温水浴保持30 min 后取出,用分光光度法在500 nm 波长下,测定其吸光值,得回归方程为y=0.38x +0.02,R=0.9994,线性范围为0.12~0.62 mg/mL。
1.2.2.2 样品测定
准确称取1.000 g 左右沙棘籽粕粉末,加入一定体积的甲醇,按各方案进行提取后,4000 rpm 离心15 min,取上清1.0 mL,按上述测定方法进行保温比色,并按标准曲线回归方程对原花青素提取得率进行计算。
1.2.3 试验设计方法
该研究通过料液比、提取时间、提取次数、酶的用量和提取液pH 等因素的试验结果,筛选出对沙棘籽粕原花青素提取工艺影响较大的因素,进行Box-Behnken 中心组合试验设计(见表1)。
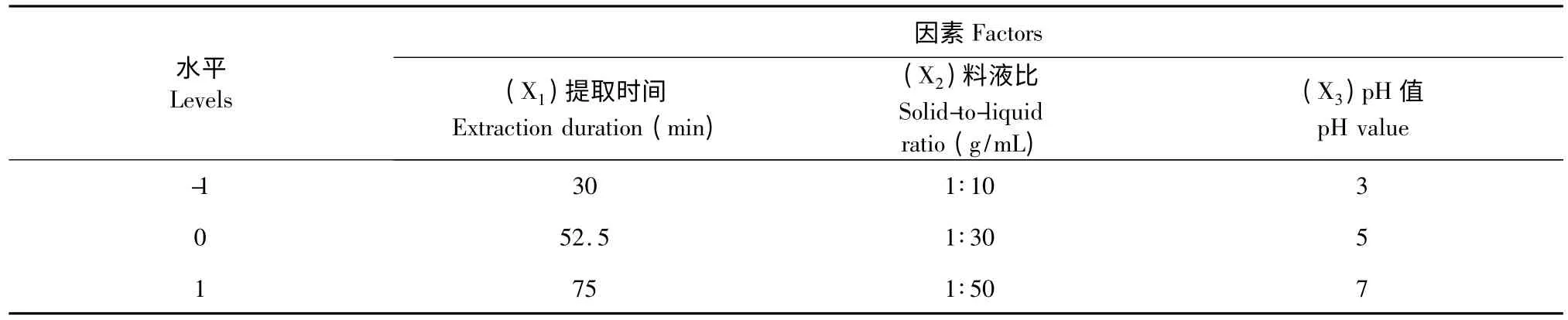
表1 Box-Behnken 设计因素与水平Table 1 Factors and levels in Box-Behnken design
2 结果与分析
2.1 单因素试验结果与分析
2.1.1 料液比对沙棘籽粕原花青素提取得率的影响
沙棘籽粕原花青素的提取过程中,设置不同的料液比,在室温下,甲醇溶液超声辅助提取45 min,研究料液比对原花青素提取的影响,结果见图1A。原花青素的提取得率随着料液比的增加而呈现增加的趋势,其中料液比为1∶30 g/mL 时,原花青素提取得率较高,而后变化趋势不明显。因此选取料液比1∶30 g/mL 进行其他单因素试验。
2.1.2 提取时间对沙棘籽粕原花青素提取得率的影响
沙棘籽粕原花青素的提取过程中,设置不同的提取时间,在室温下,料液比为1∶30 g/mL,甲醇超声辅助提取,研究提取时间对原花青素提取的影响,结果见图1B。原花青素的提取得率随提取时间的增加有一定的增加,45 min 前变化趋势较为明显,而后变化趋于平缓。因此,选择甲醇超声辅助提取时间45 min、料液比1∶30 g/mL 进行其他单因素试验。
2.1.3 提取次数对沙棘籽粕原花青素提取得率的影响
沙棘籽粕原花青素的提取过程中,考虑不同的提取次数,在室温下,料液比为1∶30 g/mL,甲醇超声辅助提取45 min,研究提取次数对沙棘籽粕原花青素提取的影响,结果见图1C。原花青素的提取得率对提取次数的增加有一定的变化,但变化趋势较为不明显,尤其是提取3 次以上几乎无差异,因此,甲醇超声辅助提取3 次、每次45min、料液比1∶30 g/mL 进行其他单因素试验。
2.1.4 酶的用量对沙棘籽粕原花青素提取得率的影响
试验选用纤维素酶协同甲醇超声提取沙棘籽粕中的原花青素,考虑不同纤维素酶的用量,在室温下,料液比为1 ∶30 g/mL,甲醇超声辅助提取45 min,研究酶的用量对沙棘籽粕原花青素提取的影响,结果见图1D。沙棘籽粕中,原花青素需突破细胞壁的束缚才能进入提取溶剂中,细胞壁的主要成分之一即为纤维素,它在纤维素酶的催化作用下,可快速降解,使细胞壁出现裂解的现象,使原花青素更易进入提取溶剂中,提高其提取得率[19]。试验结果表明,在纤维素酶的作用下,原花青素的提取得率有明显的提高,但当酶的用量达到3%(每1 g 原料添加0.03 g 纤维素酶,下同)后,原花青素的提取得率无明显变化。因此,选择甲醇超声辅助提取3 次、每次45 min、料液比1∶30 g/mL 和酶的用量为3%进行其他单因素试验。
2.1.5 提取液pH 对沙棘籽粕原花青素提取得率的影响
试验选用纤维素酶协助甲醇超声提取沙棘籽粕中的原花青素,而酶活力容易受到pH 影响。因此,在提取过程中,考虑提取液pH,在室温下,甲醇超声辅助提取3 次、每次45 min、料液比1∶30 g/mL 和酶的用量为3%,研究提取液pH 对沙棘籽粕原花青素提取的影响,结果见图1E。试验表明,当pH 小于3或大于7 时,原花青素的提取得率均处于较低水平,而当pH 为5 时,原花青素的提取得率最高,且表明pH 对原花青素提取得率影响较大,其原因可能与提取液pH 对纤维素酶的影响有关,纤维素酶的最佳pH 在4.0~5.5 之间[20]。当提取液pH 过酸和过碱,均使纤维素酶不能具有较高的催化效率,而影响原花青素的提取得率。
2.2 响应面法试验设计及结果
2.2.1 分析单因素结果显示
甲醇超声辅助提取3 次、酶的用量为3%时沙棘籽粕原花青素有最大的提取率。沙棘籽粕原花青素提取的响应面试验设计及试验结果见表2,结合Box-Behnken 中心组合实验设计原理,按照表1 对提取时间、料液比和提取液pH 作变换,以原花青素提取得率为响应值(Y),共17 个试验点,其中1~12 组为析因试验,13~17 组为中心试验,用来分析试验误差。
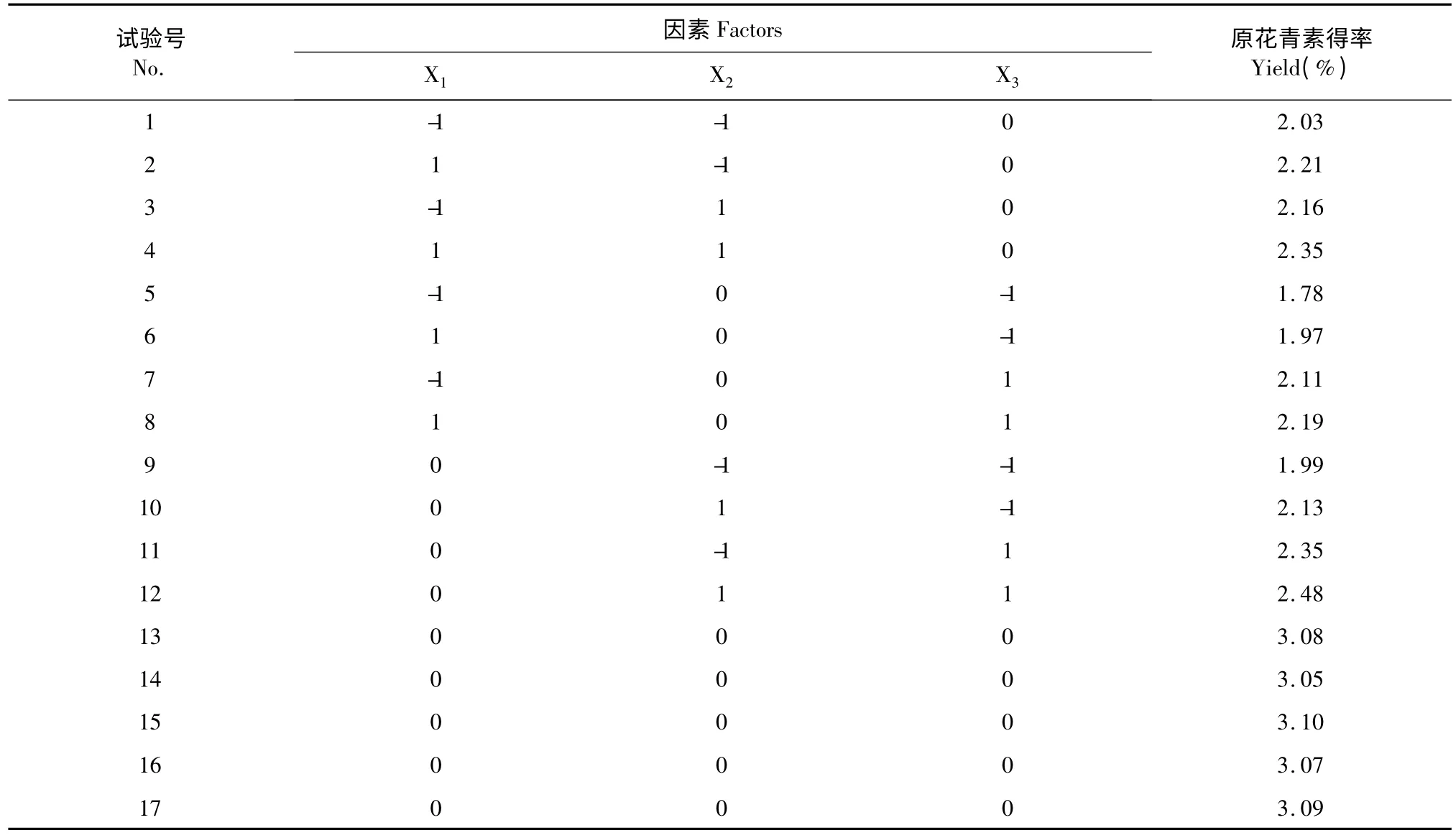
表2 原花青素提取得率试验设计及结果Table 2 Design and results of response surface analysis for the optimization of extraction conditions of PC
采用Design Expert 8.05b 软件对沙棘原花青素提取得率数据进行回归拟合分析,得回归方程:原花青素提取得率Y=3.08+0.080X1+0.068X2+0.16X3+2.5 ×10-3X1X2-0.027X1X3-2.5 ×10-3X2X3-。
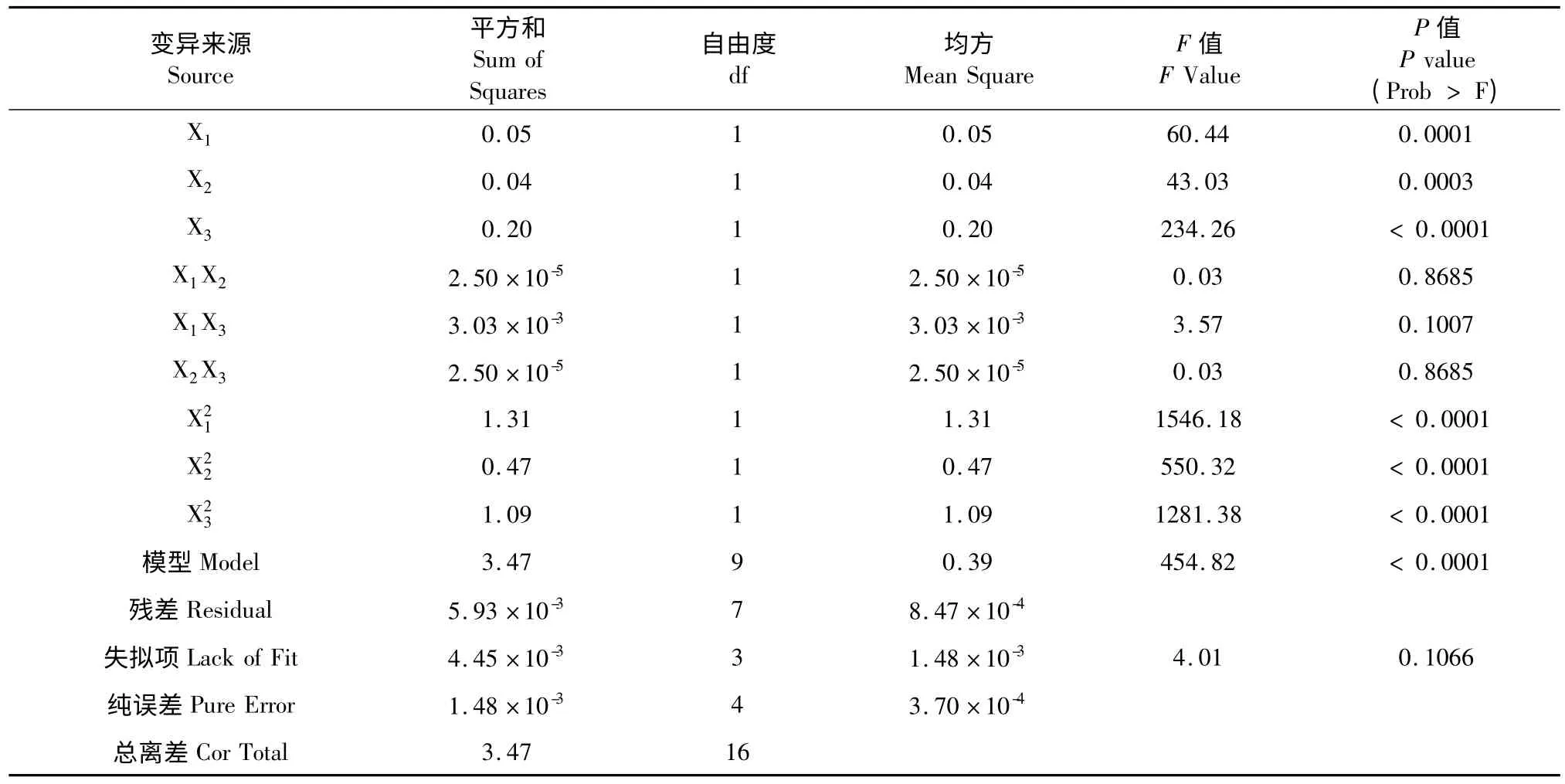
表3 方差分析结果Table 3 ANOVA of regression analysis
2.2.2 模型的显著性检验
从回归模型方差分析(表3)可见,试验选用的模型极显著(P<0.0001),失拟项不显著P=0.1066>0.05,说明模型是适合的;模型的校正决定系数=0.9961,说明该模型能解释99.61%响应值的变化,仅有总变异大约0.39%不能用该模型进行解释;相关系数R2=0.9983,说明该模型拟合程度较好,预测值与实测值之间有较好的相关性,试验误差小,可以用该模型来分析和预测沙棘籽粕原花青素的提取得率。
由表3 方差分析结果可知,在此试验设计中,一次项X1、X2、X3均极显著(P<0.01),二次项X1X2、X2X3、X1X3均不显著(P>0.05),均极显著(P<0.01)。
2.2.3 响应面交互作用分析
回归模型的响应面及其等高线见图2,3 组图直观地反映了各因素对响应值的影响。由三组图对比可知,提取液pH(X3)对沙棘籽粕原花青素提取得率影响最为显著,表现为图2B1、2C1 的曲面较陡。等高线的形状可反映出交互效应的强弱,椭圆表示两因素交互作用显著,圆形则相反。由图2B2、2C2等高线可得知,提取时间与pH 值和料液比与pH 值的交互作用较为明显,表现为等高线略成椭圆形。相比而言,提取时间与料液比之间的交互作用稍弱。
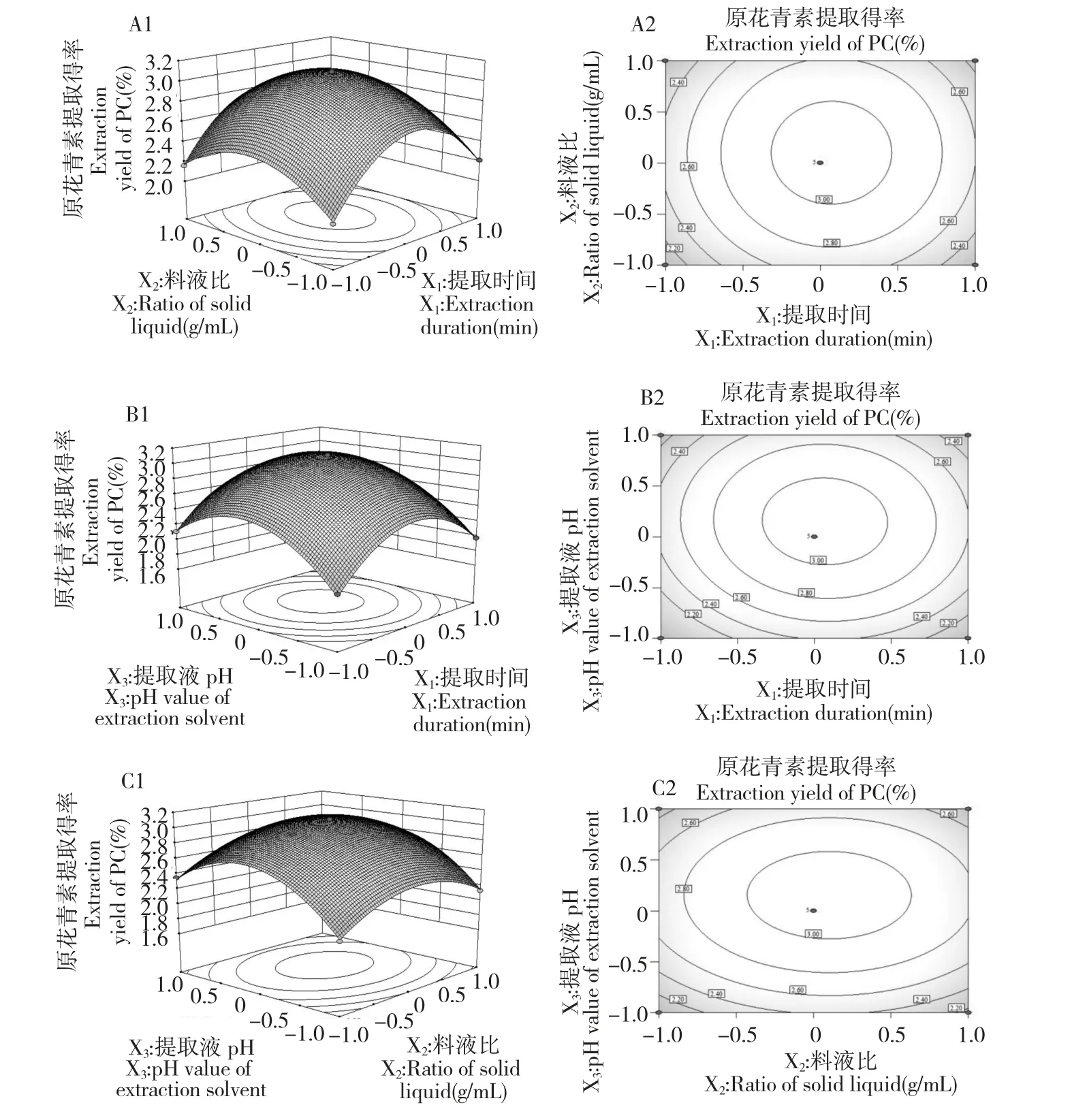
图2 提取时间(X1)与料液比(X2)、提取时间(X1)与提取液pH(X3)及提取时间(X1)与提取液pH(X3)交互作用响应面图(A1、B1、C1)与等高线图(A2、B2、C2)Fig.2 Responsive surface plots (A1、B1、C1)and contour plots (A2、B2、C2)showing the mutual effects of extraction duration(X1)and ratio of solid to liquid (X2),extraction duration (X1)and pH value of extraction solvent (X3),ratio of solid to liquid (X2)and pH value of extraction solvent (X3)on the yield of PC
2.2.4 最优提取工艺参数
通过Design-Expert8.05b 软件求解回归方程得出的最佳提取工艺参数为:纤维素酶协同甲醇超声提取,超声功率250 W,室温下,酶的用量为3%,提取时间54.02 min,料液比32.01 g/mL,pH 值为5.31 提取3 次,测定并计算原花青素提取得率。综合考虑试验的操作性、效率和成本等,将沙棘籽粕原花青素提取工艺参数修正为:纤维素酶协同甲醇超声提取,超声功率250 W,室温下,酶的用量为3%,提取时间55 min,料液比1∶30 g/mL,pH 值为5.0,提取3 次,此条件下,沙棘籽粕原花青素提取得率的理论值达到3.09%。
2.2.5 试验模型的验证和比较
按照模型得到的最优提取参数与实践过程中的简便性得到的最终条件验证试验模型。试验结果表明,模型提取参数按实际操作简化后实际提取得率为(3.07±0.0080)%,与理论最大值非常接近,说明该模型可以较好的反映沙棘籽粕原花青素的提取参数,也说明用响应面法对原花青素提取得率进行参数优化是可行的。
3 结论
利用纤维素酶协同甲醇超声辅助提取沙棘籽粕原花青素,通过单因素试验筛选出料液比、提取时间和提取液pH 值对原花青素提取得率的影响较为明显,进一步根据Box-Benhnken 原理进行响应面试验设计,优化沙棘籽粕原花青素提取的最佳工艺参数,并进行稳定性的检验。根据响应面分析模型方程Y=3.08+0.080X1+0.068X2+0.16X3+2.510-3,得出沙棘籽粕原花青素的最佳提取工艺参数:纤维素酶协同甲醇超声提取,超声功率250 W,室温下,酶的用量为3%,提取时间55 min,料液比1∶30 g/mL,pH 值为5.0,提取3 次。在此条件下,沙棘籽粕原花青素提取得率为3.07%。该研究通过单因素及响应面法对原花青素的提取工艺参数进行优化筛选,为沙棘籽粕中原花青素的生产利用提供一定的理论基础。
1 Chen XW(陈修文),Zhao HL(赵宏利).Development and utilization of sea buckthorn resources in qinghai province.Nat Res(自然资源),1992,6:47-51.
2 Wu AH(武挨厚),Mi L(米拉),Dong QJ(董交其),et al.Nutritive value of Hippophae rhomnoides fruit residue and its application.J Inner Mongolia Instit Agric Animal Husb (内蒙古农牧学院学报),1993,1:50-54.
3 Gao X,Ohlander M,Jeppsson N,et al.Changes in antioxidant effects and their relationship to phytonutrients in fruits of sea buckthorn (Hippophae rhamnoides L.)during maturation.J Agric Food Chem,2000,48:1485-1490.
4 Suryakumar G,Gupta A.Medicinal and therapeutic potential of Sea buckthorn (Hippophae rhamnoides L.).J Ethnopharmacol,2011,138:268-278.
5 Panossian A,Wagner H.From traditional to evidence-based use of Hippophaë rhamnoides L.:chemical composition,experimental,and clinical pharmacology of sea buckthorn berries and leaves extracts.Evid Rational Based Res Chin Drugs,2013:181-236.
6 Al-malki AL,Sayed AAR,El Rabey HA.Proanthocyanidin attenuation of oxidative stress and NF-κB protects apolipoprotein E-deficient mice against diabetic nephropathy.Evid-Based Comple Alter Med,2013,2013:1-8.
7 Gentile C,Allegra M,Angileri F,et al.Polymeric proanthocyanidins from Sicilian pistachio (Pistacia vera L.)nut extract inhibit lipopolysaccharide-induced inflammatory response in RAW 264.7 cells.Eu J Nutri,2012,51:353-363.
8 A-sowayan NS,Kishore U.Prophylactic efficacy of a combination of proanthocyanidin and vitamin E on hepatotoxicity induced by doxorubicin in rats.Int J Pharm,2012,2:161-169.
9 Shin MO,Yoon S,Moon JO.The proanthocyanidins inhibit dimethylnitrosamine-induced liver damage in rats.Arch Pharmacol Res,2010,33:167-173.
10 Hummer W,Schreier P.Analysis of proanthocyanidins.Mole Nutri Food Res,2008,52:1381-1398.
11 Bagchi D,Garg A,Krohn R,et al.Oxygen free radical scavenging abilities of vitamins C and E,and a grape seed proanthocyanidin extract in vitro.Res Commun Mole Pathol Pharmacol,1997,95:179-189.
12 Stoupi S,Williamson G,Viton F,et al.In vivo bioavailability,absorption,excretion,and pharmacokinetics of[14C]procyanidin B2 in male rats.Drug Metabol Dispos,2010,38:287-291.
13 Deprez S,Brezillon C,Rabot S,et al.Polymeric proanthocyanidins are catabolized by human colonic microflora into lowmolecular-weight phenolic acids.J Nutri,2000,130:2733-2738.
14 Jin HY(金海英).Single-factor tests extraction of proanthocyanidins from Hippophae rhamnoides seed.Hippophae(沙棘),2006,18(4):29-32.
15 Zhang C(张驰),Xu XY (徐晓云),Pan SY (潘思轶).Study on isolation and purification of procyanidins from seabuckthorn Fruit.Food Sci (食品科学),2005,26:183-185.
16 Mei JL (梅金龙),Hu CY(胡长鹰),et al.Extraction and purification of procyanidine from sea buckthorn seed meal.China Oils Fats(中国油脂),2010,7(35):50-53.
17 Yu HJ (禹华娟),Sun ZD (孙智达),Xie BJ (谢笔钧).Enzyme assistant extraction of procyanidins from seedpod of lotus and the comparison of antioxidant activity.Nat Prod ResDev (天然产物研究与开发),2010,22:154-158.
18 Li CY (李春阳),Xu SY (许时婴),Wang Z (王璋).Vanillin-HCl assay for the proanthocyanidins content of grape seed and stem.Food Sci (食品科学),2004,35:157-161.
19 Pettersson G.Structure and function of a cellulase fromPenicillium notatum as studied by chemical modification and solvent accessibility.Arch Biochem Biophysics,1968,126:776-784.
20 Ingram L,Gomez P,et al.Metabolic engineering of bacteria for ethanol production.Biotechnol Bioeng,1998,58:204-214.

