叉枝鸦葱总黄酮清除DPPH 自由基活性研究
马国财,赵丽娜,白红进
1塔里木大学生命科学学院 新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室;2 塔里木大学分析测试中心,阿拉尔 843300
叉枝鸦葱(Scorzonera divaricata)俗称碱草,系菊科鸦葱属植物,多生于草原、半荒漠和荒漠地带,能够固定沙丘、戈壁和干河床上。全草入药,能清热解毒,主治疗毒恶疮[1]。目前,鸦葱属植物关于化学成分的研究文献较多,主要有挥发油、无机物质、氨基酸、萜类、甾体类、鞣质、黄酮类化合物等[2-9],文献对叉枝鸦葱的研究报道较少。陶大勇[2]等采用分光光度法测定了塔里木盆地叉枝鸦葱中鞣质的含量,陈瑛[3]等对叉枝鸦葱有机溶剂提取物中生物碱进行了测定,二者都没有对其所含的鞣质和生物碱单体化合物进行进一步的分离与检测。
Harman[10]提出的自由基学说认为:自由基攻击生命大分子造成的损伤是引起衰老的根本原因,也是诱发肿瘤等疾病的重要原因,这一学说已经广泛的被人们所日益接受。近二十年来,对自由基及其清除率的研究已经成为天然产物研究的热点,各国研究人员越来越多的将注意力集中于筛选有阻断自由基形成或抑制细胞过氧化活性的天然药物研究,其中对黄酮类化合物的研究是自由基清除剂研究的热门领域之一[11]。
本文利用紫外-可见分光光度法对叉枝鸦葱全草中总黄酮清除DPPH 自由基活性进行研究,为叉枝鸦葱的合理开发利用和提高其生物利用度提供了科学依据。
1 仪器与材料
1.1 仪器
CARY-100 紫外可见光分光光度计(澳大利亚VARIAN 公司);KQ-400KDE 台式通用超声波清洗器(昆山市超声仪器有限公司);JA1203 电子天平(上海恒平科学仪器有限公司)。
1.2 试剂
芦丁对照品(德国Dr.Ehrdnstorfer 公司 批号:60922);DPPH 自由基(和光纯药工业株式会社,批号:ALL1930);乙醇,硝酸铝,氢氧化钠,亚硝酸钠,三氯化铝等,均为国产分析纯。
1.3 材料
叉枝芽葱于2009年5 月,采集于新疆建设兵团第四十五团。自然阴干,粉碎,过60 目筛,待用。经塔里木大学植物科学学院刘艳萍副教授鉴定为菊科(Compositae)鸦葱属(Scorzonera)叉枝鸦葱(Scorzonera divaricata)植物。
2 实验方法
2.1 叉枝鸦葱总黄酮提取
精密称取叉枝鸦葱粉末1.000 g,加65%乙醇20 mL,微波提取20 min,功率40 W,滤过,残渣再加入65%乙醇20 mL,重复提取2 次,过滤,合并滤液,定容于100 mL 容量瓶中,备用。
2.2 芦丁对照品溶液的制备
精密称取120 ℃干燥至恒重的芦丁对照品13.60 mg 置50 mL 容量瓶中,加65%乙醇20 mL,超声使溶解,再加65%乙醇定容至刻度,摇匀即得。芦丁对照品浓度为0.272 mg/mL,备用。
2.3 显色条件的考察[12]
2.3.1 显色系统的筛选
方法1:分别精密吸取0.5 mL 的芦丁标准品溶液和2 mL 样品溶液于10 mL 容量瓶中,加0.1 mol/L 的AlCl3溶液2 mL,摇匀,放置6 min;再加入1 mol/L 的4% NaoH 溶液3 mL,用65%乙醇溶液定容,摇匀,放置10 min,测定。
方法2:分别精密吸取0.5 mol 的芦丁标准溶液和2 mL 的样品溶液于10 mL 容量瓶中,加5%NaNO2溶液0.4 mL 摇匀,放置6 min;加10% Al(NO3)30.4 mL,摇匀,放置6min;再加4% NaOH 溶液4 mL,65%乙醇定容,摇匀,放置10 min,测定。
结果表明:方法2 显色灵敏、稳定,故采用NaNO2-Al(NO3)3-NaOH 为显色系统
2.3.2 最大吸收波长的确定
精密称取芦丁对照品溶液0.5 mL 和2.1 项下样品溶液2 mL 分别置于10 mL 容量瓶中,加65%乙醇至3 mL,按2.3.1 项下方法2 进行显色,测定。以65%乙醇平行实验为空白参比,于400~800 nm波长范围内扫描。
2.4 标准曲线的绘制[13]
精密吸取芦丁对照品溶液0.0、1.0、2.0、3.0、4.0、5.0、6.0 mL,分别置于容量瓶中,按2.3.1 项下方法2 操作,以第一份溶液为空白,在501 nm 处测定吸光度。吸光度(A)为纵坐标,浓度(C)为横坐标,绘制标准曲线。得回归方程A=0.0124X-0.0322(r=0.9996),表明芦丁在27.2~163.2 μg/mL 范围内与吸光度值线性关系良好。
2.5 叉枝鸦葱总黄酮清除DPPH 的反应动力学研究
将2 mL 不同浓度叉枝鸦葱总黄酮提取液与2 mL、40 μg/mL 的DPPH 自由基反应,以相同浓度的芦丁和VC 为对照,测定不同反应时间的吸光度,研究不同浓度叉枝鸦葱总黄酮与DPPH 自由基反应随时间推移的动力学关系,以时间为横坐标,吸光度为纵坐标绘制不同浓度的叉枝鸦葱总黄酮与DPPH 自由基随时间推移的动力学关系曲线图。
2.6 叉枝鸦葱总黄酮对DPPH 自由基的清除率[14,15]
在叉枝鸦葱总黄酮清除自由基的反应动力学研究的基础上,测定反应平衡时的吸光度,按下式计算不同浓度叉枝鸦葱总黄酮对DPPH 自由基的清除率:K=[1-(Ai-Aj)/Ac]×100%。式中,K 为叉枝鸦葱总黄酮对DPPH 自由基的清除率,Ai 为加式样反应后DPPH 溶液的吸光度Aj 为不加DPPH,只加式样的溶液的吸光度;Ac 为不加式样,只加DPPH的溶液的吸光度。

图1 芦丁和样品的吸收曲线Fig.1 Absorption curves of rutin and sample

图2 DPPH 吸收光谱Fig.2 DPPH absorption spectrum
2.7 叉枝鸦葱总黄酮清除DPPH 自由基的IC50值的计算
IC50为半数抑制率浓度,即自由基清除率为50%时的自由基清除剂的浓度。运用Graphpad Prism 5.0 计算IC50。
3 结果与分析
3.1 最大吸收波长的确定
对照品和样品溶液均在501 nm 波长处有最大吸收峰,故以501 nm 为测定波长(见图1)。
3.2 叉枝鸦葱总黄酮的提取
经测定,叉枝鸦葱总黄酮提取率为2.79 g/100g。
3.3 波长-吸光度之间的关系
测定在乙醇-水介质中的活性时,选择测定波长为517 nm(见图2)。
3.4 叉枝鸦葱总黄酮清除DPPH 自由基的反应动力学研究结果
不同浓度叉枝鸦葱总黄酮清除DPPH 自由基的反应动力学曲线图(见图3)。同时采用Graphpad Prism 5.0 对实验数据进行方程拟合,数学模型为:Y=(Y0-NS)* exp(-K* X)+NS,其中:Y0 表示最大吸光度;NS 表示当时间达到一定量时,吸光度的最小极值;K 表示吸光度与时间对应的斜率。拟合曲线方程各项数据(见表1),并归纳5 组拟合曲线方程(见表2)。
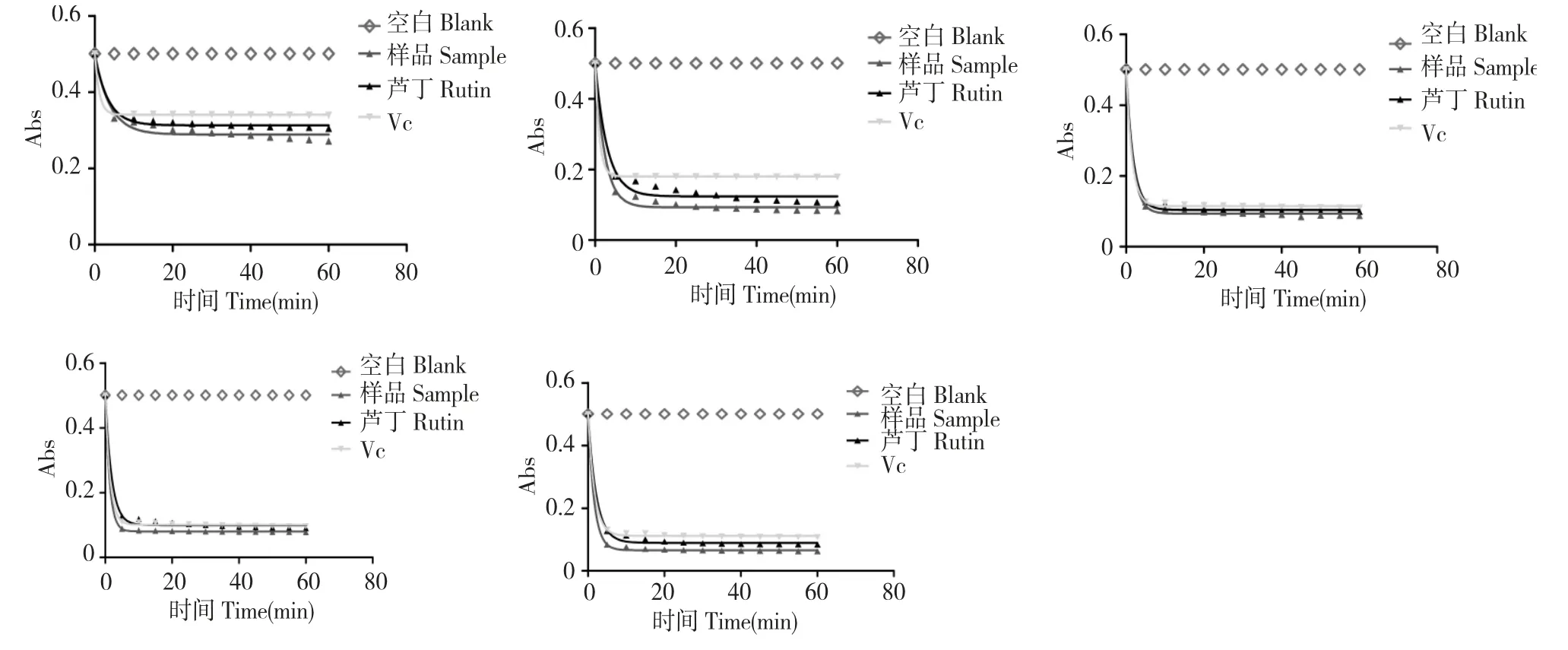
图3 各浓度拟合曲线图Fig.3 Fitting kinetic curves of different concentrations

表1 动力学数据结果Table 1 Results of kinetics data
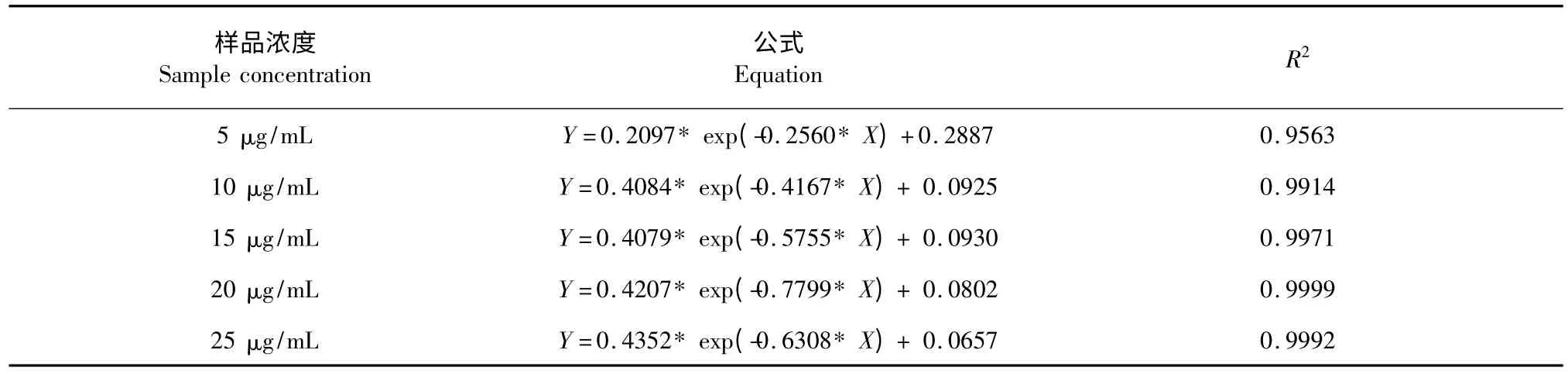
表2 动力学曲线方程Table 2 Kinetic curve equation
从图3 可以看出,不加样品的DPPH 自由基随时间的延长其吸光度没有变化,说明DDPH 是一种稳定的自由基,而加入不同浓度叉枝鸦葱总黄酮的DPPH 自由基的吸光度随时间的延长而逐渐降低。在反应前5 min 吸光度下降很快,5 min 后,吸光度下降缓慢,在30~45min 内反应达到基本平衡,该体系的吸光度不再下降。但当叉枝鸦葱总黄酮浓度越高时,反应达到平衡的时间越短,对照芦丁、VC亦表现出同样的反应规律。
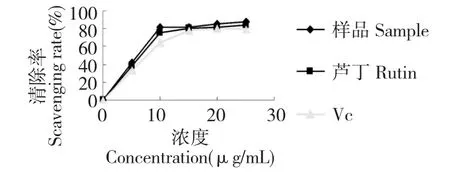
图4 叉枝鸦葱总黄酮对DPPH 自由基清除率Fig.4 Scavenging rate of flavonoids from S.divaricata on DPPH free radical
3.5 对DPPH 自由基清除率
由图4 可以看出,叉枝鸦葱总黄酮对DPPH 自由基有明显的清除作用,在5~25 μg/mL 的浓度范围内,叉枝鸦葱总黄酮清除DPPH 自由基的能力为41.72%~87.72%。随着浓度的增加,其对DPPH自由基的清除能力增强,对DPPH 自由基的清除具量效关系。同芦丁、VC相比,叉枝鸦葱总黄酮对DPPH 自由基的清除率明显偏高于芦丁和VC。
3.6 清除DPPH 自由基的IC50值
经计算,叉枝鸦葱总黄酮清除DPPH 的IC50值为5.6 μg/mL,大于芦丁IC506.2 μg/mL 和Vc 的IC507.3 μg/mL。说明叉枝鸦葱总黄酮清除DPPH自由基的效果好于二者。
4 讨论
叉枝鸦葱总黄酮清除DPPH 自由基的反应动力学研究,根据公式:Y=(Y0-NS)* exp(-K* X)+NS,进行求导,其中一阶导数Y'=-(Y0-NS)* K*exp-kx<0(恒小于零)说明:吸光度随着时间的增加而减少,而当时间趋于无穷大时,吸光度无限趋近于NS 值。对其进行二阶求导,其导数为:Y″=(Y0-NS)* K2* exp-KX>0(恒大于零),说明:吸光度随时间的增加的变化率减小,而当时间趋于无穷大时吸光度随时间的变化率趋于不变,接近于零值。
根据5、10、15、20、25 μg/mL 拟合曲线图分析可知,随着样品浓度的增加,NS 值逐渐减小,说明样品浓度对DPPH 的抗氧化性不断增强。
从动力学数据可以看出,当样品浓度在5、10、15、20、25 μg/mL 时,所得五个具体曲线方程中Y0值与实际反应值,随着浓度的增加,差值从0.0025变成零,说明该五组方程表达式均能很好的表达各个浓度样品的实际反应过程。一个模型五组方程不但本身线性相关性很强,回归效果好,由于动力学模型方程经参数估值后所得的模拟计算值与实验值吻合较好,可以作为优化工艺条件的控制依据。
叉枝鸦葱总黄酮对DPPH 自由基有明显的清除作用,清除DPPH 自由基的能力随着浓度的增加而增加,并对DPPH 自由基的清除率具有量效关系。叉枝鸦葱总黄酮清除DPPH 自由基的IC50值为5.6 μg/mL,是一种有效的自由基清除剂。
1 China Flora Editorial Board of Chinese Academy of Sciences(中国科学院中国植物志编辑委员会).Flora of China(中国植物志).Beijing:Science Publishing House,1997.80(1):13-36.
2 Tao DY(陶大勇),Li SW (李树伟),Ren DQ(任道泉),et al.Detections and analysis to aecidium tannicum content of Scoizonera divaricata in Tarim basin.J Tar Univ Agri Recl(塔里木农垦大学学报),2004,16(4):5-8.
3 Chen Y(陈瑛),Tao DY(陶大勇),Jiang T(蒋涛),et al.Survey of the content of alkaloid in four kinds of desert plants.J Tar Univ(塔里木大学学报),2005,17:19-21.
4 Wang B(王斌),Li GQ(李国强)Guan HS (管华诗).Analysis of volatile oils and inorganic element of Scorzonera Mongolica maxim by GC-MS and ICP-MS.Lishizhen Med Mater Med Res(时珍国医国药),2007,18:2364-2365.
5 Wang GS(王广树),Zhang MX(张沐新),Zhou XP(周小平).Chemical constituents of whole plant of Scorzonera diata Fisch.J Med Chem (中国药物化学杂志),2010,20:527-530.
6 Zhao RJ(赵瑞建).Research on phytochemical constituents in Senecio nemorensis L.and Scorzonera.Jinan:Shandong University(山东大学),MSc.2007.
7 Li J(李娟),Wu QX(武全香),Shi YP(石艳萍),et al.A new sesquiterpene lactone from Scorzonera austriaca.Chin Chem Lett(中国化学快报),2004,15:1309-1310.
8 He L(何琭).Studies on flavonoids of Scorzonera austriaca Willd.Changchun:Jilin University(吉林大学),MSc.2012.
9 Menichini F,Statti G,Monache DF.Flavonoid glycosides from Scorzonera columnae.Fitoterapia,1994,64:555-556.
10 Song Y(宋彦),Dong YM(董银卯),Wang YS(王友升),etal.Study on the extraction technique for free radical scavenging substance from pogadatree flower (Sopho rajaponica L.).J Anhui Agric Sci(安徽农业科学),2009,37:2049-2053.
11 Cheng XY (成喜雨),Cui X (崔馨),Liu CZ(刘春朝),et al.Recent advances of antioxidant activity of Chinese herbal medicine.Nat Prod Res Dev(天然产物研究与开发),2006,18:514-518.
12 Zhou GF(周桂芬),Zhang H(张涵),Lv GY(吕圭源).Determination of total flavonoids in Sonchus oleraceus by spectroscopy.Chin Arch Tradit Chin Med (中华医药学刊),2008,26:218-220.
13 Zhang ZG(张志国),Chen JP(陈锦屏),Shao XZ(邵秀芝).Study on DPPH free radical scavenging efficiency of flavonoids from Jujube Pit.Food Sci (食品科学),2007,28(2):67-70.
14 Ma QY(马庆一),Zhang X(张侠),Xiong WD(熊卫东),et al.Study on free radical scavenging efficiency of sweet potato stems.Food Sci(食品科学),2003.24:145-148.
15 Chen Y(陈奕),Xie MY(谢明勇),Gong XF(弓晓峰).DPPH radical scavenging effect of Ganoderma atrum.Nat Prod Res Dev(天然产物研究与开发),2006,18:917-921.

