黑果腺肋花楸花色苷树脂纯化工艺及其稳定性研究
国石磊,朱凤妹,王 娜,张永祥,李 军
河北科技师范学院食品科技学院 河北省果品加工工程技术研究中心,秦皇岛 066600
黑果腺肋花楸(Aronia melanocarpa)属蔷薇科,原产于美国东北部,果皮为紫黑色,果汁为暗宝石红色,美国和欧洲国家把黑果腺类花楸作为民间的药材有很长的历史,果实中含有大量的花色苷类物质[1,2]。食用色素是现代食品工业中的一种重要的食品添加剂,随着科技的发展和人民生活水平的提高,天然色素的市场需求量不断增大。花色苷由于其特有的性质可作为天然的着色剂应用于果汁、果酒领域中[3-5],而花色苷也具有抗氧化、抗癌、抗炎、抗血栓以及降血脂等多种生物活性[6-10]。李梦莎[11]采用超声波辅助提取方法提取了黑果腺肋花楸中的花色苷,并用响应面法优化了提取工艺,最优条件下花色苷提取量是39.80 mg/g。Oszmianski J[12]等研究表明,黑果腺肋花楸花色苷占果实酚类化合物的25%左右,果实中含有4 种花色苷单体,即矢车菊素-3-阿拉伯糖苷、矢车菊素-3-葡萄糖苷、矢车菊素-3-半乳糖苷和矢车菊素-3-木糖苷。大孔树脂吸附纯化法是目前纯化花色苷类色素常用的方法,具有成本低、效率高、操作简单方便等优点[13,14]。
本实验目的在于研究黑果腺肋花楸花色苷纯化工艺及其稳定性,比较几种大孔吸附树脂对黑果腺肋花楸花色苷的吸附解吸效果,筛选出最适的树脂类型进行动态吸附-解吸实验,提高花色苷纯度。研究其在光照、温度、pH 值、金属离子和氧化剂、还原剂的干预下花色苷性质的改变,根据其稳定性差异探寻黑果腺肋花楸花色苷的保存条件。
1 材料与仪器
黑果腺肋花楸由辽宁省海城市世富集团提供,-20 ℃储存;无水乙醇、浓盐酸、NaCl、FeSO4、ZnSO4、MgSO4、MnCl2、CuSO4、Alcl3、FeCl3·6H2O、H2O2、Na2SO3、苯甲酸钠、柠檬酸、酒石酸、抗坏血酸、磷酸二氢钠、柠檬酸均为国产分析纯;去离子水;BS-80、D101、AB-8、HP-20、HPD-100 大孔吸附树脂,沧州宝恩化工有限公司。
UV765 紫外可见分光光度计,上海仪电分析仪器有限公司制造;低速台式大容量离心机,无锡市瑞江分析仪器有限公司;KQ5200DB 型数控超声波清洗器,昆山市超声仪器有限公司;MS204S/01 型电子天平,梅特勒-托利多仪器(瑞士)有限公司;N-1100旋转蒸发器,日本EYELA;冷冻干燥机,日本EYELA。
2 实验方法
2.1 黑果腺肋花楸花色苷的提取
以40%的乙醇溶液(含0.1%乙酸)为提取液,提取温度43 ℃、超声提取时间23 min、液料比89∶1 mL/g,提取完成后先过滤去皮渣,再以7000 rpm 离心去沉淀,40 ℃旋转蒸发至膏状,冷冻干燥得到紫黑色粉末,备用。
2.2 黑果腺肋花楸花色苷纯化方法
2.2.1 大孔吸附树脂的预处理[15]
取5 种适量大孔吸附树脂,用无水乙醇浸泡24 h 后用蒸馏水反复洗至树脂无醇味,用质量分数为2%的NaOH 溶液浸泡3 h,蒸馏水洗至中性,再用质量分数为0.5 %的HCl 溶液浸泡3h,蒸馏水洗至中性装柱备用。
2.2.2 大孔吸附树脂的筛选
分别称取1.000 g 经预处理后的树脂于100 mL具塞锥形瓶中,加入25 mL 等质量浓度花色苷液,封口,室温条件下遮光振荡(100 rpm)。每隔0.5 h 吸取上清液2 mL 于520 nm 波长处测定吸光度,测定后倒回锥形瓶,直到数值稳定;准确称取已吸附饱和的树脂1.000 g 于锥形瓶中。用体积分数为40%乙醇溶液(0.1% 乙酸)分次洗脱,每次洗脱振荡30 min,速率为100 rpm,洗脱剂用量25 mL。过滤,以相应溶剂作为空白,处测定滤液吸光度A,A 总表示梯度洗脱液吸光度累加,以参数A 总来评价树脂的解吸效果。吸附率E1/%=[(A0V0-A1V1)/A0V0]× 100,解吸率E2/%=[A2V2/(A0V0-A1V1)]×100,其中A0、A1和A2分别为上样液吸附前、吸附后和解吸液在520 nm 处的吸光值,V0、V1和V2分别为上样液吸附前、吸附后和解吸液的体积[16]。
2.2.3 HP-20 树脂的静态吸附和解吸动力学研究
准确称取1.000 g 预处理过的HP-20 大孔树脂于具塞三角瓶中,加入25 mL 不同pH 值、不同质量浓度的花色苷溶液,每隔0.5 h 吸取上清液2 mL 于534 nm 波长处测定吸光度,测定后倒回三角瓶,直到数值稳定,考察pH、上样液质量浓度对吸附率的影响,选用最佳的吸附条件,过滤出吸附饱和的树脂,称取1.0 g 吸附饱和的树脂,分别不同体积分数的酸性乙醇(0.5%乙酸)溶液进行洗脱,考察不同体积分数的乙醇对解吸率的影响。
2.2.4 HP-20 树脂的动态吸附和解吸动力学研究
采用湿法装柱,选取不同的流速上样,分段收集流出液测定流出液的吸光值,当流出液吸光值达到泄露点时停止进样,考察不同吸附流速对吸附率的影响,吸附饱和后,用3 倍柱体积的去离子水冲洗树脂以去除糖类,用最适体积分数的酸性乙醇(0.5%乙酸)以不同的流速对树脂进行洗脱,分段收集流出液并测定吸光值,考察不同解吸速度对解吸率的影响。
2.2.5 HP-20 大孔吸附树脂纯化效果检测方法及回收率
精确称取花色苷样品,用pH 为3 的柠檬酸-磷酸盐的缓冲溶液定容至100 mL,以缓冲溶液为空白调零,在520 nm 下测定吸光值;色价=A ×100/m,式中A 为520 nm 下花色苷溶液的吸光值,m 为花色苷的质量;回收率(%)=C1V1/C0V0×100,式中C0、C1为上样液吸附前和解吸液的花色苷质量浓度,V0、V1为上样液吸附前和解吸液的体积,3 次平行实验。
2.3 黑果腺肋花楸花色苷稳定性研究方法
2.3.1 pH 对花色苷稳定性的影响
用柠檬酸和磷酸二氢钠配制pH 值为1~10 的缓冲溶液,精确称取适量纯化后花色苷提取液分别加入不同pH 值的缓冲溶液,摇匀,以相应的pH 值缓冲溶液做调零,在520 nm 下测定吸光值,并观察记录颜色的变化情况。
2.3.2 光照条件对花色苷稳定性的影响
精确称取适量纯化后花色苷固体装入两个具塞试管中,向其中分别加入蒸馏水20 mL(含0.5%乙酸),在避光和实验室自然光下,在1~10 d 内定时取样,测定花色苷溶液在520 nm 下的吸光值。
2.3.3 温度对花色苷稳定性的影响
精确取5 份纯化后的花色苷固体,加入蒸馏水(含0.5 %乙酸)定容至30 mL,分别置于30、40、50、60、70 ℃的恒温水浴锅中,每隔30 min 取样,取样时迅速冷却至室温后,在520 nm 处测定吸光值。
2.3.4 金属离子对花色苷稳定性的影响
分别配制浓度为0.5 mol/L 的NaCl、FeSO4、Zn-SO4、MgSO4、MnCl2、CuSO4溶液,取纯化后的花色苷溶液5 mL 与10 mL 上述溶液混匀,以5 mL 去离子水和相应的10 mL 盐溶液混匀做为参比调零,每隔5 h 测定其在520 nm 下的吸光值。
2.3.5 氧化剂和还原剂对花色苷稳定性的影响
分别配制不同浓度为的H2O2水溶液和Na2SO3溶液,取纯化后的黑果腺肋花楸花色苷提取液5 mL与10 mL 上述溶液混匀,以5 mL 去离子水和相应的10 mLNa2SO3和H2O2溶液混匀做为参比调零,摇匀后在520 nm 测定溶液的吸光值。
3 结果与分析
3.1 黑果腺肋花楸花色苷的纯化
3.1.1 大孔吸附树脂的筛选
不同型号的大孔吸附树脂的吸附曲线和解吸曲线和性能如图1 和表1 所示。由图1 和表1 可以得出,树脂的孔径对花色苷的吸附效果影响较大,孔径过小或过大都不利于花色苷分子的保留[17],非极性的树脂比弱极性的树脂对黑果腺肋花楸花色苷的吸附和解吸效果都好,大孔吸附树脂在90 min 时基本吸附饱和,解吸过程在60 min 时结束,其中HP-20的吸附和解吸能力最强,吸附率达到91.2%,解吸率为90.1%,因此选择HP-20 大孔吸附树脂进行黑果腺肋花楸花色苷的纯化树脂。

图1 不同大孔吸附树脂对黑果腺肋花楸花色苷的吸附(A)及解吸(B)效果Fig.1 Adsorption (A)and desorption (B)curves of anthocyanins on different resins

表1 不同大孔吸附树脂对黑果腺肋花楸花色苷吸附和解吸性能的比较Table 1 Comparison of adsorption and desorption efficiencies of A.melanocarpa anthocyanins with different resins
3.1.2 HP-20 大孔吸附树脂的静态吸附特性
3.1.2.1 样液pH 值对吸附效果的影响
花色苷溶液在酸性条件下能够稳定的存在,在碱性条件下会有降解现象的出现,试验考察了花色苷溶液在酸性条件下pH 值与HP-20 大孔吸附树脂的吸附能力。由图2 可知,花色苷溶液pH 值为1时,树脂的吸附率最高达到92.6%,随着pH 值的升高,树脂的吸附能力有下降趋势,可能是黑果腺肋花楸花色苷随着pH 值的改变其在溶液的存在形式也会发生变化,pH 为1 和2 时解吸效果相差不大,而且过酸性的溶液对大孔吸附树脂和仪器会产生不利影响[18],所以选择pH 值为2 的黑果腺肋花楸花色苷溶液做为最佳的动态上样液pH 值。
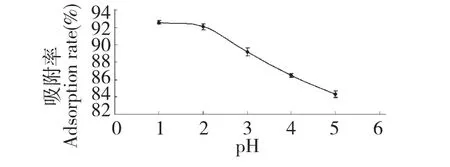
图2 黑果腺肋花楸花色苷溶液pH 值对HP-20 大孔吸附树脂吸附的影响Fig.2 Adsorption performances of A.melanocarpa anthocyanins with different pH values on HP-20 resins
3.1.2.2 样液质量浓度对吸附效果的影响
由图3 可知,随着上样液质量浓度的增大,HP-20 大孔吸附树脂的吸附效果逐渐降低,这是由于大孔吸附树脂对花色苷的吸附能力有限,当上样液中含有过多的花色苷时吸附树脂的吸附能力达到饱和而导致的吸附率降低,虽然质量浓度为0.3 mg/mL时的吸附率要略高于0.6 mg/mL,但是后者溶液中所含花色苷浓度大,当上样液质量浓度高于0.6 mg/mL 时,大孔吸附树脂的吸附效果急剧下降,会造成原料的浪费,充分利用树脂和节省原料的角度上考虑,选择上样液质量浓度为0.6 mg/mL。
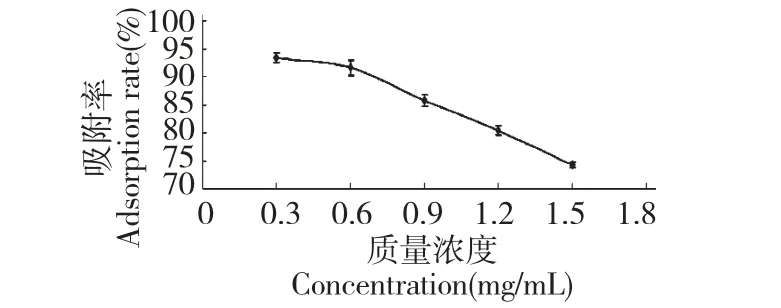
图3 黑果腺肋花楸花色苷溶液质量浓度对HP-20 大孔吸附树脂吸附的影响Fig.3 Adsorption performances of different concentrations of A.melanocarpa anthocyanins solution on HP-20 resins
3.1.2.3 不同体积分数乙醇对解吸效果的影响
解吸的过程实质上是解吸液与花色苷争夺大孔吸附树脂活性吸附点的过程,不同体积分数的乙醇溶液可以导致洗脱剂的极性大小不同,这样会影响黑果腺肋花楸花色苷与大孔吸附树脂之间的相互作用力,如图4 所示,在一定范围内,随着洗脱剂乙醇的体积分数增大,解析效果逐渐增强,当体积分数大于40%时解吸效果有下降的趋势,考虑解吸效果和成本,选择体积分数为40%的乙醇(含0.5%乙酸)作为解吸液。

图4 乙醇浓度对HP-20 大孔吸附树脂解吸的影响Fig.4 Effect of ethanol concentrations on HP-20 resins desorption behavior
3.1.3 HP-20 大孔吸附树脂的动态吸附特性
3.1.3.1 动态吸附流速的确定
上样液的流速对大孔吸附树脂的吸附效果有很大的影响,不同的流速导致花色苷向大孔吸附树脂表面扩散速度不同,泄漏点出现的早晚是评价动态吸附流速对大孔吸附树脂吸附效果影响的重要指标,由图5 可以得出,上样液流速越快,泄露点出现的越早;随着流速的降低,泄露点的出现也有相应的延迟,当吸附速率为2.5 mL/min 时,在流出20 管的时候就已泄漏,而流速为0.5 mL/min 和1.0 mL/min 时泄露点均在45 管左右出现,流速小延长了吸附时间使树脂的寿命降低,因此在后续的试验中选择上样液流速为1.0 mL/min。

图5 黑果腺肋花楸花色苷溶液流速对HP-20 大孔吸附树脂吸附的影响Fig.5 Effects of different flow rates on the adsorption of A.melanocarpa anthocyanins with HP-20 resin
3.1.3.2 解吸液流速的确定
由图6 可知,在解吸液流速大于1.0 mL/min时,洗脱峰型都较宽,出现严重的拖尾现象,这是由于随着解吸液流速的增大,只有较少的花色苷类物质溶解在解吸液中被洗脱下来,需要大量的解吸液才能将大部分花色苷解吸下来,当解吸液的流速小于1.0 mL/min 时,两个流速下的峰型较窄,这是由于吸附在树脂上的花色苷类物质有充分的时间溶解在解吸液中,考虑到洗脱时间、解吸液用量和洗脱效果,选取解吸液流速为1.0 mL/min。

图6 解析液流速对HP-20 大孔吸附树脂解吸的影响Fig.6 Effect of different elution rate on the desorption of HP-20 resin
3.1.3.3 HP-20 大孔吸附树脂纯化效果检测方法及回收率
选用HP-20 大孔吸附树脂在最佳纯化条件下,黑果腺肋花楸花色苷色价由开始的14.3 提高到121.5,是纯化前的的8.5 倍,实验测得花色苷回收率为90.5%。
3.2 黑果腺肋花楸花色苷的稳定性研究
3.2.1 pH 值对花色苷稳定性的影响
由表2 可知,随着溶液的pH 的增大,最大吸收波长也随之增大,最大吸收峰出现了明显的红移,在pH 值为5 和6 的时候无明显最大波长,当pH 值大于7 的时候,花色苷溶液呈现出浅褐色。随着pH的改变,花色苷的降解反应属一级动力学反应中的裂解反应[19]。结果说明,黑果腺肋花楸花色苷会随着介质pH 的变化而产生色泽消退和颜色改变[20],适宜在偏酸性的环境保藏和使用。

表2 pH 值对黑果腺肋花楸花色苷稳定性的影响Table 2 Effects of pH values on the spectral property and the stability of A.melanocarpa anthocyanins
3.2.2 光照条件对花色苷稳定性的影响
由图7 可知,黑果腺肋花楸花色苷在实验室自然光条件下,花色苷溶液吸光值逐渐下降,说明花色苷发生了明显的降解,而在避光条件下10 天内溶液吸光值没有太大变化,因此,黑果腺肋花楸花色苷应该尽量避光储藏。

图7 光照和避光对黑果腺肋花楸花色苷稳定性的影响Fig.7 Effects of sunlight and dark on the stability of A.melanocarpa anthocaynins
3.2.3 温度对花色苷稳定性的影响
由图8 所示,随着处理温度的升高和时间的延长,黑果腺肋花楸花色苷的吸光值在下降,处理温度40、50、60 ℃与70、80 ℃相比,黑果腺肋花楸花色苷吸光度下降比较小。处理2h 后,40、50、60 ℃的花色苷保存率为99.5%、99.2%、98.0%,而70、80 ℃下花色苷的保存率只有70.8%和67.7%,可见黑果腺肋花楸花色苷在60 ℃以内,显示了较强的耐热性,处理温度不断加大,其耐热性降低,颜色由鲜红变浅,因此,黑果腺肋花楸花色苷类产品在加工过程中温度应该控制在60 ℃以下。
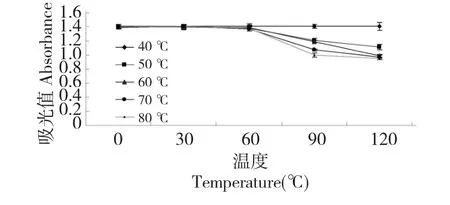
图8 温度对黑果腺肋花楸花色苷稳定性的影响Fig.8 Effects of temperature on the stability of A.melanocarpa anthocaynins
3.2.4 金属离子对花色苷稳定性的影响
由表3 所示,Na+、Fe2+、Zn2+、Mg2+、Mn2+的盐离子加入到黑果腺肋花楸花色苷溶液中后,溶液的吸光值变化不大,可以确定这几种盐离子对花色苷的稳定性无明显影响,而Cu2+、Al3+、Fe3+的加入使花色苷溶液的吸光值显示出下降的趋势,这可能是由于花色苷分子与这些金属离子结合,形成复杂的络合物导致花色苷的降解,因此,在黑果腺肋花楸花色苷在加工过程中应该避免添加这些离子的试剂,以起到增加花色苷稳定性的效果。
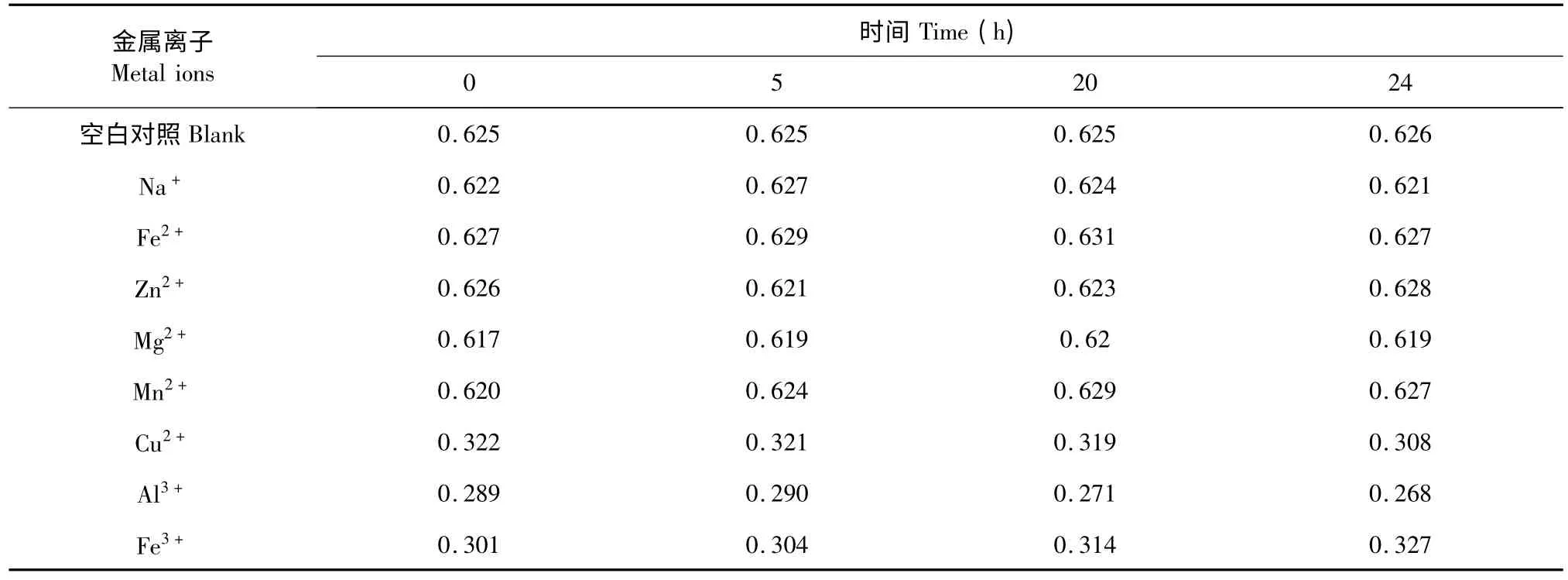
表3 金属离子对黑果腺肋花楸花色苷稳定性的影响Table 3 Effects of metal ions on the stability of A.melanocarpa anthocaynins
3.2.5 氧化剂和还原剂对花色苷稳定性的影响
由表5 可知,氧化剂H2O2的加入后,黑果腺肋花楸花色苷溶液的吸光值明显下降,目测花色苷溶液颜色由深红色变为无色,氧化剂浓度越大,花色苷溶液的吸光值越低,这是由于花色苷属于多酚类天然产物,结构里含有酚羟基,容易受到氧化剂的氧化而导致花色苷的降解[21];在花色苷溶液中加入不同浓度的还原剂Na2SO3之后,目测观察花色苷溶液由深红色变为浅红,随着浓度的增大,花色苷溶液变为无色,因此,无论是氧化剂还是还原剂对黑果腺肋花楸花色苷稳定性的影响都是极其快速的,在相关黑果腺肋花楸花色苷产品的制作过程中,应避免氧化剂和还原剂的使用。
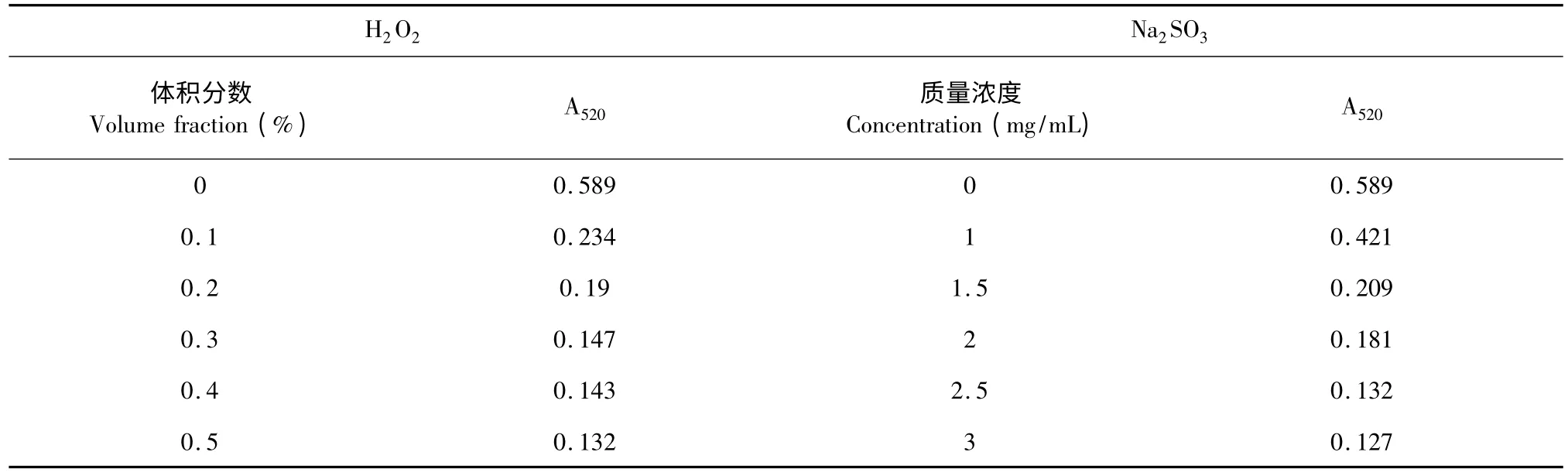
表5 氧化剂和还原剂对黑果腺肋花楸花色苷稳定性的影响Table 5 Effects of oxidant and reductant on the stability of A.melanocarpa anthocaynins
4 结论
HP-20 大孔吸附树脂对黑果腺肋花楸花色苷显示出了优良的纯化功能,经纯化后花色苷的色价达到121.5,回收率为90.5%,其纯化工艺参数为:上样液pH 为2,上样液质量浓度为0.6 mg/mL,解吸液为体积分数是40%的酸化乙醇(含0.5%乙酸),吸附和解吸流速均为1 mL/min。黑果腺肋花楸花色苷对光、pH 值、温度均表现出负相关的变化趋势,相关产品加工过程中应尽量避免与Cu2+、Al3+、Fe3+金属离子和氧化剂、还原剂的接触,根据相关稳定性试验,可以认为黑果腺肋花楸花色苷可以应用与酸性、低温的加工环境中的天然色素资源。
1 Akita Y,Kitamura S,Hase Y,et al.Isolation and characterization of the fragrant cyclamen O-methyltransferase involved in flower coloration.Planta,2011,234:1127-1136.
2 Fan ZL(樊梓鸾),Wang ZY(王振宇),Cheng CL(程翠林),et al.Antioxidant and antiproliferative activities of five wild berries.Food Sci (食品科学),2010,31:148-152.
3 Dai YJ(戴余军),Shi HJ(石会军),Qiu XY(仇小燕),et al.Study on the stability of pigment from Black Carrot.China Condiment (中国调味品),2014,39:102-106.
4 Zhao X(赵鑫),Hu GS(胡国胜).Progresses on natural pigments of plant(II).Guangzhou Chem Ind (广州化工),2012,12:14-16.
5 Valcheva-Kuzmanova SV,Belcheva A.Current knowledge of Aronia melanocarpa as a medicinal plant.Folia Med,2006,48:11-17.
6 Małodobry M,Bieniasz M,Dziedzic E.Evaluation of the yield and some components in the fruit of blue honeysuckle (Lonicera caerulea var.edulis Turcz.Freyn.).Folia Horticul,2010,22:45-50.
7 Zdarilová A,Svobodová AR,Chytilová K,et al.Polyphenolic fraction of Lonicera caerulea L.fruits reduces oxidative stress and inflammatory markers induced by lipopolysaccharide in gingival fibroblasts.Food Chem Toxicol,2010,48:1555-1561.
8 Odriozola-Serrano I,Soliva-Fortuny R,Martín-Belloso O.Impact of high-intensity pulsed electric fields variables on vitamin C,anthocyanins and antioxidant capacity of Strawberry juice.LWT-Food Sci Technol,2009,42:93-100.
9 Jang HL,Yoon KY.Cultivar differences in phenolic contents/biological activities of color-fleshed potatoes and their relationships.Horticul Environ Biotechnol,2012,53:175-181.
10 Jiao Y(焦岩),Wang ZY(王振宇).Optimization on the supersonic-assisted extracting technology of Lonicera caerulea anthocyanin and its hypolipidemic effect.J Chin Instit Food Sci Technol (中国食品学报),2010,10(2):75-81.
11 Li MS(李梦莎).Optimization of ultrasonic extraction technology of anthocyanins from Aornia melanocarpa elliot by response surface method.China Brew (中国酿造),2014,33:129-133.
12 Oszmianski J,Wojdylo A.Aronia melanocarpa phenolics and their antioxidant activity.Eur Food Res Technol,2005,221:809-813.
13 Bridgers EN,Chinn MS,Truong V.Extraction of anthocyanins from industrial purple-fleshed sweet potatoes and enzymatic hydrolysis of residues for fermentable sugars.Ind Crops Prod,2010,3:613-620.
14 Hou FL(侯方丽),Zhang MW(张名位),Sun DX(苏东晓),et al.Research on adsorption character and purification of Black Rice anthocyanins with macroporous resin.J South China Norm Univ,Nat Sci(华南师范大学学报,自科版),2009,1:100-104.
15 Dong ZY(董周永),A G(阿嘎),Zhao GJ(赵国建),et al.Purification of anthocyanins from red-core radish by macroporous resin.Food Sci (食品科学),2011,4:21-24.
16 Hu JK(胡金奎).Separation and preparation,structural analysis and in vitro activity of anthocyanins from Mulberry fruits.Wuxi:Jiangnan University(江南大学),MSc.2013.
17 Di Mauro A,Arena E,Fallico B,et al.Recovery of anthocyanins from pulp wash of pigmented oranges by concentration on resins.J Agric Food Chem,2002,50:5968-5974.
18 Li CY(李颖畅),Zheng FE(郑凤娥),Meng XJ(孟宪军).Studies on purification of anthocyanins from Blueberry fruits by macroporous resins.J Food Sci Biotechnol (食品与生物技术学报),2009,4:496-500.
19 Wang JB(王家保),Liu ZY(刘志媛),Du ZJ(杜中军),et al.Analysis of the factors related to pericarp color formation during fruit development of Litchi.Chin J Tropical Crops (热带作物学报),2006,27(2):11-17.
20 Zhong MR(钟瑞敏).Applied studies on the internal relationship between the structure and stability of anthocyanins.J Shaoguan Univ,Nat Sci(韶关学院学报,自科版),2001,22(12):79-83.
21 Li Y(李云),Zhao CL(赵昶灵),Yang XN(杨晓娜).et al.Research advances in the relationship between the molecular structures of anthocyanins and the instability and colorations.J Yunnan Agric Univ (云南农业大学学报),2010,25:713-720.

