纤溶系统对罗格列酮治疗肺纤维化的影响及信号机制
张彦萍,白林林,李 娜,马丽华,崔丽亚
(1.河北医科大学第二医院呼吸内二科,河北 石家庄 050000; 2.河北省邢台市人民医院呼吸科,河北 邢台 054000)
·论 著·
纤溶系统对罗格列酮治疗肺纤维化的影响及信号机制
张彦萍1,白林林2,李 娜1,马丽华1,崔丽亚1
(1.河北医科大学第二医院呼吸内二科,河北 石家庄 050000; 2.河北省邢台市人民医院呼吸科,河北 邢台 054000)
目的探讨纤溶酶原激活物抑制剂1(plasminogen activator inhibitor-1,PAI-1)对罗格列酮抑制成纤维细胞转化的影响及信号机制。方法大鼠胚肺成纤维细胞随机分为3组:罗格列酮组、PAI-1组、对照组。罗格列酮组加入罗格列酮30 mmol/L,PAI-1组加入罗格列酮30 mmol/L及PAI-1 20 mmol/L,对照组加入培养基。分别于24 、48 、72 h收取细胞冻存。采用反转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)法检测成纤维细胞24 h PAI-1和α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)mRNA的表达;Western Blot方法分析3个时间点丝氨酸/苏氨酸蛋白激酶(serine/threonine kinase,AKT)、细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)的蛋白表达。结果罗格列酮抑制成纤维细胞PAI-1 mRNA、α-SMA mRNA及ERK的蛋白表达,与对照组比较差异有统计学意义(P<0.05);上调成纤维细胞内PAI-1表达后,罗格列酮对PAI-1、α-SMA 的基因表达及3个时间点ERK蛋白表达的抑制作用均减弱,与罗格列酮组比较差异有统计学意义(P<0.05);罗格列酮对AKT蛋白表达无抑制作用(P>0.05)。结论罗格列酮通过抑制大鼠成纤维细胞PAI-1的表达活化纤溶系统;上调PAI-1表达可以使罗格列酮抑制成纤维细胞转化的能力减弱,这种作用可能是通过PAI-1与ERK信号途径之间的相互作用实现的。
肺纤维化;罗格列酮;纤溶酶原激活物抑制物1
肺间质纤维化的发病率逐年增加,已成为临床亟待解决的课题。以往研究认为,微环境变化、上皮细胞损伤、细胞因子释放、成纤维细胞转化为肌成纤维细胞等可能参与了肺纤维化的发病[1]。近年研究表明,纤溶酶原激活物抑制剂1(plasminogen activator inhibitor-1,PAI-1)可能是一个独立的促纤维化因子,降低PAI-1表达可以减轻博莱霉素诱导的肺纤维化[2]。在治疗方面,虽然激素、免疫抑制剂及抗纤维化药物已在临床应用,但肺纤维化还没有规范的治疗方法。有报道显示罗格列酮除了调节脂肪代谢、糖代谢、动脉硬化外,还具有强烈的抗器官纤维化作用[3],但机制尚不清楚。本研究探讨PAI-1是否参与了罗格列酮抑制大鼠胚肺成纤维细胞转化为肌成纤维细胞的过程,以及改变纤溶系统的活性对丝氨酸/苏氨酸蛋白激酶(serine/threonine kinase,AKT)、细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)信号途径的影响,旨在从罗格列酮治疗肺纤维化的角度说明纤溶系统在肺纤维化发病中的作用。报告如下。
1 材料与方法
1.1 细胞系与试剂 大鼠胚肺成纤维细胞(本室冻存);胎牛血清、DMEM-F12培养基(Gibco公司);PAI-1蛋白(美国 PEPROTECH公司);PAI-1、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)引物(上海生工生物工程有限公司);兔抗大鼠ERK、AKT多克隆抗体(美国Bioworld公司);辣根过氧化物酶(horseradish peroxidase,HRP)标记山羊抗兔IgG二抗(中山金桥公司)。
1.2 方法
1.2.1 细胞复苏 取出呼吸病研究室冻存的大鼠胚肺成纤维细胞,迅速置于37 ℃水浴中复苏。将细胞置于含10%胎牛血清、1%双抗的DMEM-F12培养基中,于5% CO2、37 ℃饱和湿度条件下培养。传至第三代时进行药物干预。将细胞分为3组:罗格列酮组、PAI-1组、对照组。罗格列酮组加入罗格列酮(30 mmol/L),PAI-1组加入罗格列酮30 mmol/L及PAI-1 20 mmol/L,对照组加入培养基。分别于24、48、72 h收取细胞冻存。
1.2.2 RT-PCR法测定24 h PAI-1、α-SMA mRNA含量 采用Trizol法提取总RNA,按照TaKaRa公司试剂盒说明书反转录成CDNA,保存于-20 ℃中备用。PAI-1上游引物:5′-CCTTCCAGAGTCCC-ATACA-3′;下游引物:5′-CTGG CTCTTTCCACC-TCT-3′。α-SMA上游引物:5′- CCTTCCAGAG TCCCATACA-3′;下游引物:5′-CTGGCTCTTTC-CACCTCT-3′。内参照GAPDH上游引物:5′-CCATGTTTGTGATGGGTGTGAACCA-3′;下游引物:5′- ACCAGTGGATGCAGGATGATGTTC-3′。
1.2.3 Westen-Blot测定24、48、72 h AKT、ERK的蛋白表达 用RIPA细胞裂解液将细胞充分裂解,考马斯亮蓝法测定蛋白浓度,加溴酚蓝沸水中煮沸5 min变性,按照SDS-聚丙烯酰胺二凝胶电泳操作说明书经过电泳,转膜,封闭,加入相应一抗(AKT、ERK一抗以1∶500稀释,β-actin一抗以1∶2 000稀释),洗膜,HRP标记的特异性二抗以1∶2 000稀释,增强化学发光法显色后,图像采集,软件分析得出数据。
2 结 果
2.1 大鼠胚肺成纤维细胞PAI-1和α-SMA mRA的基因表达 罗格列酮组成纤维细胞内加入罗格列酮24 h后,PAI-1 mRNA和α-SMA mRNA的表达下调,与对照组比较差异有统计学意义(P<0.05)。PAI-I组成纤维细胞内加入罗格列酮后,再加入外源性PAI-1,PAI-1 mRNA和α-SMA mRA的表达再次上调,与罗格列酮组比较差异有统计学意义(P<0.05)。见图1,2和表1。

图1 罗格列酮抑制大鼠胚肺成纤维细胞PAI-1 mRNA的表达C:对照组;R:罗格列酮组;P:PAI-1组
Figure 1 Rosiglitazone inhibited PAI-1 mRNA expressions of fibroblasts from rats′ embryo lung tissues

图2 上调PAI-1表达对罗格列酮抑制成纤维细胞α-SMA mRNA表达的影响C:对照组;R:罗格列酮组;P:PAI-1组
Figure 2 The effect of up-regulation PAI-1 expression in rosiglitazone inhibition on α-SMA mRNA expression of fibroblasts
表1 各组成纤维细胞PAI-1 mRNA和α-SMA mRNA表达比较
Table 1 The expression of PAI-1 mRNA and α-SMA mRNAin fibroblasts among three groups
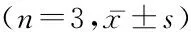

组别PAI-1mRNAα-SMAmRNA对照组 0.921±0.0381.087±0.048罗格列酮组0.379±0.024*0.944±0.028*PAI-1组 0.900±0.006#1.225±0.027#F 84.30585.580P 0.0000.000
*P<0.05与对照组比较 #P<0.05与罗格列酮组比较(q检验)
2.2 上调PAI-1表达对成纤维细胞AKT及ERK蛋白表达的影响 Western Blot结果显示罗格列酮作用后对AKT蛋白表达没有影响(P>0.05);罗格列酮使ERK蛋白表达下调,3个时间点与对照组比较差异有统计学意义;上调PAI-1表达后,罗格列酮对ERK蛋白的抑制作用均减弱,3个时间点PAI-1组与罗格列酮组比较差异有统计学意义(P<0.05),见图3和表2。
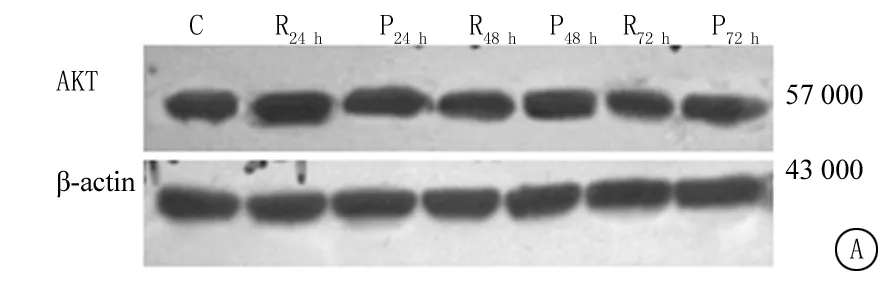
图3 上调PAI-1表达对罗格列酮抑制成纤维细胞AKT及ERK蛋白表达的影响C:对照组;R:罗格列酮组;P:PAI-1组
Figure 3 The effect of up-regulation PAI-1 expression in rosiglitazone inhibition on AKT and ERK protein expressions of fibroblasts
表2 不同时间点成纤维细胞内AKT和ERK表达比较
Table 2 The protein expression of AKT and ERK in fibroblasts at different time
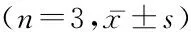

组别AKT/β-actinERK/β-actin对照组0.519±0.0303.007±0.211罗格列酮组24h0.562±0.0111.048±0.030*PAI-1组24h0.503±0.0331.616±0.020#罗格列酮48h0.534±0.0322.114±0.041*PAI-1组48h0.523±0.0142.623±0.094#罗格列酮组72h0.485±0.0351.790±0.091*PAI-1组72h0.546±0.0442.616±0.035# F2.736153.548 P0.0570.000
*P<0.05与对照组比较 #P<0.05与罗格列酮组比较(q检验)
3 讨 论
特发性肺纤维化发病机制尚不清楚。以往研究表明,吸烟、病毒感染、肺泡上皮反复发生微小损伤后的异常修复、成纤维细胞转化为高表达α-SMA的肌成纤维细胞、上皮细胞-间质细胞转化等因素与发病有关[4]。研究表明,纤溶系统不但在凝血及纤溶过程中发挥重要作用,而且在细胞增殖、凋亡、肿瘤细胞迁移,尤其在器官纤维化中亦发挥着重要作用[5]。近年来对于PAI-1的研究已经有了长足的进展。我们前期研究表明,成纤维细胞内转染PAI-1 siRNA,可以抑制其增殖、促进其凋亡[6],气管内滴入PAI-1 siRNA可减轻博莱霉素诱导的肺纤维化[2]。PAI-1可能作为一个独立的促纤维化因子,促进肺纤维化的发生发展。
激素及免疫抑制剂对IPF患者的疗效较差,已经不推荐使用。虽然吡非尼酮已经用于临床[7],但价格昂贵,疗效有待进一步观察。近年研究表明,罗格列酮作为研究最多的外源性过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor,PPARγ)激动剂,具有调节脂肪及糖代谢、细胞增殖及凋亡、炎症及纤维化的作用[3]。尤其在肝、肾、角膜、肺纤维化等的治疗过程中,可以是PPARγ依赖和非依赖性的[8-9]。本研究从基因水平证实罗格列酮抑制大鼠胚肺成纤维细胞α-SMA的表达,抑制成纤维细胞向肌成纤维细胞转化,阻滞肺纤维化的发生发展。这与以往研究观察到罗格列酮抑制转化生长因子β诱导的人成纤维细胞转化,减轻博莱霉素诱导的肺纤维化并降低大鼠死亡率等结果相一致[10]。本研究探讨在罗格列酮治疗肺纤维化过程中是否有纤溶系统参与以及PAI-1与AKT、ERK信号途径的关系,从治疗角度说明纤溶系统在肺纤维化发病中的作用。
关于罗格列酮抑制肺纤维化的分子学机制,以往研究表明,PPARγ活化可以调节炎症到损伤愈合的转换及上皮细胞-间质细胞转化[3];通过减低转化生长因子β水平减轻博莱霉素诱导肺纤维化[10];通过抑制 JAK/STAT和ERK信号途径减轻IL-13诱导的气道成纤维细胞胶原沉积[11]。本研究观察到,罗格列酮可以抑制成纤维细胞PAI-1表达,使纤溶活性升高,同时罗格列酮持续抑制ERK蛋白的活性;上调PAI-1表达后,罗格列酮抑制成纤维细胞转化为肌成纤维细胞的能力减弱,同时对ERK表达的抑制作用也减弱。因此,我们认为纤溶系统的参与可能是罗格列酮治疗肺纤维化的新机制,也进一步说明PAI-1在肺纤维化发病中起重要作用。
近期国外已有研究表明罗格列酮通过改变纤溶活性抑制心肌、肾纤维化及肿瘤活性。如Meng等[12]观察到PPARγ与Smad信号蛋白的相互作用抑制血管紧张素2诱导的PAI-1产生,进而抑制心肌成纤维细胞增殖。Carter等[13]观察到PPARγ激动剂降低PAI-1表达,抑制乳腺癌细胞转移,这个过程可能是通过改变纤溶系统的活性实现的。罗格列酮通过改变纤溶活性抑制成纤维细胞增殖及转化的报道尚未检索到。本研究结果表明PAI-1与ERK信号途径的相互作用可能是罗格列酮治疗肺纤维化的关键环节,PAI-1是肺纤维化发病的独立危险因素,降低PAI-1活性可能对肺纤维化治疗有益。
综上所述,罗格列酮抑制成纤维细胞转化为肌成纤维细胞,与以往研究机制不同。我们认为,PAI-1与ERK信号途径之间的相互作用可能参与了这一过程,纤溶系统在罗格列酮治疗肺纤维化过程中发挥了重要作用。
[1] Ghosh AK,Quaggin SE,Vaughan DE.Molecular basis of organ fibrosis:potential therapeutic approaches[J].Exp Biol Med(Maywood),2013,238(5):461-481.
[2] Zhang YP,Li WB,Wang WL,et al.siRNA against plasminogen activator inhibitor-1 ameliorates bleomycin-induced lung fibrosis in rats [J].Acta Pharmacologica Sinica,2012,33(7):897-908.
[3] Kulkarni AA,Woeller CF,Thatcher TH,et al.Emerging PPAR- independent role of PPARγ ligands in lung diseases [J].PPAR Res,2012,2012:705352.
[4] Bartis D,Mise N,Mahida RY,et al.Epithelial-mesenchymal transition in lung development and disease:does it exist and is it important? [J].Thorax,2014,69(8):760-765.
[5] Balsara RD,Ploplis VA.Plasminogen activator inhibitor-1:the double-edged sword in apoptosis [J].Thromb Haemost,2008,100(6):1029-1036.
[6] Zhang YP,Wang WL,Liu J,et al.Plasminogen activator inhibitor-1 promotes the proliferation and inhibits the apoptosis of pulmonary fibroblasts by Ca2+signaling [J].Thromb Res,2013,131(1):64-71.
[7] Cottin V,Maher T.Long-term clinical and real-world experience with pirfenidone in the treatment of idiopathic pulmonary fibrosis [J].Eur Respir Rev,2015,24(135):58-64.
[8] Lin CL,Hsu YC,Lee PH,et al.Cannabinoid receptor 1 disturbance of PPARγ2 augments hyperglycemia induction of mesangial inflammation and fibrosis in renal glomeruli [J].J Mol Med(Berl),2014,92(7):779-792.
[9] Sharvit E,Abramovitch S,Reif S,et al.Amplified inhibition of stellate cell activation pathways by PPAR-γ,RAR and RXR agonists [J].PLoS One,2013,8(10):e76541.
[10] Wei J,Zhu H,Komura K,et al.A synthetic PPAR-γ agonist triterpenoid ameliorates experimental fibrosis:PPAR-γ-independent suppression of fibrotic responses.[J] Ann Rheum Dis,2014,73(2):446-454.
[11] Lu J,Liu L,Zhu Y,et al.PPAR-γ inhibits IL-13-induced collagen production in mouse airway fibroblasts [J].Eur J Pharmacol,2014,737:133-139.
[12] Meng Z,Yu XH,Chen J,et al.Curcumin attenuates cardiac fibrosis in spontaneously hypertensive rats through PPAR-γ activation [J].Acta Pharmacol Sin,2014,35(10):1247-1256.
[13] Carter JC,Church FC.Peroxisome Proliferator-Activated Receptor-γ Ligands Alter Breast Cancer Cell Motility through Modulation of the Plasminogen Activator System [J].J Oncol,2011,2011:594258.
(本文编辑:许卓文)
Rosiglitazone in treatment of lung fibrosis through activation fibrinolysis system and ERK signal pathway
ZHANG Yan-ping1,BAI Lin-lin2,LI Na1,MA Li-hua1,CUI Li-ya1
(1.Department of Respiratory Medicine,the Second Hospital of Hebei Medical University,Shijiazhuang 050000,China;2.Department of Respiratory Medicine,the People′sHospital of Xingtai City,Hebei Province,Xingtai 054000,China)
Objective To investigate the effect of plasminogen activator inhibitor-1(PAI-1) in rosiglitazone inhibition the transformation of fibroblasts and the signal mechanism in the process.Methods The fibroblasts from rats' embryo lung tissues were divided into three groups: rosiglitazone,PAI-1 and control groups.The fibroblasts in rosiglitazone group were added with 30 mmol/L rosiglitazone,the fibroblasts in PAI-1 group were added with 30 mmol/L rosiglitazone and 20 mmol/L extrinsic PAI-1,and the amount of culture medium was added in the control group.The fibroblasts were collected at 24 h,48 h and 72 h,and were storaged at frozen condition.The mRNA expression of PAI-1 and α-SMA at 24 h were determined by reverse transcription-polymerase chain reaction(RT-PCR).Western Blot analysis was used to determine the expression of serine/threonine kinase(AKT) and extracellular regulated protein kinases(ERK) at 24 h,48 h and 72 h.Results Rosiglitazone inhibited PAI-1 mRNA,α-SMA mRNA and ERK protein expression of fibroblasts,and there were significant difference in rosiglitazone group compared with control group(P<0.05).The inhibition effect was alleviated by up-regulation PAI-1 expression of fibroblasts,there was significant difference in PAI-1 group compared with rosiglitazone group(P<0.05).The expression of AKT showed no difference among three groups(P>0.05).Conclusion Rosiglitazone inhibits the transformation of lung fibroblasts through inhibition on the expression of PAI-1 that activates fibrinolytic system and through the cross-talk between PAI-1 and ERK signal pathway.
pulmonary fibrosis;rosiglitazone;plasminogen activator inhibitor 1
2015-05-28;
2015-08-04
河北省自然科学基金(C2009001161)
张彦萍(1968-),女,河北吴桥人,河北医科大学第二医院主任医师,教授,医学博士,从事肺间质纤维化疾病诊治研究。
R563.13
A
1007-3205(2015)11-1241-04
10.3969/j.issn.1007-3205.2015.11.001

