干细胞相关标志物Oct-4在宫颈癌组织中的表达及临床意义
刘 红,房朝晖,张倩影,李魁秀,樊小妹,程建新
(1.河北医科大学第四医院妇瘤科,河北 石家庄 050011;2.河北医科大学第四医院妇产科,河北 石家庄 050011)
·论 著·
干细胞相关标志物Oct-4在宫颈癌组织中的表达及临床意义
刘 红1,房朝晖1,张倩影1,李魁秀1,樊小妹1,程建新2*
(1.河北医科大学第四医院妇瘤科,河北 石家庄 050011;2.河北医科大学第四医院妇产科,河北 石家庄 050011)
目的探讨干细胞相关标志物Oct-4在宫颈癌组织中的表达并分析其在宫颈癌发生、发展中的作用和意义。方法选取宫颈癌患者的组织检查标本50例,正常宫颈组织标本20例,采用免疫组织化学法和反转录聚合酶链反应(reversetranscriptionpolymerasechainreaction,RT-PCR)法检测正常宫颈组织和不同分化宫颈癌组织Oct-4mRNA的表达量,比较两者Oct-4蛋白表达阳性率以及宫颈癌患者在不同病理情况下Oct-4蛋白表达的阳性率。结果RT-PCR检测显示Oct-4mRNA在宫颈癌组织中的表达明显高于正常宫颈组织,免疫组织化学染色显示正常宫颈鳞状上皮组织不表达Oct-4蛋白,宫颈癌组织中阳性表达率为56.0%(P<0.01)。Oct-4蛋白表达在宫颈癌患者的不同年龄和不同病理类型之间差异无统计学意义(P>0.05),但在低分化的宫颈癌组织中明显高于中高分化的宫颈癌组织,在宫颈癌复发转移者明显高于临床治愈者(P<0.01)。结论Oct-4基因在宫颈癌组织中表达增加,表达程度随着宫颈癌细胞的分化而降低,可能在宫颈癌放疗抵抗中起重要作用。
宫颈癌;Oct-4;放射治疗;转移;复发doi:10.3969/j.issn.1007-3205.2015.11.008
宫颈癌是发病率较高的女性恶性肿瘤之一,约35%的宫颈癌患者在最初治疗结束后3年内出现复发和转移[1],一旦发生转移或复发则预后极差。因此,如何预防宫颈癌转移和复发是治疗宫颈癌成败的关键。尽管近年来在治疗宫颈癌方面,放疗技术不断改进,但治愈率并未明显改善[2]。其主要原因是肿瘤组织抗拒放疗。肿瘤干细胞理论认为肿瘤细胞来源于肿瘤干细胞,肿瘤干细胞具有自我更新、多向分化潜能、抗拒放化疗及高致瘤性等特点,是肿瘤生长、侵袭、转移和复发的根源[3-4]。因此,从肿瘤干细胞的角度深入探索宫颈癌的转移和复发机制,可以为治疗宫颈癌提供新的思路和方法。干细胞相关标志物Oct-4被认为是细胞全能性的标志,用于维持细胞的多能性状态,敲除胚胎干细胞的Oct-4可导致细胞的分化及干细胞特性的消失[5]。研究表明,Oct-4在生殖细胞来源及生殖系统以外的恶性肿瘤中均有阳性表达[6]。有学者认为,表达Oct-4基因的成人干细胞,在肿瘤发生过程中起着重要作用,是导致癌变的一种靶细胞。由于肿瘤初始形成过程中某些不可逆基因改变阻止了分化,因而阻止了Oct-4的消失,保留了其超常自我更新的能力,导致无限制的扩增,形成肿瘤[7-8]。但Oct-4蛋白的表达水平与宫颈癌细胞的生物行为及临床病理特征之间的关系尚不明确,此方面的研究甚少[9]。本研究应用免疫组织化学、反转录聚合酶链反应(reversetranscriptionpolymerasechainreaction,RT-PCR)方法检测Oct-4在宫颈癌细胞和宫颈癌组织中的表达,探讨Oct-4表达与宫颈癌发生发展的关系,以期为宫颈癌的治疗提供理论基础,报告如下。
1 资料与方法
1.1 一般资料 收集河北医科大学第四医院提供的资料完整的2008—2010年50例宫颈癌住院放疗患者活组织检查并经病理证实的标本。年龄24~82岁,中位年龄53岁,治疗前均行全身计算机断层扫描(computedtomography,CT)或正电子发射计算机断层显像(positronemissiontomography,PET)检查,除外远处转移患者,其中高分化13例,中分化19例,低分化18例,临床分期为Ⅱb~Ⅲb期。收集妇科病理检查中20例非宫颈癌患者的组织检查标本,年龄28~76岁,中位年龄52岁。所有标本一分为二:一份置于液氮中,用于提取组织的总RNA,进行RT-PCR检测目的基因mRNA的表达水平;另一份放入中性福尔马林(10%)固定,再经石蜡包埋固定后切片,进行免疫组织化学染色。
1.2 主要试剂 兔源性Oct-4多克隆抗体(Abcam);抗兔免疫组织化学染色试剂盒(北京博奥森生物技术有限公司);RNA提取试剂TRIzol(美国GIBCO公司);Oct-4、GAPDH引物(上海捷瑞技术有限公司)。
1.3RT-PCR技术检测Oct-4mRNA的表达 用Trizol法分别提取宫颈癌组织和正常宫颈组织中的总RNA行RT-PCR。20μL的反应体系为:2×UltraSYBRMixture10μL,上游引物(10μL/μm)为0.4μL,下游引物(10μL/μm)为0.4μL,模板(cDNA)为2μL,DEPCddH2O为7.2μL,Total为20μL,所需反应条件为95 ° 15s、60min20s,共循环45次。Oct4基因引物序列:上游为5′-CAGAAGGGCAAGCGATCAAG-3′,下游为5′-GGGCCAGAGGAAAGGACACT-3′,扩增产物100bp。以GAPDH基因为内参照,引物序列:上游为5′-CCTCTGACTTCAACAGCGACAC-3′,下游为5′-TGGTCCAGGGGTCTTACTCC-3′,扩增产物174bp。数据收集及分析采用Rotor-GeneReal-TimeAnalysisSoftware6.1序列检测系统。△Ct值是每个样本目的基因的循环阈值(Ct)与内参Ct的差异,以GAPDH为内参基因,采用△Ct(Ct目的-Ct内参)法进行相对定量分析,并以2-△Ct×104作为目的基因mRNA的相对表达量。
1.4 免疫组织化学实验 宫颈癌或组织检查标本采用常规方法固定包埋和切片。免疫组织化学采用链霉素抗生物素-过氧化物酶(SP)法,Oct-4抗体浓度为1∶100。正常宫颈鳞状上皮组织作阴性对照,PBS取代一抗作为空白对照,光镜下观察Oct-4抗原阳性反应为位于细胞核内的棕黄色均匀细颗粒。任意选择8~10个高倍视野,选取1 000个瘤细胞中阳性染色细胞,阳性细胞率=(阳性表达瘤细胞数/1 000)×100%。平均光密度分析应用HMIAS-2000型全自动彩色图像分析系统。
1.5 统计学方法 应用SPSS11.5软件处理数据。计量资料比较分别采用单因素方差分析和q检验;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1Oct-4mRNA在正常宫颈组织和宫颈癌组织中的表达 正常宫颈组织和宫颈鳞癌组织的阳性表达率分别为15.0%(3/20)、66.0%(33/50),宫颈鳞癌组织Oct-4mRNA阳性表达率明显高于正常宫颈组织(χ2=14.875,P=0.000)。Oct-4mRNA在宫颈鳞癌组织中的相对表达量高于正常宫颈组织,宫颈鳞癌组织中分化和低分化高于高分化,宫颈鳞癌组织低分化又高于中分化(P<0.01),见表1。
表1 正常宫颈组织与宫颈鳞癌组织Oct-4mRNA表达量比较

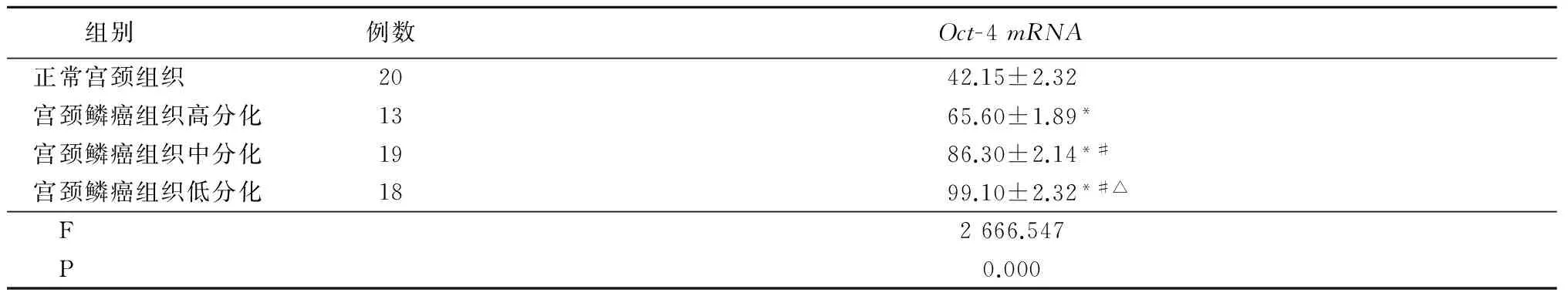
组别例数Oct-4mRNA正常宫颈组织2042.15±2.32宫颈鳞癌组织高分化1365.60±1.89*宫颈鳞癌组织中分化1986.30±2.14*#宫颈鳞癌组织低分化1899.10±2.32*#△ F2666.547 P0.000
*P<0.01与正常宫颈组织比较 #P<0.01与宫颈鳞癌组织高分化比较 △P<0.01与宫颈鳞癌组织中分化比较(q检验)
2.2Oct-4蛋白在宫颈正常组织和宫颈鳞癌组织中的表达Oct-4蛋白在宫颈鳞癌细胞中表达于核膜上,呈黄色或棕黄色。宫颈癌组织、正常宫颈的Oct-4蛋白阳性表达率分别为56.0%(28/50)和0.0%(0/20),差异有统计学意义(χ2=18.667,P=0.000)。
2.3Oct-4表达与宫颈癌临床病理学指标分析结果Oct-4在宫颈癌患者不同年龄、不同肿瘤直径、不同组织分型间差异均无统计学意义(P>0.05);在病理分级中,高分化与中分化Oct-4表达阳性率低于低分化(P<0.01),而中分化与高分化Oct-4表达阳性率之间差异无统计学意义(P>0.05);宫颈癌复发转移者Oct-4表达阳性率明显高于临床治愈者,差异有统计学意义(P<0.01)。见表2。

表2 宫颈癌患者在不同病理情况下Oct-4的表达
*P<0.01与低分化比较(χ2检验)
3 讨 论
宫颈癌的转移方式包括直接蔓延、淋巴结转移及血行转移等。肺、腹膜后淋巴结以及骨是最常见的远处转移部位。以放疗为主的同步放化疗是中晚期宫颈癌的主要治疗方法。虽然宫颈癌的放疗效果较好,然而仍有近35%的患者在治疗后出现复发转移,成为宫颈癌患者死亡的主要原因[10]。肿瘤干细胞是恶性肿瘤中存在的一群数量极少的肿瘤细胞,是肿瘤生长、侵袭、转移、复发和抗拒放化疗的根源[3]。Singh等[11]认为肿瘤干细胞的多少与肿瘤的恶性程度呈正相关,即肿瘤干细胞所占比例越大,恶性程度就越高。
哺乳动物在胚胎发育过程中受多种基因的调控,有序地进行组织分化和个体发育,Oct4基因就是关键基因之一。Oct-4由N端的Pou特异域和C端的Pou同源域构成,N端和C端富含羟脯氨酸和酸性残基的氨基酸,2个亚区则由15~56个氨基酸组成的易变区连接,通过结合ATGCAAAT的八聚体结构域活化相应的靶基因。Oct-4是研究发现最早、也是最重要的维持胚胎干细胞多潜能性和自我更新的基因。在胚胎发育早期可使胚胎干细胞维持未分化状态,被认为是重要的干细胞标志物[12]。Oct-4作为细胞多能性状态的最主要调节因子,当细胞未分化时,Oct-4发挥着双重调节功能。一方面,它可以维持细胞的未分化阶段;另一方面,也可以使细胞分化为另一细胞类型,同时它还可将已分化完成的体细胞逆转成为具有强分化潜能的细胞[13]。此外,Oct-4还可以激活特定的信号通路对细胞增殖分化产生作用,通过前馈系统、信号通路等对多种转录因子的表达进行调控[14]。Oct4既可以表达于胚胎以及生殖细胞肿瘤中,也可以表达于非生殖系统肿瘤细胞和组织中[15]。Oct-4在非生殖系统肿瘤细胞中表达的现象可能成为干细胞致癌的一种证据。研究发现,Oct-4虽然在肿瘤干细胞中表达升高,但在已经分化的体细胞中表达下调[16]。在胚胎干细胞中,敲除Oct-4基因后干细胞特性也会随之丧失[17]。但也有学者认为Oct-4蛋白在非胚胎性肿瘤细胞系和组织中的表达可能是假基因和亚型的影响[18]。因此,Oct-4是否在成体肿瘤组织中表达尚存分歧。
宫颈癌治疗后42%~50%的复发转移癌发生在治疗后1~2年内,少数发生在治疗后4~5年,5年后再发生则非常少见[19]。我们称治疗结束5年未复发的患者为临床治愈。因此,本研究分别采用PT-PCR法和免疫组织化学的方法分析了Oct-4基因和蛋白在宫颈癌组织和正常宫颈组织中的表达,以及在不同病理特征、放疗后出现转移复发和临床治愈患者中的表达状况,结果显示宫颈癌组织中Oct-4基因和蛋白的表达明显高于宫颈正常组织(P<0.01),Oct-4蛋白表达在患者不同年龄和不同病理类型之间差异无统计学意义(P>0.05)。肿瘤细胞的分化程度与肿瘤的侵袭能力密切相关,分化程度越低,其基因结构及表型越接近原始幼稚的干细胞。本研究结果显示,Oct-4阳性表达在宫颈浸润癌的病理组织不同分级中差异有统计学意义(P<0.01),阳性率随宫颈癌组织分化程度降低而增加,提示在低分化癌组织中幼稚干细胞样细胞数量比高分化癌组织要多;同时Oct-4在转移复发者宫颈癌组织中的表达明显高于其在临床治愈者中的表达,这提示Oct-4可以作为评估宫颈鳞癌预后的有效指标。
总之,肿瘤的发生、发展、转移和复发是一个异常复杂的过程,与许多基因、蛋白及信号转导通路相关。本研究发现宫颈癌组织中干细胞相关标志物Oct-4的高表达是癌细胞抗拒放疗的主要原因和易发生转移的危险因素之一。针对肿瘤干细胞的靶向治疗,有关Oct-4的研究可能为控制宫颈癌的转移复发、改善宫颈癌患者的预后提供新的治疗方向。
[1]TanigawaT,MatodaM,YamamotoA,etal.ClinicalusefulnessoftheoralchemotherapyagentS-1inheavilypre-treatedpatientswithadvancedorrecurrentcervicalcancer[J].ArchGynecolObstet,2015Aug25[Epubaheadofprint].
[2] 高琨,李力,韦玮,等.宫颈癌三维适形放疗临床疗效观察[J].河北医科大学学报,2011,32(8):945-947.
[3]RaoQX,YaoTT,ZhangBZ,etal.ExpressionandfunctionalroleofALDH1incervicalcarcinomacells[J].AsianPacJCancerPrev,2012,13(4):1325-1331.
[4]GuTT,LiuSY,ZhengPS.CytoplasmicNANOG-positivestromalcellspromotehumancervicalcancerprogression[J].AmJPathol,2012,181(2):652-661.
[5]KimK,RoJY,KimS,etal.Expressionofstem-cellmarkersoct-4andcd133:importantprognosticfactorsinpapillaryrenalcellcarcinoma[J].HumPathol,2012,43(12):2109-2016.
[6]AbdouAG,El-WahedMM,KandilMA,etal.Immunohistochemicalanalysisoftheroleandrelationshipbetweennotch-1andoct-4expressioninurinarybladdercarcinoma[J].APMIS,2013,121(10):982-996.
[7]StaudF,PavekP.Breastcancerresistanceprotein[J].IntJBiochemCellBiol,2005,37(4):720-725.
[8]KahnM.Wntsignalinginstemcellsandtumorstemcells[J].SeminReprodMed,2015,33(5):317-325.
[9]FengD,PengC,LiC,etal.Identificationandcharacterizationofcancerstem-likecellsfromprimarycarcinomaofthecervixuteri[J].OncolRep,2009,22(5):1129-1134.
[10]GoncalvesA,FabbmM,LhommeC,etal.AphaseⅡtrialtoevaluategefitinibassecond-orthird-linetreatmentinpatientswithrecurringlocoregionallyadvancedormetastaticcervicalcancer[J].GynecolOncol,2008,108(1):42-46.
[11]SinghSK,ClarkeID,HideT,etal.Cancerstemcellsinnervoussystemtumors[J].Oncogene,2004,23(43):7267-7273.
[12] 郑鹏生,曹浩哲.Oct-4基因的研究进展[J].西安交通大学学报:医学版,2010,31(5):521-526.
[13]AtlasiY,MowlaSJ,ZiaeeSA,etal.Oct-4,anembryonicstemcellmarker,ishighlyexpressedinbladdercancer[J].IntJCancer,2007,120(7):1598-1602.
[14]LeslieEM,DeeleyRG,ColeSP.Multidrugresistanceproteins:roleofP-glycoprotein,MRPI,MRP2,andBCRP(ABCG2)intissuedefense[J].ToxicolApplPharmacol,2005,204(3):216-237.
[15]MonsefN,SollerM,IsakssonM,etal.TheexpressionofpluripotencymarkerOct3/4inprostatecancerandbenignprostatehyperplasia[J].Prostate,2009,69(9):909-916.
[16]HoughSR,ClementsI,Welchog,etal.DifferentiationofMouseembryonicstemcellsafterRNAinterference-mediatedsilencingofOct-4andNanog[J].StemCells,2006,24(6):1467-1475.
[17]CabtzT,KeyG,BleidisselM,etal.AbsenceofOct-4expressioninsomatictumorcelllines[J].StemCells,2008,26(3):692-697.
[18]LiedtkeS,EnczmanJ,WaclawczykS,etal.Oct-4anditspseudogenesconfusestemcellresearch[J].CellStemCell,2007,1(4):364-366.
[19]QiuJT,AbdullahNA,ChouHH,etal.Outcomesandprognosisofpatientswithrecurrentcervicalcancerafterradicalhysterectomy[J].GynecolOncol,2012,127(3):472-477.
(本文编辑:许卓文)
Expression of stem cell gene Oct-4 in cervical cancer and clinical significance
LIUHong1,FANGZhao-hui1,ZHANGQian-ying1,LIKui-xiu1,FANXiao-mei1,CHENGJian-xin2*
(1.Department of Gynecological Tumor,the Fourth Hospital of Hebei Medical University,Shijiazhuang 050011,China;2.Department of Obstetrics and Gynecology,the Fourth Hospital of Hebei Medical University,Shijiazhuang 050011,China)
ObjectiveToexploretheexpressionofstemcellgeneOct-4incervicalcancer,andevaluateitsrelationshipwithpathologicalcharacteristicsandprognosisofcervicalcancer.MethodsFiftyparaffinsamplesofcervicalcancertissuesand20casesofnormalcervicaltissuespecimenswereobtained.Immunohistochemicalmethodandreversetranscriptionpolymerasechainreatction(RT-PCR)methodwereusedtodetectmRNAexpressionandOct-4proteinpositiverateinthenormalcervicaltissueanddifferentdifferentiationofcervicalcancertissueandOct4positiverateofproteinexpressionunderthedifferentpathologicalconditions.ResultsRT-PCRdetectionshowedthatOct-4mRNAexpressionincervicalcancertissuewassignificantlyhigherthanthatofnormalcervicaltissue(P<0.01).ImmunohistochemicalstainingshowedthatOct-4innormalcervicalsquamousepithelialtissuewasnegative,butthepositiverateincervicalcancerwas56.0%(P<0.01).Oct-4proteinexpressioninpatientswithdifferentagesandpathologicaltypesshowednostatisticalsignificance(P>0.05).But,Oct-4proteininpoorlydifferentiatedcervicalcancergroupwassignificantlyhigherthanthatinhighdifferentiationofcervicalcancertissue(P<0.01).Oct-4proteininpatientswithrecurrenceandmetastasisofcervicalcancerwassignificantlyhigherthanthatofclinicallycuredpatients(P<0.01).ConclusionOct-4incervicalcancerisincreasedanddownregulatedduringcelldifferentiation.AbnormalexpressionofOct-4proteinplaysanimportantroleinradioresistanceofcervicalcancer.
cervicalcancer;Oct-4;recurrence;metastasis;radiotherapy
2015-08-07;
2015-09-14
河北省科学技术研究与发展计划项目(14277770D)
刘红(1972-),女, 河北威县人,河北医科大学第四医院副主任医师,医学博士研究生,从事妇科肿瘤诊治研究。
*通讯作者。E-mail:jianxin_cheng@263.net
R
A
1007-3205(2015)11-1267-04

