Ni胁迫对不同基因型谷子幼苗生长及氮素代谢的影响
崔秀秀,张义贤
山西大学生命科学学院,太原 030006
Ni胁迫对不同基因型谷子幼苗生长及氮素代谢的影响
崔秀秀,张义贤*
山西大学生命科学学院,太原 030006
采用盆栽土培法,研究了不同浓度Ni2+(0、25、50、100、150、200 mg/kg)对4种基因型谷子(13- 36、B- 7、晋谷51号、晋谷52号)幼苗生长,Ni2+富集与转运能力,叶片中硝态氮、氨态氮、可溶性蛋白质、脯氨酸含量及氮代谢相关酶硝酸还原酶(NR)、谷氨酰胺合成酶(GS)、谷氨酸合酶(GOGAT)、谷氨酸脱氢酶(GDH)活性的影响。结果表明:Ni2+胁迫下,4种基因型谷子幼苗的根长、苗长、生物量随Ni2+浓度增加逐渐降低,体内Ni2+含量逐渐增加,与对照组差异显著(P<0.05)。在所试浓度范围内,4种基因型谷子幼苗叶片中的硝态氮含量、NR、GS、GOGAT活性表现为低浓度(25—50mg/kg)增高和高浓度(50—200 mg/kg)降低,而GDH活性在Ni2+浓度为100mg/kg以上时下降,氨态氮含量在50—150 mg/kg处理组中为对照的1.14—3.02倍。不同浓度Ni2+处理后,4种基因型谷子幼苗叶片中的脯氨酸含量均有不同程度的提高,而可溶性蛋白质含量呈明显下降趋势。实验结果证明,Ni2+胁迫抑制了谷子幼苗对硝态氮的吸收,降低了叶片中NR、GS、GOGAT活性,影响了氨的同化作用,使谷子幼苗的氮素代谢发生紊乱,不同基因型谷子对Ni2+胁迫的毒性效应存在差异。4种基因型谷子对Ni2+的耐性顺序为13- 36>B- 7>晋谷51>晋谷52。
谷子;Ni胁迫;生长响应;氮素代谢
镍(Ni)是一种广泛分布的重金属元素,由于现代工业的快速发展,采矿、冶炼、电镀等废弃物的产生,以及污泥和复合堆肥的使用,Ni已成为农业生态环境中的重要污染物[1]。研究表明,Ni是植物生长的必需微量元素之一,微量的镍能够促进种子萌发和幼苗的生长,延缓植物衰老[2]。镍还是脲酶的金属辅基,参与植物的氮素代谢,改善植物对氮素的利用率[3]。但过量的镍能阻滞植物的生长,使植物叶片卷曲,黄化,甚至死亡,还会干扰植物体内正常的物质代谢[4]。氮是植物生长发育中不可缺少的营养元素,氮素代谢也是植物重要的营养代谢之一[5],氮素代谢会影响植物的代谢、资源分配及生长和发育[6]。Ni胁迫可以通过抑制植物体内氮素代谢相关酶的活性,减少植物对氮的吸收与转运,引起氮代谢的变化[7]。
谷子(Setariaitalica(L.) Beauv)是一种起源于我国的特色禾谷类粮饲兼用作物,具有耐旱、耐瘠、营养丰富等特点,其蛋白质含量明显高于小麦、玉米和水稻等作物。在谷子生长发育和产量的形成中,需要吸收氮、磷、钾等多种营养元素,其中氮对谷子产量的作用最大[8]。目前,国内外有关重金属胁迫对谷子毒性影响的研究已有一些报道,Rout等[9]研究了Ni2+对谷子愈伤组织生长及蛋白质合成的抑制效应。肖志华等[10]研究了不同浓度Pb2+、Cu2+胁迫对谷子幼苗的叶绿素、可溶性蛋白质及DNA含量的影响。张义贤等[11- 12]研究了Cu2+、Pb2+胁迫对不同基因型谷子幼苗基因组DNA多态性的影响。张喜文等[13]研究了谷子幼苗对土壤Pb2+、Cr3+的生长响应及吸收积累的差异性。而有关Ni2+对谷子幼苗生长及氮素代谢的研究报道甚少。本实验采用盆栽土培法,研究了外源Ni2+胁迫下4种基因型谷子幼苗生长、生物量、叶片中含氮物质、氮代谢关键酶活性的变化及Ni2+吸收积累特性,以期了解镍污染对谷子幼苗生长发育的影响,探讨镍对谷子氮素代谢的毒害机制,比较不同基因型谷子幼苗对镍毒害的耐性差异,为重金属污染地区谷子的栽培管理及谷子品质改良提供参考依据。
1 材料与方法
1.1 试验材料
以山西省农科院谷子研究所提供的13- 36、B- 7、晋谷51号、晋谷52号4种基因型谷子(Setariaitalica(L.) Beauv)为试验材料。供试土壤为褐土,取自山西省农科院试验田0—20cm的表层土。土壤pH值为7.2,有机质含量为8.3g/kg,全氮含量为0.9mg/kg,速效P、K含量分别25.2、68.6 mg/kg,镍含量为12.52mg/kg,土壤含水量为31.2%。试验所用外源镍为NiCl2·6H2O(分析纯)。
1.2 试验处理
Ni2+处理浓度的设置参照我国农田土壤环境质量标准[14]中Ni2+污染临界值,用NiCl2·6H2O配制成25、50、100、150、200mg/kg(以纯Ni2+计)5个Ni2+浓度溶液,以去离子水作为对照。将配置好的Ni2+溶液分别加入装有2 kg土壤的陶瓷盆中(20cm×20cm),充分混匀后放置20d备用。精选籽粒饱满、大小均匀的谷子种子,用5%的NaClO消毒30min后洗净,放置在26℃培养箱中避光发芽。将萌发后的种子种于盆中,每盆50粒,在室内条件下培养30d后取样测试各指标,昼/夜温度为27℃/20℃,湿度为30%—50%,每天定时补充水分,以称重法确定失水量,每一处理设置3个重复。
1.3 测定指标与方法
1.3.1 生物量及Ni含量的测定
将培养30d的谷子幼苗整株取出,用去离子水洗净,然后将根浸入20mmol/L的EDTA-Na2溶液中交换20min,以去除根系表面吸附的Ni2+,再用去离子水洗净,吸水纸吸干表面水分,测量幼苗的根长、苗长(cm)。将谷子幼苗置于70℃烘箱中烘干至恒重,随机选取10株幼苗,称生物量(mg)(以平均值计)。根系耐性指数(RTI)[10]:
RTI=各处理的根长(cm)/对照的根长(cm)
另将烘干的谷子幼苗分为地上、地下两部分,研磨,分别称取0.1g,经4∶1 HNO3-HClO4消化,去离子水定容后用原子吸收分光光度计(SHIMADZU AA- 6300型)测定各样品中的Ni2+含量(mg/kg)[10]。
富集系数=植株地上部的重金属含量(mg/kg)/土壤中重金属含量(mg/kg)
转运系数=植株地上部的重金属含量(mg/kg)/根部的重金属含量(mg/kg)
1.3.2 氨态氮、硝态氮、可溶性蛋白质和游离脯氨酸含量的测定
选取谷子幼苗的新鲜叶片进行含氮物质的测定。其中,氨态氮含量的测定参照中国科学院上海植物生理研究所的方法[15];硝态氮含量的测定采用硝基水杨酸比色法[16],410nm波长下测定吸光度;可溶性蛋白质含量的测定采用考马斯亮蓝G- 250染色法[16];游离脯氨酸含量的测定采用磺基水杨酸法[16]。
1.3.3 酶的提取与活性测定
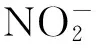
1.4 数据处理
实验数据采用Excel进行计算,并用SPSS 16.0进行差异显著性分析。
2 结果与分析
2.1 Ni2+胁迫对不同基因型谷子幼苗生长及生物量的影响
表1显示,与对照组相比,4种基因型谷子幼苗的根长、苗长、生物量随Ni2+处理浓度的增加逐渐下降,在200mg/kg时降至最低,与对照差异显著(P<0.05)。其中晋谷52受Ni2+胁迫的影响最大,植株长度和生物量分别比对照下降了34.2%和34.3%。在所试Ni2+浓度范围内,4种基因型谷子幼苗的根系耐性指数均小于对照组,表明Ni2+胁迫对谷子幼苗的根系生长有明显抑制作用。13- 36、B- 7、晋谷51、晋谷52对Ni2+的平均耐性指数分别为0.618、0.658、0.566、0.562,不同基因型之间差异显著(P<0.05),4种基因型谷子对Ni2+的耐性大小为B- 7>13- 36>晋谷51>晋谷52。
2.2 Ni2+在不同基因型谷子幼苗体内的吸收积累与迁移
富集系数(BCF)和转运系数(TF)能够反映植物对土壤中重金属的吸收和转运能力[17]。由表2可知,不同浓度Ni2+处理下,4种基因型谷子幼苗地上部、根部中Ni2+含量随处理浓度的升高逐渐增加,与对照差异显著(P<0.05)。在所试Ni2+处理浓度范围内,幼苗根部的Ni2+含量均明显高于地上部,表明Ni2+进入谷子幼苗体内主要积累在根部。从谷子幼苗对Ni2+的富集能力看,不同基因型间存在差异(P<0.05),4种谷子对Ni2+的富集能力为晋谷51>13- 36>B- 7>晋谷52。Ni2+由根部向地上部的转运能力也存在差异,4种谷子的转运能力为13- 36>B- 7>晋谷51>晋谷52。
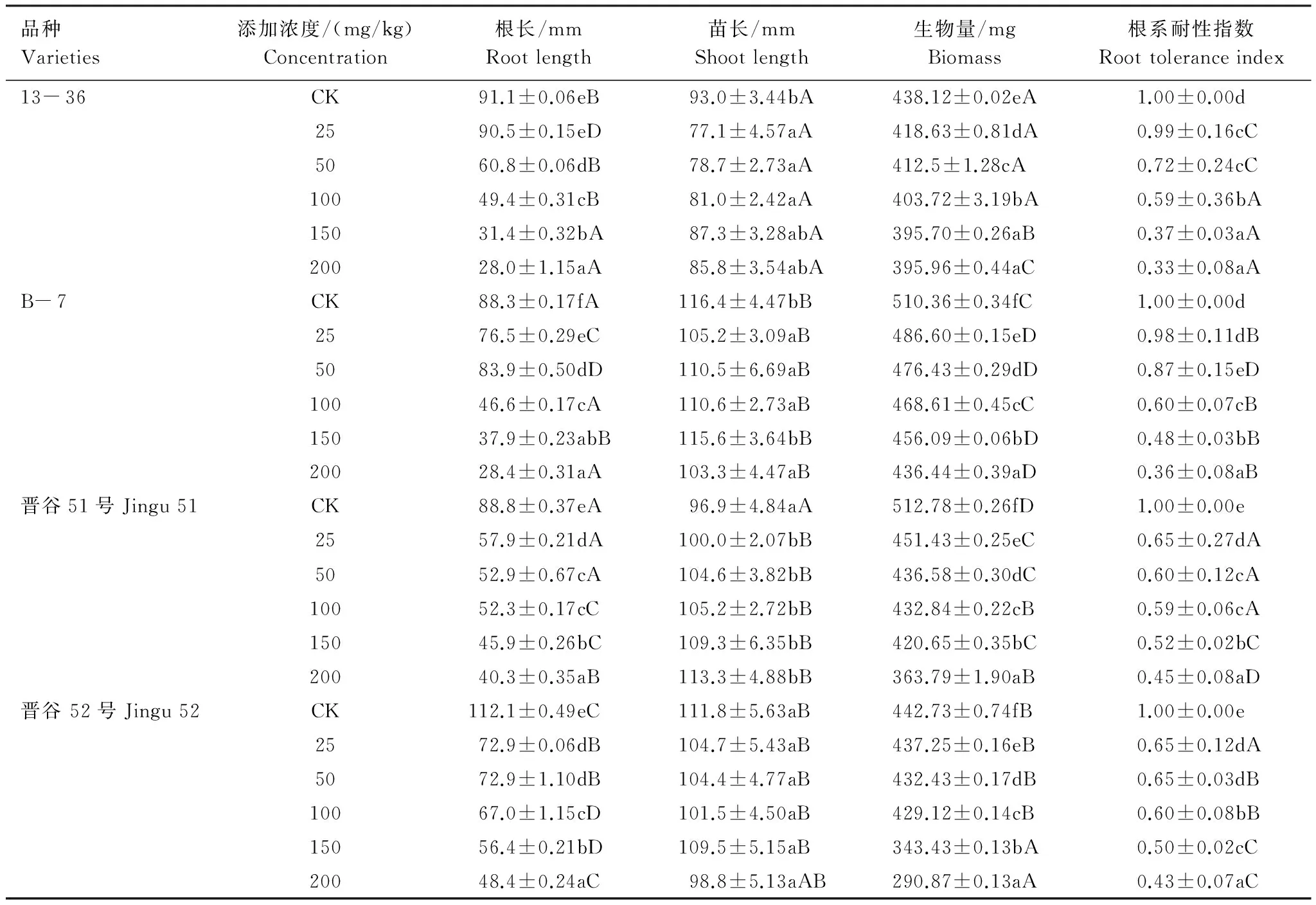
表1 Ni2+对不同基因型谷子幼苗生长及生物量的影响Table 1 Effects of the growth and biomass on different genotypes foxtail millet seedlings under Ni2+ stress
同列相同基因型不同小写字母表示差异显著(P<0.05);相同浓度不同基因型不同大写字母表示差异显著(P<0.05)
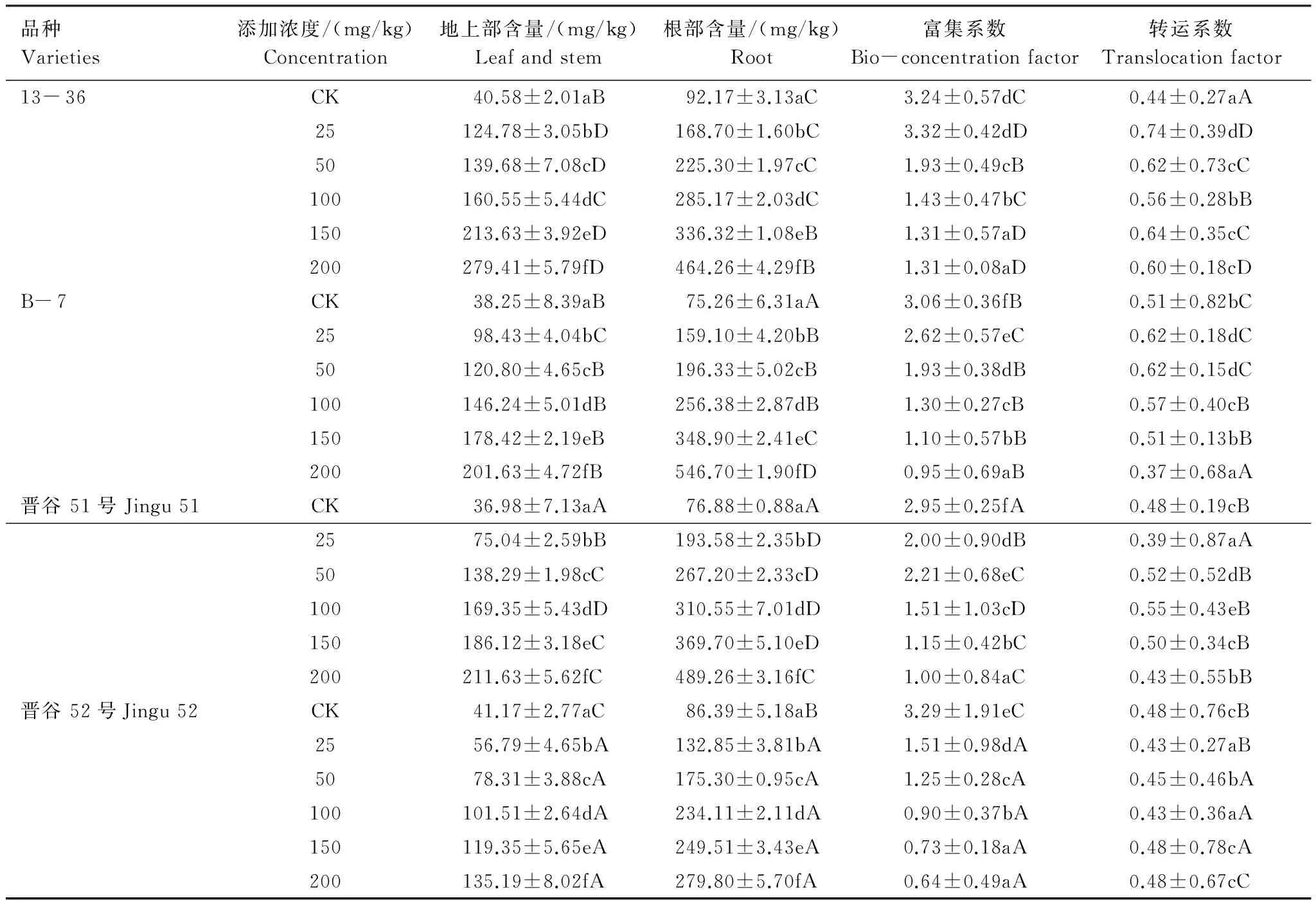
表2 Ni2+在不同基因型谷子幼苗体内的吸收、积累与迁移Table 2 The uptake,accumulation and transformation of Ni2+ in different genotypes foxtail millet Seedlings
2.3 Ni2+胁迫对不同基因型谷子幼苗硝态氮、氨态氮、游离脯氨酸及可溶性蛋白质含量的影响
由表3可以看出,在低浓度(25—50 mg/kg)Ni2+处理组中,4种基因型谷子幼苗叶片中硝态氮的含量逐渐上升,与对照相比差异显著(P<0.05)。当Ni2+处理浓度>50 mg/kg时,4种谷子叶片中硝态氮含量逐渐下降。4种基因型谷子叶片中的硝态氮含量为13- 36>B- 7>晋谷51>晋谷52。Ni2+处理下,4种谷子幼苗叶片中氨态氮含量随处理浓度的升高先增加后减少,在50—100 mg/kg范围内为对照的1.14—3.02倍,且不同处理组间差异显著(P<0.05),其中晋谷52叶片中氨态氮含量明显高于其他3种基因型。
表3 Ni2+胁迫对不同基因型谷子幼苗硝态氮、氨态氮、游离脯氨酸和可溶性蛋白质含量的影响
Table 3 Effects of Ni2+stress on contents of nitrate,ammonium,free praline and soluble proteins in different genotypes foxtail millet Seedlings
品种Varieties添加浓度/(mg/kg)Concentration氨态氮/(μg/g)Nitrate硝态氮/(μg/g)Ammonium可溶性蛋白质/(μg/g)Solubleprotein脯氨酸/(μg/g)Proline13-36CK338.66±0.73cC927.44±0.56bD81.13±0.35dD9.88±1.31aA25351.65±0.95dC1198.72±0.56dD79.31±1.13cdD10.41±0.05abA50381.16±0.55eC1343.57±0.05eD77.71±0.39bcD11.75±0.10bB100422.64±1.20fC1199.68±0.04dD76.12±0.96abD16.13±0.20cC150195.77±0.55bA1072.32±0.68cD76.16±1.47abD22.11±0.05dC200168.25±1.19aA828.12±0.56aD73.63±0.71aD25.40±0.30dCB-7CK423.92±0.27eD568.42±0.56dC62.45±0.48cB12.44±0.05aB25233.70±0.06aB636.10±2.01eC58.14±0.75cB13.65±0.04bB50249.35±0.04bB677.87±0.03fC56.24±0.81bcB15.55±0.04cC100292.02±1.42dA518.19±0.06cB53.23±2.67aB15.77±0.14cB150480.94±0.27fC498.43±2.01bC52.87±1.27abB23.12±0.11dD200264.23±1.52cC434.95±0.07aB51.35±0.25abB56.57±0.11eD晋谷51号Jingu51CK142.22±0.28aA534.99±0.56bB50.74±4.83bA13.49±0.03aC25331.02±0.27cC628.86±0.55dB49.12±4.39bA14.90±0.03bC50391.49±0.04eD634.56±1.24eB47.60±4.92aA15.33±0.14cC100373.99±1.00dB558.93±0.56cC43.98±2.59aA16.19±0.03dB150339.44±1.46fB487.11±0.56bB46.13±8.04aA16.33±0.05dD200198.02±0.97bB463.57±0.09aC42.84±4.14aA19.32±0.06eB晋谷52号Jingu52CK243.72±0.55dB320.40±0.27aA76.51±0.94cC9.72±0.05aA25134.38±0.82aA344.26±0.06dA73.27±1.26bC10.51±0.05aA50212.87±0.27bA361.07±0.28fA68.55±0.54aC10.97±0.08aA100736.01±1.09fD356.03±0.28eA72.53±0.80bC13.93±0.03bA150532.46±1.25eD332.69±0.28cA71.19±0.28bC14.49±1.27bA200157.14±0.27cA328.73±0.74bA70.71±0.55aC14.76±0.10bA
4种基因型谷子幼苗叶片中可溶性蛋白质含量随着Ni2+处理浓度的增加逐渐下降,当Ni2+浓度达到200 mg/kg时降至最低,分别比对照降低了9.24%,17.77%,15.57%,7.58%。13- 36和晋谷52叶片中可溶性蛋白质含量大于B- 7和晋谷51。Ni2+胁迫下,4种基因型谷子幼苗叶片中的脯氨酸含量随处理浓度的逐渐增加,与对照相比差异显著(P<0.05),且不同基因型之间存在差异(P<0.05),13- 36和B- 7的脯氨酸含量显著高于晋谷51和晋谷52。
2.4 Ni2+胁迫对不同基因型谷子幼苗NR、GS、GOGAT、GDH酶活性的影响
4种基因型谷子幼苗叶片中的NR活性随着Ni2+处理浓度的增加先升高后下降(表4),在100—150 mg/kg时为对照的1.02—1.54倍,不同基因型间差异显著(P<0.05)。除晋谷52外,其他谷子幼苗中GS、GOGAT活性均随Ni2+处理浓度升高先升后降,在50mg/kg时达到最大值,分别为对照的1.69、1.47、1.19倍和2.84、1.03、3.17倍。Ni2+胁迫下,4种谷子幼苗叶片中GDH活性在100 mg/kg时明显高于对照(P<0.05),此后逐渐下降。在25—100 mg/kg的Ni2+处理范围内,4种谷子叶片中GDH的活性大小为B- 7>晋谷51>晋谷52>13- 36。
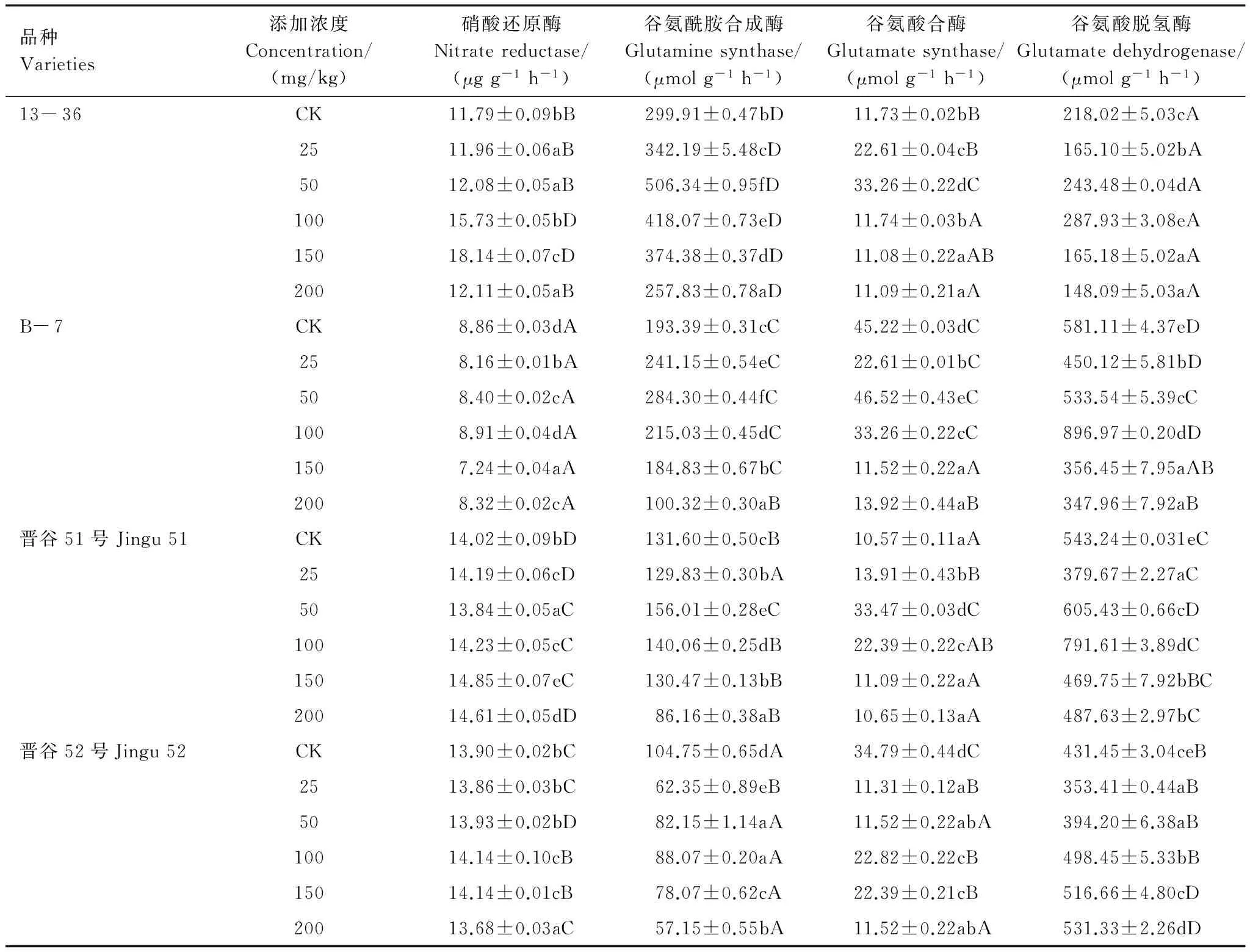
表4 Ni2+胁迫对不同基因型谷子幼苗GOGAT、GS、NR、GDH酶活性的影响Table 4 Effects of Ni2+ stress on activities of GOGAT,GS,NR and GDH in different genotypes foxtail millet Seedlings
3 讨论
大量研究证明,重金属进入土壤后具有积累性和不可分解性的特征,并参与土壤和生物体的循环过程。植物通过根系将重金属吸收进入根细胞内,并通过细胞间的运输向地上部转移[10]。本研究结果表明,在所试浓度(25—200mg/kg)范围内,4种基因型谷子幼苗体内的Ni2+含量显著增加(P<0.05),且根部含量远高于地上部。使谷子幼苗的生长受到明显抑制,根长、苗长显著低于对照,直接影响到生物量的生成。4种谷子幼苗的根系耐性指数均低于对照,富集系数和转运系数在不同基因型间存在明显的种内差异。表明Ni2+虽然是植物生长的必需微量元素,但在较高浓度处理后对幼苗的生长可造成明显的抑制和毒害效应,此结果与其他学者在小麦、玉米、水稻等作物中的研究结果相一致[17- 19]。



可溶性蛋白质是细胞基质及各种细胞器基质的主要组成成分,在细胞生理代谢过程中有重要的催化功能,其含量的变化在一定程度上能反映植物氮素代谢的情况[21]。本实验结果显示,在50—200mg/kg Ni2+浓度范围内,4种基因型谷子幼苗叶片中的可溶性蛋白质含量均有下降,B- 7和晋谷51的下降幅度大于13- 36和晋谷52,此现象可能与氮素吸收同化过程中关键酶(NR、GS、GOGAT)活性下降有关,导致无机氮向氨基酸的转化受到抑制,从而使蛋白质的合成受到抑制。
4 结论
(1) Ni2+胁迫使4种基因型谷子幼苗体内的Ni2+含量增加,抑制了谷子幼苗的生长,降低了生物量。4种基因型谷子对Ni2+的耐性大小为13- 36>B- 7>晋谷51>晋谷52。
(2) 50 mg/kg以上的Ni2+处理后,4种谷子幼苗体内硝态氮的含量均有下降,氮素代谢过程中几种关键酶(NR、GS、GOGAT)活性受到抑制,使谷子幼苗体内氨态氮积累,造成谷子幼苗氮素代谢过程紊乱。这种影响具有基因型之间的差异。
(3) 在本实验条件下,Ni2+胁迫使谷子幼苗体内可溶性蛋白质含量下降,脯氨酸含量增加,且脯氨酸对氨毒害具有明显的缓解作用。
[1] 王夔. 生命科学中的微量元素(第二版). 北京: 中国计量出版社, 1996: 331- 350.
[2] 张秀玲, 宋光煜. 植物的镍素营养. 土壤肥料, 2004, (6): 33- 36.
[3] Dixon N E, Gazzola C, Blakeley R L, Zemer B. Jack bean urease (EC. 3. 5. 1. 5.). Metalloenzyme. Simple biological role for nickel. Journal of the American Chemical Society, 1975, 97(14): 4131- 4133.
[4] Pandey N, Sharma C P. Effect of heavy metals Co2+, Ni2+and Cd2+on growth and metabolism of cabbage. Plant Science, 2002, 163(4): 753- 758.
[5] 郭智, 原海燕, 陈留根, 奥岩松. 镉胁迫对龙葵幼苗氮代谢及其相关酶活性的影响. 生态环境学报, 2010, 19(5): 1087- 1091.
[6] 于方明, 李燕, 刘可慧, 李明顺, 邓华, 杨栋林, 邓华, 杨栋林, 周振明. Mn对超富集植物短毛蓼和水蓼生长、Mn吸收及氮素代谢的影响. 环境科学学报, 2011, 31(8): 1783- 1789.
[7] Mishra P, Dubey R S. Nickel and Al-excess inhibit nitrate reductase but upregulate activities of aminating glutamate dehydrogenase and aminotransferases in growing rice seedlings. Plant Growth Regulation, 2011, 64(3): 251- 261.
[8] 张喜文, 武钊. 谷子栽培生理. 北京: 中国农业科学技术出版社, 1993: 1- 15.
[9] Rout G R, Samantaray S, Das P. In vitro selection and characterization of Ni-tolerant callus lines ofSetariaitalicaL. Acta Physiologiae Plantarum, 1998, 20(3): 269- 275.
[10] 肖志华, 张义贤, 张喜文, 李萍. 外源铅、铜胁迫对不同基因型谷子幼苗生理生态特性的影响. 生态学报, 2012, 32(3): 889- 897.
[11] 张义贤, 付亚萍, 肖志华, 张喜文, 李萍. 铜胁迫对不同基因型谷子幼苗基因组DNA多态性的影响. 环境科学, 2013, 34(10): 4090- 4095.
[12] 张义贤, 付亚萍, 肖志华, 张喜文, 李萍. 铅胁迫对不同基因型谷子幼苗生理特性及基因组DNA多态性的影响. 农业环境科学学报, 2013, 32(3): 478- 484.
[13] 张喜文, 张义贤, 李萍, 肖志华, 杨磊. 谷子幼苗对土壤铅、铬的生长响应及吸收积累的差异性. 植物研究, 2011, 31(6): 739- 743.
[14] GB 15618—1995, 中华人民共和国国家标准, 土壤环境质量标准. 1995.
[15] 中国科学院上海植物生理研究所. 现代植物生理学实验指南. 北京: 科学出版社, 1999: 152- 158.
[16] 李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000: 184- 217.
[17] 黄锦孙, 韦东普, 郭雪雁, 马义兵. 田间土壤外源铜镍在小麦中的累积及其毒害研究. 环境科学, 2012, 33(4): 1369- 1375.
[18] 马贵. 镍胁迫对玉米萌发和早期生长的影响. 安徽农业科学, 2010, 38(32): 18029- 18030.
[19] 王海华, 康健, 蒋明义. 高浓度镍对水稻幼苗生长及酶活性的影响. 作物学报, 2001, 27(6): 953- 957.
[20] 莫良玉, 吴良欢, 陶勤南. 高等植物GS/GOGAT循环研究进展. 植物营养与肥料学报, 2001, 7(2): 223- 231.
[21] 于方明, 孙银萍, 刘华, 李燕, 李艺, 刘可慧, 李明顺. Mn、Zn单一及复合污染对短毛蓼氮素代谢的影响. 农业环境科学学报, 2013, 32(3): 517- 523.
[22] 田华, 段美洋, 王兰. 植物硝酸还原酶功能的研究进展. 中国农学通报, 2009, 25(10): 96- 99.
[23] 刘丽, 甘志军, 王宪泽. 植物氮代谢硝酸还原酶水平调控机制的研究进展. 西北植物学报, 2004, 24(7): 1355- 1361.
[24] Matraszek R. Nitrate reductase activity of two leafy vegetables as affected by nickel and different nitrogen forms. Acta Physiologiae Plantarum, 2008, 30(3): 361- 370.
[25] Zhang Y Y, Zhou N, Liu P. Effect of Cu stress on nitrogen metabolism of NicotianalabacumL. seedling. Acta Ecologica Sinica, 2009, 29(12): 6779- 6784.
[26] Mäck G. Organ-specific changes in the activity and subunit composition of glutamine synthetase isoforms of barley (HordeumvulgareL.) after growth on different level of NH+4. Planta, 1995, 196(2): 231- 238.
[27] 于方明, 仇荣亮, 周小勇, 应蓉蓉, 汤叶涛, 赵璇, 胡鹏杰, 曾晓雯. 镉对超富集植物圆锥南芥氮素代谢的影响研究. 土壤学报, 2008, 45(3): 497- 502.
[28] 王志强, 王春丽, 林同保. 外源钙离子对小麦幼苗氮素代谢的影响. 生态学报, 2008, 28(8): 3662- 3667.
[29] LinY C, Kao C H. Proline accumulation induced by excess nickel in detached rice leaves. Biologia Plantarum, 2007, 51 (2): 351- 354.
[30] Brugiere N, Dubois F, Limami A M, Lelamdais M, Poux Y, Sangwan R S, Hirel B. Glutamine synthetase in the phloem plays a major role in controlling proline production. Plant Cell, 1999, 11(10): 1995- 2012.
Effect of Ni on the growth and nitrogen metabolism in foxtail millet seedlings of different genotypes
CUI Xiuxiu, ZHANG Yixian*
CollegeofLifeScience,ShanxiUniversity,Taiyuan030006,China
Nowadays, soil pollution by Ni2+is getting more severe in some place of China. Nickel (Ni) is an essential microelement of plants, however, large Ni2+accumulation in crops leads to necrosis of plant leaf, lignification of stem and growth inhibition of root. The mechanisms of the Ni2+toxicity are not well understood for nitrogen metabolism of higher plants. In this study, pot culture was conducted to investigate the effects of Ni2+on the growth of roots and shoots, biomass, the uptake and accumulation of Ni2+, the contents of nitrate nitrogen, ammonium nitrogen, free proline and soluble proteins, the nitrogen metabolism key enzymatic activities including nitrate reductase (NR), glutamine synthase (GS), glutamate synthase (GOGAT), glutamate dehydrogenase (GDH) in four genotypes (13- 36, B- 7, Jingu 51, Jingu 52) of foxtail millet (Setariaitalica(L.) Beauv) seedlings from Shanxi, China. The foxtail millet seeds were cultured in incubators at 26℃ for germination with no light, then planted in the pots spiked with five different Ni2+concentration, namely 25, 50, 100, 150, 200 (mg/kg). The experimental results showed that with the rise of Ni2+concentration the root length, shoot length and biomass declined and the accumulation of Ni2+increased gradually, which formed a sharp contrast with the control group (P<0.05). In the range of test Ni2+concentration, the content of nitrate nitrogen, the activities of NR, GS, GOGAT of four genotypes of foxtail millet characterized by increasing at low concentration (25—50mg/kg) and declining at high concentration (50—200 mg/kg). The activities of NR, GS, GOGAT reached the peak values when exposed to 50mg/kg Ni2+. The nitrate nitrogen contents and NR activities in 13- 36 were higher than other three genotypes (P<0.05). The activities of GS and GOGAT in 13- 36, B- 7, Jingu51 were 1.69, 1.47, 1.19 and 2.84, 1.03, 3.17 times than those of control group in 50mg/kg Ni2+exposure. However, The GDH activities decreased when the Ni2+concentration higher than 100mg/kg. Ni2+treatments increased the accumulation of ammonium nitrogen in range of 50 to150 mg/kg in the leaves of four foxtail millet and were 1.14 to 3.02 times than control group. Besides these, with the increasing of Ni2+concentration, the content of free proline increased, the soluble protein decreased. Synthesize the above results, we found that Ni2+treatments impaired N assimilation in foxtail millet seedlings by restraining the absorption of nitrate nitrogen and inhibiting the activities of NR, GS and GOGAT, which lead to nitrogen metabolism disturbance. And the toxicity effect was different among different genotypes of foxtail millet. Further, Ni2+stress inhibited the growth of foxtail millet. The tolerance order of four foxtail millets to Ni2+was 13- 36>B- 7>Jingu51>Jingu52.
foxtail millet (Setariaitalica(L) Beauv); Ni stress; growth response; nitrogen metabolism
国家农业产业技术体系专项基金项目(nycytx- 13);山西省自然科学基金项目(2006011074)
2013- 10- 08;
2014- 11- 17
10.5846/stxb201310082415
*通讯作者Corresponding author.E-mail: zhangyx@sxu.edu.cn
崔秀秀,张义贤.Ni胁迫对不同基因型谷子幼苗生长及氮素代谢的影响.生态学报,2015,35(10):3244- 3251.
Cui X X, Zhang Y X.Effect of Ni on the growth and nitrogen metabolism in foxtail millet seedlings of different genotypes.Acta Ecologica Sinica,2015,35(10):3244- 3251.

