低于15公斤患儿心脏手术围体外循环期改良节约用血策略的安全性分析
邹丽华,刘晋萍,冯正义,赵 举,崔勇丽,赵明霞,李守军,闫 军,晏馥霞,王 旭
·临床研究·
低于15公斤患儿心脏手术围体外循环期改良节约用血策略的安全性分析
邹丽华,刘晋萍,冯正义,赵 举,崔勇丽,赵明霞,李守军,闫 军,晏馥霞,王 旭
目的 探索改良节约用血策略对体重≤15 kg先天性心脏病患儿的安全性,并分析体外循环中传统与改良库血预充策略对患儿围术期血制品输注情况及近期临床预后。方法 自2011年2月至2013年10月,按入选标准先后纳入531例先天性心脏病患儿。传统组(C组,n=248例)患儿采用库血预充方案,改良组(M组,n=283例)患儿实施改良节约用血策略即无库血预充方案,所有患儿行体外循环下心脏手术,收集转前及转中、转后不同时点的血气指标及围术期的资料。结果
体外循环;婴幼儿;节约用血
众所周知,在新生儿和低体重婴幼儿先天性心脏病矫治手术中,因整套体外循环管路的预充量与患儿血容量的比值较大,常需预充库存红细胞以提高体外循环(cardiopulmonary bypass,CPB)术中红细胞比容(Hct)[1]。尽管近年由异体红细胞输注引起的传染病传播已得到改善,但输注红细胞尤其是少白红细胞与免疫调节相关,可能会影响感染发生风险[2-3]。Silliman等学者提出输血是引起术后多器官衰竭的重要因素,而血制品的贮存时间则与输血后发病率呈正相关[4]。Chang提出在危重症患儿中必须遵循以下原则:避免输血所引发的并发症,同时减少输血,加强输血的安全性意识[5]。因此,在改善先天性心脏病患儿心脏手术预后的临床工作中,减少血制品输入将是重要环节。本研究旨在CPB期间综合多项技术进行改良节约用血,探索其对近期预后的影响,分析其在先天性心脏病患儿手术中的安全性。
1 资料与方法
本研究经阜外心血管病医院医学伦理委员会审批(伦理编号2014-600),患儿家属于术前签属知情同意书。
1.1 一般资料与分组 自2011年2月至2013年10月,共531例先天性心脏病患儿纳入本研究。其中自2011年2月至2012年8月共248例患儿采用传统血液保护策略即含库血CPB预充方案进行相应的外科手术治疗,设为传统组;自2012年8月至2013年10月共有283例患儿通过实施改良节约用血策略进行相应的外科治疗,设为改良组。本研究的全部患儿由长期固定小儿心脏中心的3名高年资心外科医生、2名小儿麻醉医生和2名灌注医生组成的手术团队完成。
1.2 研究对象入选指征 ①体重≤15 kg行择期手术的先天性心脏病患儿;②非罕见病例或新开展术式;③术前血液动力学稳定,心功能分级为Ⅰ~Ⅱ级,非危重症或垂危患儿;④ 术前无肝肾功能及神经系统相关疾病;⑤术前无凝血功能障碍;⑥术前未使用影响凝血功能的药物,如阿司匹林、前列环素等;⑦无同期感染存在。
1.3 麻醉及体外循环方法 患儿入室,进行麻醉诱导气管插管及机械通气,术中行静脉吸入复合麻醉。CPB采用人工心肺机(Jostra HL20,德国),婴儿型膜肺(Terumo Baby Rx05,日本),婴儿C、D型管道(天津塑料研究所),婴儿型(10~20 kg)或新婴儿型(<10 kg)动脉微栓滤器(宁波,中国),心肌保护全部采用冷晶体St.Thomas(阜外心血管病医院制剂室)或康斯特(HTK液,德国科勒公司)保护液经机械泵由灌注装置(天津塑料研究所)灌注主动脉根部。全部患儿术中安装血液超滤器(Maquet,德国)。
将CPB管路、氧合器、动脉微栓滤器、血液超滤器及心肌灌注装置等连接并置入机械滚压泵内。加入复方电解质注射液(勃脉力,美国百特公司)500 ml进行预充排气,并且主泵相连接的改良超滤装置一并排气,排气完毕后将氧合器回流室内晶体液排空至底部,再加入人工胶体液(佳乐施,德国贝朗)10~20 ml/kg。传统输血组给予含2 000 U肝素的少白悬浮红细胞1~2 U、适量人工胶体液如琥珀酰明胶及5%碳酸氢钠20 ml加入回流室内,缓慢启动主泵再从静脉管路端排出一定量的晶体液后,提速主泵,混合管路内的液体,并相应给予保温。改良组则只将30~40 ml/kg人工胶体液及晶体液混合,给予5%碳酸氢钠20 ml,缓慢启动主泵再从静脉管路端排出一定量的晶体液后,混合管路内的液体,并相应进行保温。
改良组患儿常规安装负压辅助静脉引流(assisted venous drainage,VAVD),转流开始后启动,在转流结束前逐步关闭,停CPB后改良超滤至Hct>0.27及以上(视体重和术前Hct水平而定),血浆胶体渗透压(colloid osmotic pressure,COP)达到16~18mm Hg。全部患儿术中安装血液超滤器,并可根据术中的血液稀释度和血代谢指标的变化全程进行常规+零平衡超滤管理(见图1中的动静脉超滤1),停机后常规进行动脉-静脉(A-V)改良超滤(modified ultrafiltration,MUF)5~10 min,流量控制在5~10 ml/(kg·min)。两组患儿所实施节约用血策略的异同总结见表1与图1。
1.4 观察指标 ①术前:收集术前患儿的一般资料包括性别,年龄,体重,心脏手术史;术前常规检查如血常规、肝肾功能、血糖水平、心胸比、射血分数(EF)等,先天性心脏病手术根据RACHS评分系统进行分类。②术中:CPB时间,主动脉阻断时间,CPB期间不同时点的血气指标,血制品输入量,COP等。③术后:麻醉关胸期间和术后ICU、病房的血制品输入量,机械通气时间,ICU停留时间,肝肾功能。记录是否二次开胸止血、腹透、再次气管插管、死亡、住院时间。
1.5 统计学处理 所有数据采用SPSS 19.0软件进行分析,符合正态分布的计量资料用均数±标准差(±s)表示,两组间比较采用独立样本t检验,各组不同时间点资料比较采用重复测量数据方差分析。不符合正态分布的计量资料用中位数和四分位间距表示,两组间比较采用Mann-Whitney U检验,多组间比较采用Kruskal Wallis H检验。分类变量以频数(百分比)表示,采用卡方检验进行比较,当理论频数小于5或样本量小于40时,采用Fisher精确概率法。P<0.05表示有统计学差异。

图1 改良CPB策略示意图

表1 两组节约用血策略的异同介绍
2 结 果
2.1 两组患儿一般资料和术中情况 术前比较:年龄、体重、性别、心胸比、术前EF、紫绀患儿比例、再次心脏手术患儿比例以及RACHS评分在两组间均无统计学差异(P>0.05),见表1。术中比较:体外循环时间、主动脉阻断时间两组间无统计学差异(P>0.05);两组患儿术前Hct无统计学差异(P=0.078),但改良组患儿术中最低Hct显著低于传统组(P=0.041),停机MUF后的Hct值两组间无显著性差异(P=0.814)。改良组患儿静态预充量明显少于传统组(P=0.023)。见表2。
两组患儿PaO2在CPB 10 min和停机前均较转机前增高,存在统计学差异(P<0.05),组间比较无统计学差异。两组患儿的Hct水平在CPB开始10 min时均较转流前明显降低(P<0.05),且改良组Hct水平低于传统组,两组间存在统计学差异(P<0.05)。两组患儿的Glu水平在停机前和停机MUF后均高于转流前,存在统计学差异(P<0.05),组间比较无统计学差异。两组患儿COP水平在转流后10 min降至最低水平,与转流前比较具有统计学差异(P<0.05),组间无统计学差异。两组患儿术中的血气变化在组间和不同时点均无统计学差异。见表3。
2.2 两组患儿围术期输血情况 改良组与传统组患儿术中输入不同单位库血的构成比有显著差异(P<0.001),即改良组患儿在输入1 U或2 U库存红细胞的人数比例明显少于传统组。在传统组患儿中有16例(6.4%)CPB中输入2单位库血,有232例(93.6%)CPB中输入1单位库血;而在改良组中,仅有5例(1.8%)在CPB中输入2单位库血,有116例(41%)CPB输入1单位库血,162例(57.2%)顺利完成CPB中免输血手术。术后改良组患儿的红细胞输入显著少于传统组(P=0.003),而且两组间不同单位红细胞输入的构成比有统计学差异,即改良组术后输入1U或2U库存红细胞的人员比率明显低于传统组(P=0.009)。见表4。
2.3 两组患儿手术近期预后情况比较 传统组(n=248)中患儿术后死亡3例,2例死于术后心功能衰竭,1例因多器官功能衰竭自动放弃治疗;改良组(n=283)中患儿术后死亡2例,其中1例因术后感染致多器官功能衰竭;1例术后因左心功能不良无法脱离CPB,接受体外膜肺氧合(extracorporealmembrane oxygenation,ECMO)支持治疗,脱离ECMO后因再次发生恶性心律失常抢救无效死亡。改良组患儿的机械通气时间和ICU停留时间均短于传统组患儿(P=0.028,P=0.034),24 h胸液引流量明显少于传统组(P=0.012)。两组的住院时间、术后再次气管插管、腹透以及住院死亡发生例数均无统计学差异。术后24 h血清中各项生化指标均无统计学差异(P>0.05)。见表5。两组患儿除死亡病例外,在手术后的短期观察中均无意识障碍,肢体瘫痪,失聪,失明,延迟苏醒等中枢神经系统并发症发生。
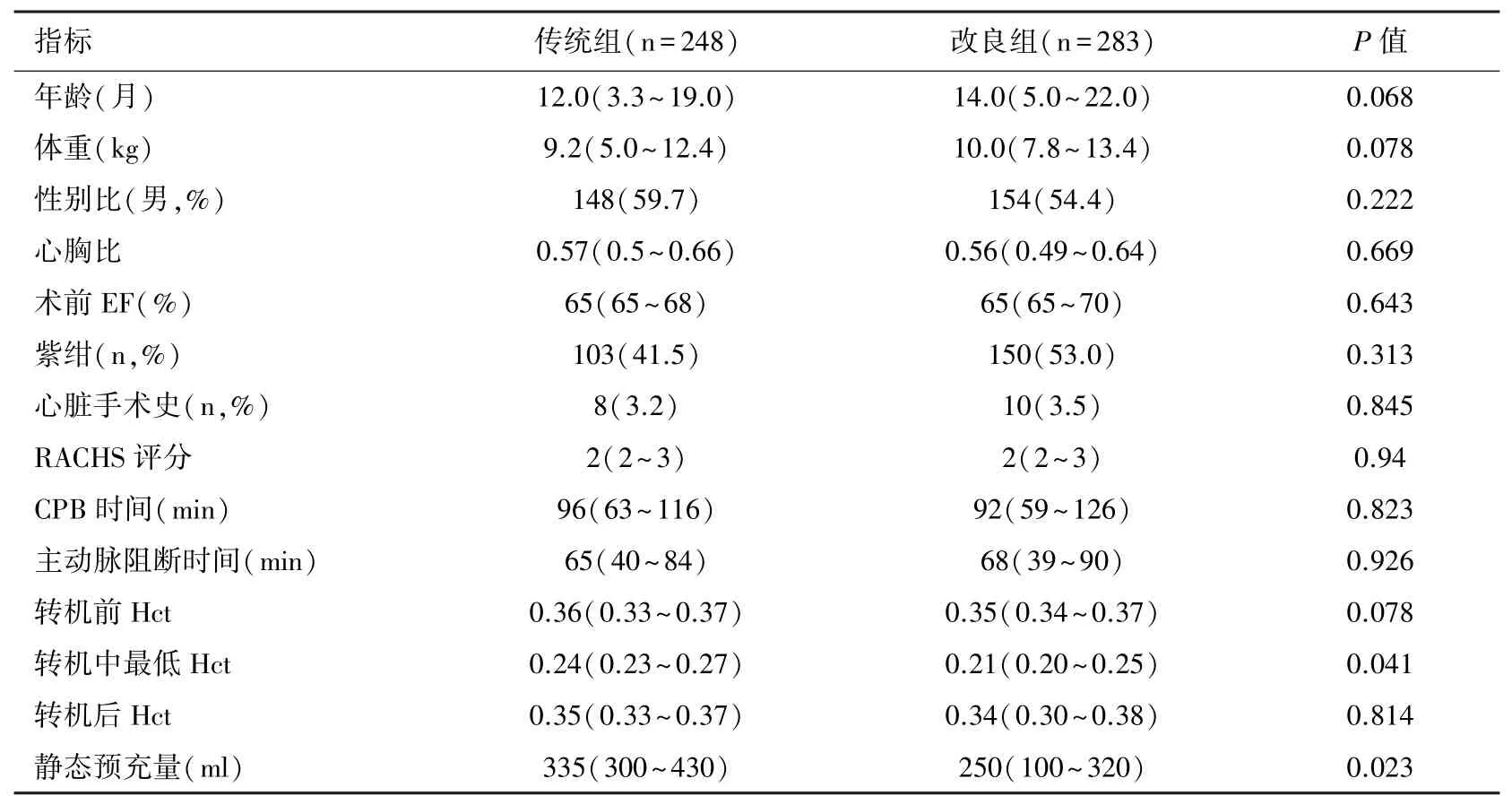
表2 传统组和改良组患儿一般资料和术中情况
表3 传统组与改良组患儿围术期动脉血气重要指标和COP的变化(±s)

表3 传统组与改良组患儿围术期动脉血气重要指标和COP的变化(±s)
注:与转前相比,*P<0.05;与传统组相比#P<0.05;PaCO2:动脉血二氧化碳分压;PaO2:动脉血氧分压。
?

表4 改良组与传统组患儿围术期血制品输入情况的比较

表5 改良组与传统组患儿术后近期恢复的比较
3 讨 论
本研究主要从改变血制品预充和硬件设施两方面着手,即通过无库血预充、缩小管路内径尺寸以减少管路预充量、术中的血液回收技术减少血液丢失及术后的改良超滤技术(MUF)进一步提高血红蛋白水平,同时增加脑氧饱和度和连续血气监测(CDI 500实时监测)技术。
目前,在国内各家心脏中心所开展的先天性心脏病治疗状况和本课题前期所做的围CPB期用血量的初步调查,发现以往超过95%的15 kg以下先天性心脏病患儿需要在围术期输入库存红细胞,因此,选择体重≤15 kg患儿进行免输血技术的研究。通过实施改良节约用血策略,结果证实改良组患儿在术中红细胞用量少于传统组,而且两组间患儿术中输入不同单位库血的构成比存在统计学差异(P<0.001),改良组患儿术后的红细胞输入明显少于传统组(P=0.003),组间术后不同单位红细胞输入的构成比存在统计学差异。因此,血制品输注明显减少与临床相关硬件设施的改进及围术期节约用血意识的增强密不可分。
CPB设备和技术的改进为先天性心脏病患儿围CPB期减少血制品输入奠定了重要基础。其中新生儿和婴儿型管路是减少CPB预充量的关键环节,也是实施免输血手术的重要保障。在国内各心脏中心先天性心脏病患儿(≤15 kg)普遍应用的最小尺寸婴儿型A-V管路内径均是1/4英寸(婴儿C管路),即使连接婴儿型膜肺,其静态预充量(静止状态下全部管路加回流室内最小安全转流液面的液体量)也将达到400~500 ml。本研究中使用迷你型的CPB管路,将主动脉泵管内径调整至3/16英寸,静脉回流管路保持1/4英寸,其余连接管路调整至5/32英寸,使得最大转流流量可达到1.2 L/min,管路静态预充量可减少至250ml左右,适合1岁以下、体重≤10 kg的患儿(婴儿D管路);若配合使用新型的动脉微栓滤器一体化氧合器,将进一步减少静态预充量至180~200ml。此项改进为减少预充量尤其是开展低体重先天性心脏病患儿的免输血、少输血技术奠定了重要基础。
除管路改进外,本研究还将VAVD加入到改良节约用血策略中,常规放置在人工心肺机上,与氧合器回流室上端的气体排放口连接。负压源接至可连续提供负压的手术室中心装置上。VAVD一方面可以为低体重患儿使用新型婴儿D管路和更加细化的静脉插管带来方便;另一方面,对于通过抬高氧合器以缩小机器与术野距离而达到减少预充量的改良策略提供了安全保障[6-7]。但该装置的临床使用需要经过技术培训,术中渐进式调节负压最大控制在-30~-40 mm Hg之间;转流开始后启动VAVD,转流结束前先关掉VAVD再停机等[6]。本研究中,改良组患儿均使用了VAVD,未发生与其相关的临床意外,而且还为开展改良节约用血策略提供重要保障。
MUF技术是上世纪九十年代末,由英国儿童医院Dr.Naik等首先提出并使用的一项技术[8]。它克服了常规超滤技术只能在CPB中进行滤水的缺点,通过A-V回路的连接,对于部分患儿CPB中回流室容量不多,而在CPB结束前的Hct水平未达到满意状态,在CPB结束后立即进行5~10 min的超滤。大量临床数据证实,MUF技术对提高新生儿和婴幼儿的Hct水平,改善血流动力学和保护术后早期的肺功能起到了积极的治疗意义[9-12]。经典的 MUF连接是从主动脉管路分流出动脉血液后经过滚压泵流入人工肾,再回流经静脉管路(1/4英寸)入右心房。为了更有效地进行MUF,本研究将血液超滤器滤过的血液经心肌停搏液管路(1/16英寸)回流入右心房,再将静脉管路内的血液引流至回流室内(见图4)。一方面是为了减少MUF过程中滤过后的静脉回路预充量,另一方面可以通过回收静脉管路内血液增加回流室内的储血量,加强MUF的滤水效果,使得改良组患儿虽然在停机前的Hct水平明显低于传统组,但在MUF后即可达到与传统输血组相近的Hct水平。
通过实施改良节约用血策略,使得改良组患儿的CPB期间血制品用量明显少于传统组,此外,随着围术期节约用血意识的增强,患儿近期预后得到明显改善。因此,CPB期间改良节约用血策略在体重≤15 kg先天性心脏病患儿中使用具有安全性。
[1] 冯正义,李桂芬,刘晋萍,等.改良超滤对婴幼儿心脏手术输血的影响[J].临床麻醉学杂志,2004,20(6):336-337.
[2] Raghavan M,Marik PE.Marik.Anemia,allogenic blood transfusion,and immunomodulation in the critically ill[J].Chest,2005,127(1):295-307.
[3] Leal-Noval SR,Munoz-Gomez M,Arellano V,et al.Influence of red blood cell transfusion on CD4+T-helper cells immune response in patients undergoing cardiac surgery[J].J Surg Res,2010,164(1):43-49.
[4] Silliman CC,Chaffin DJ.Broken hearts and transfusion-related acute lung injury[J].Crit Care Med,2012,40(10):2909-2910.
[5] Chang TT.Transfusion therapy in critically ill children[J].Pediatr Neonatol,2008,49(2):5-12.
[6] Durandy Y.Vacuum-assisted venous drainage,angel or demon:PRO[J]?JExtra Corpor Technol,2013,45(2):122-127.
[7] Willcox TW.Vacuum Assist:Angel or Demon Con[J].J Extra Corpor Technol,2013,45(2):128-132.
[8] Naik SK,Knight A,Elliott M.A prospective randomized study of amodified technique of ultrafiltration during pediatric open-heart surgery[J].Circulation,1991,84(5 Suppl):III422-431.
[9] Boodhwani M,Williams K,Babaev A,et al.Ultrafiltration reduces blood transfusions following cardiac surgery:A meta-analysis[J].Eur JCardiothorac Surg,2006,30(6):892-897.
[10] Maluf MA,Mangia C,Silva C,et al.Conventional and conventional plusmodified ultrafiltration during cardiac surgery in highrisk congenital heart disease[J].J Cardiovasc Surg(Torino),2001,42(4):465-473.
[11] Sever K,Tansel T,Basaran M,et al.The benefits of continuous ultrafiltration in pediatric cardiac surgery[J].Scand Cardiovasc J,2004,38(5):307-311.
[12] Williams GD,Ramamoorthy C,Chu L,et al.Modified and conventional ultrafiltration during pediatric cardiac surgery:clinical outcomes compared[J].J Thorac Cardiovasc Surg,2006,132(6):1291-1298.
The safety analysis of blood-sparing strategy during cardiopulmonary bypass in infants w ith body weight lower than 15 kg
Zou Li-hua,Liu Jin-ping,Feng Zheng-yi,Zhao Ju,Cui Yong-li,Zhao Ming-xia,Li Shou-jun,Yan Jun,Yan Fu-xia,Wang Xu
Department ofCardiopulmonary Bypass,Cardiovascular Institute and Fu Wai Hospital,Peking Union Medical College&Chinese Academy ofMedical Sciences,Beijing 100037,China
Liu Jin-ping,Email:jinpingfw@hotmail.com
ObjectiveTo evaluate the safety ofmodified blood-sparing approach in low-body weight infants(≤15 kg)with congenital heart disease,we analyzed the effect of blood-free priming strategy on transfusion requirements and short-term prognosis.MethodsA total of531 infantswere included betweenFebruary 2011 and October 2013,according to internalize standard strictly,infants were divided into two groups:control group(C group,n=248)for traditional priming strategy,andmodified group(M group,n=283)for a new blood-sparing approach.All infants experienced routine heart surgery with cardiopulmonary bypass.Blood samples were collected as following time points:pre-CPB,10min after CPB,before termination of CPB,aftermodified ultrafiltration.Clinic data and transfusion requirements were collected during operation,in ICU,and in ward.ResultsIn the study,packed red blood cell during admission in M group were less than C group(P<0.01),as well as endotracheal intubation time,ICU stay,and total 24-hour chest tube output(P=0.028,P=0.034,P=0.012),however there was no difference in admission time,re-intubation,peritoneal dialysis and death between two groups(P>0.05).ConclusionOur research elucidated thatmodified blood-sparing approach can reduce blood transfusion during admission without poorer outcome.
Cardiopulmonary bypass;Infants;Blood-sparing strategy
2015-04-07)
2015-04-15)
10.13498/j.cnki.chin.j.ecc.2015.02.08
首都临床特色应用研究(Z131107002213172);协和医学院研究生创新基金(2013-1002-29)
100037北京,北京协和医学院,中国医学科学院,
阜外心血管病医院体外循环科(邹丽华、刘晋萍、冯正义、赵举、崔勇丽、赵明霞),小儿心脏外科(李守军、闫 军、王旭),麻醉科(晏馥霞)
刘晋萍,Email:jinpingfw@hotmail.com
两组患儿初步分析表明,改良组患儿围术期红细胞用量明显少于传统组(P<0.001);改良组患儿术后机械通气时间、ICU停留时间及24 h胸液引流量明显低于传统组(P=0.028,P=0.034,P=0.012);两组患儿住院时间、再次气管插管、术后腹透及死亡率等均无统计学差异(P>0.05)。结论 在体重≤15 kg先天性心脏病患儿体外循环期间实施改良节约用血策略是安全可行的,该策略有助于减少围术期的血制品用量,改善患儿近期预后。
——体外循环质量控制的基石

