褪黑素受体对大鼠心肌缺血再灌注损伤的调控及其机制研究
赵国龙,张秋芳,翟蒙恩,于立明,高文丽,金振晓,段维勋,俞世强,王 云
·基础研究·
褪黑素受体对大鼠心肌缺血再灌注损伤的调控及其机制研究
赵国龙,张秋芳,翟蒙恩,于立明,高文丽,金振晓,段维勋,俞世强,王 云
目的 研究褪黑素膜受体(MR)在褪黑素(Mel)抗心肌缺血再灌注(MI/R)损伤机制中的作用。方法 雄性SD大鼠80只随机分为四组:假手术组(Sham)、MI/R+溶剂对照组(MI/R+V)、MI/R+Mel治疗组(MI/R+Mel)、MI/R+Mel+Luz组(MI/R+Mel+Luz),Luz(Luzindole)为MR特异性阻断剂。大鼠冠状动脉左前降支结扎和松开方法建立大鼠MI/R模型,心肌缺血30min,再灌6 h后ELISA法检测心肌组织氧化应激相关指标,TUNEL法检测心肌细胞凋亡率,Evans blue-TTC双染法测定梗死面积,Western blot法检测沉默信息转录调控因子1(SIRT1)、乙酰化叉头转录因子1(Ac-Foxo1)、Caspase-3及褪黑素受体(MR)的表达水平,再灌注72 h后超声心动图法检测各组大鼠心功能。结果 与缺血再灌注组相比,Mel治疗显著改善心脏左室射血分数[LVEF,(65.18±5.863)%vs(47.37±4.201)%,P<0.01]及左室短轴缩短率[LVFS,(36.19±3.299)%vs(22.80 ±0.8881)%,P<0.01],下调心肌组织超氧化物[(2.881±0.1908)RLU/(mg·s)vs(3.955±0.3022)RLU/(mg·s),P<0.01]、丙二醛(MDA)生成[(269.1±11.24)pmol/mg vs(412.7±24.39)pmol/mg,P<0.01]及gp91phox的表达[(3.404±0.2440)vs(4.388± 0.1463),P<0.01],上调超氧化物歧化酶(SOD)[(35.83±2.959)U/mg vs(21.11±2.004)U/mg,P<0.01]、SIRT1[(0.8033±0.05357)vs(0.3313±0.04337)],P<0.01],下调Ac-Foxo1水平[(0.2393±0.01440)vs(0.3536±0.01384),P<0.01];而Luz阻断MR后逆转Mel的上述作用(均P<0.01)。结论 Mel通过MR激活SIRT1信号通路,显著减轻大鼠MI/R氧化应激损伤,发挥抗氧化应激抗凋亡心肌保护作用。
褪黑素;褪黑素受体;心肌缺血再灌注损伤;沉默信息转录调控因子1;心肌保护
心肌缺血/再灌注(myocardial ischemia/reperfusion,MI/R)损伤是指缺血期处于可逆损伤的心肌细胞,恢复血液供应后转化为不可逆损伤。这种损伤是由多种触发物、媒介物和效应器参与的复杂生物反应过程,导致炎症反应、内皮细胞损伤、血流障碍、心功能异常、心肌细胞坏死和凋亡[1]。近年来研究发现,沉默信息转录调控因子1(SIRT1)是保护心脏最基本的内源性抗凋亡相关转录因子之一,激活SIRT1具有明确的抗 MI/R损伤作用[2]。褪黑素(melatonin,Mel)是松果体分泌的一种吲哚类激素,化学成分是N-乙酰-5-甲氧基色胺。笔者前期研究发现Mel可激活SIRT1信号通路减轻线粒体氧化应激损伤,保护缺血心肌[3]。有文献报道褪黑素膜受体(melatonin membrane receptor,MR)被激活后,对缺氧/复氧损伤后的H9C2细胞具有保护作用[4]。但是MR是否介导Mel激活SIRT1信号通路减轻MI/R损伤尚未见报道。为此本研究采用大鼠MI/R模型,研究褪黑素对心肌缺血再灌注(MI/R)损伤的保护作用及其机制,探讨MR对MI/R损伤的影响。
1 材料和方法
1.1 材料 实验动物为清洁级雄性SD大鼠80只,体重200~250 g,由第四军医大学动物实验中心提供。30 g/L戊巴比妥钠,褪黑素(Mel,Sigma公司),褪黑素受体阻断剂(Luz,Santa Cruz公司),原位缺口末端标记法(TUNEL)检测试剂盒(Roche公司),氯化三苯氮四唑(TTC)检测试剂(Sigma公司),SIRT1、Ac-Foxo1、gp91phox、Caspase-3、Mel-1a-R、Mel-1b-R抗体(Santa Cruz公司)。
1.2 方法
1.2.1 动物的分组 80只成年雄性SD大鼠随机分为4组(每组20只):①MI/R+溶剂对照组(MI/R+V组):MI/R手术前,腹腔注射含0.1 mol/L的乙醇的生理盐水7 d(1 m l/d),再灌注前15 min注射一次;②MI/R+Mel治疗组(MI/R+Mel组):MI/R手术前腹腔注射Mel 7 d,10 mg/(kg·d),再灌注前15 min再注射1次,15 mg/(kg·d);③MI/R+Mel+Luz组(MI/R+Mel+Luz组):Luzindole(Luz),Mel给药同前,MI/R手术前腹腔注射Luz 7 d,1 mg/(kg· d),再灌注前20 min注射一次,2 mg/kg;④假手术组(Sham组)不结扎冠脉,作为对照。按文献[5-6]方法于胸骨左缘2~4肋间打开胸腔及心包膜,暴露心脏;在肺动脉圆锥右缘、平左心耳下缘1~2 cm处,经左冠状动脉下浅层心肌穿一5-0号丝线,连同一直径2 mm聚氯乙烯管结扎冠状动脉左前降支,造成心肌缺血,Sham组仅穿线而不结扎动脉。
1.2.2 心功能检测 MI/R手术后72 h,利用Vevo2100小动物超声仪(VisualSonics,Toronto,Canada)检测并计算左室射血分数(LVEF)、左室短轴缩短率(LVFS)等心功能的变化,测量5个心动周期,取平均值作为最后检测数据。
1.2.3 心肌梗死(MI)范围的测定 再灌注结束后,再次结扎冠脉,向左心室腔注入20 g/L伊文氏蓝(1~2 ml)。迅速取出心脏,冻存于-20℃。用心脏切片器垂直于心脏长轴将其切成1 mm厚的薄片,分片置于2ml10 g/L TTC(pH 7.4)的12孔培养皿中,于37℃孵育15 min。用数码相机拍照并输入计算机。采用单盲法分别将伊文氏蓝染色区(非缺血区)、TTC染色区(红染,缺血区但组织仍存活)及非TTC染色区(MI区),用Sigma Scan面积测算,Image J图像分析软件进行计算处理。MI的范围以每一心脏总梗死面积(INF)占总缺血区面积(AAR)的百分比表示(INF/AAR×100%)。
1.2.4 心肌细胞凋亡的TUNEL法检测 按TUNEL原位细胞凋亡检测试剂盒的说明书操作。MI/R 6 h后,立即取出心脏,以预冷的PBS冲洗干净,取心尖部约2~5mm组织。将取下组织切心脏冠状面最大横径,置于40 g/L甲醇溶液中固定24 h后进行石蜡包埋切片。每张切片在凋亡区随机选取5个以上高倍视野,计数每个高倍视野内凋亡细胞核数,总细胞核数,计算心肌细胞凋亡率(apoptotic rate)。
1.2.5 氧化应激损伤相关分子表达的检测 心肌中超氧化物含量的检测采用光泽精增强发光测定法,超氧化物产物以相对光单位(RLU)/(mg·s)表示。Western blot法检测gp91phox蛋白表达。超氧化物歧化酶(SOD)、丙二醛(MDA)采用南京建成生物工程研究所提供的试剂盒,并按其实验设计流程进行检测。
1.2.6 SIRT1相关分子及MR表达的检测 再灌注结束后,迅速取出心脏,用预冷的生理盐水冲洗后,剪取缺血区心肌标本,液氮中速冻,置-80℃冰箱中保存待测。取缺血区心肌标本,匀浆、离心后,取上清液分装保存备用。BCA法测定蛋白浓度并进行蛋白定量,经聚丙烯酰胺变性凝胶电泳分离蛋白,用湿转法将蛋白转移到聚氟乙烯膜,50 mol/L脱脂牛奶封闭,分别加羊抗SIRT1、羊抗Ac-Foxo1、兔抗Caspase-3抗体,稀释比均为1:500,4℃过夜,TBST洗脱3次,分别加1:5 000辣根过氧化物酶标记的兔抗羊IgG抗体、羊抗兔IgG抗体,室温孵育1 h,TBST洗脱3次,使用ECL-plus试剂盒发光,通过生化检测系统成像并分析结果,以β-actin作为内参照,检测SIRT1、Ac-Foxo1、Caspase-3、Mel-1a-R、Mel-1b-R的表达情况。
1.3 统计学处理 实验结果数据均以均数±标准差(Mean±SD)表示,采用Prism 5.0软件进行统计学分析,组间数据比较采用方差分析(ANOVA),若总体差异显著,再以t检验分析相应两组间的显著性差别。以P<0.05为差异显著的界限。
2 结 果
2.1 各组心功能的比较 大鼠心肌缺血再灌注72 h后超声心动图显示,与MI/R+V组相比,MI/R+Mel组LVEF与LVFS显著提高,而MI/R+Mel+Luz组则较MI/R+Mel组显著下降(均P<0.01,图1)。
2.2 各组心肌细胞凋亡率及梗死面积的比较 大鼠MI/R 6 h留取心肌组织TUNEL凋亡检测显示,与MI/R+V组相比,MI/R+Mel组心肌细胞凋亡率显著下降,而使用Luz组则较MI/R+Mel组显著上升(均P<0.01,图2A);MI/R 6 h后取心脏进行Evans blue-TTC双染切片统计显示,与MI/R+V组相比,MI/R+Mel组梗死面积显著下降,而使用Luz组则较MI/R+Mel组显著上升(均P<0.01,图2B)。
2.3 各组 Superoxide generation、gp91phox、SOD、MDA的比较 大鼠MI/R 6 h留取心肌组织,检测结果显示,与MI/R+V组相比,MI/R+Mel组心肌细胞相关蛋白 Superoxide generation、Gp91phox、MDA显著下降,而使用Luz组则较MI/R+Mel组显著上升(均P<0.01,图3A、B、D);检测SOD水平显示,与MI/R+V组相比,MI/R+Mel组心肌细胞表达明显上调,使用Luz后其表达水平较MI/R+V组显著下降(均P<0.01,图3C)。
2.4 各组SIRT1、凋亡相关蛋白及MR表达的比较
大鼠MI/R 6 h后,留取心肌组织,Western blot检测结果显示,与 Sham组相比,MI/R+V组心肌SIRT1蛋白表达明显下调,Mel治疗后SIRT1表达较MI/R+V组显著上升,而使用Luz组可使SIRT1表达明显降低(均P<0.01,图4A);检测Ac-Foxo1、Caspase-3水平显示,缺血再灌注后 Ac-Foxo1、Caspase-3表达较Sham组明显上调,给予Mel治疗后其表达水平较MI/R+V组显著下降,而使用Luz组可使Ac-Foxo1、Caspase-3表达明显上升(均P<0.01,图4B、C);检测MR显示,MI/R后Mel-1a-R、Mel-1b-R水平明显下,且Mel治疗组较MI/R组和Luz组表达水平无明显差异(均P>0.05,图4D、E)。
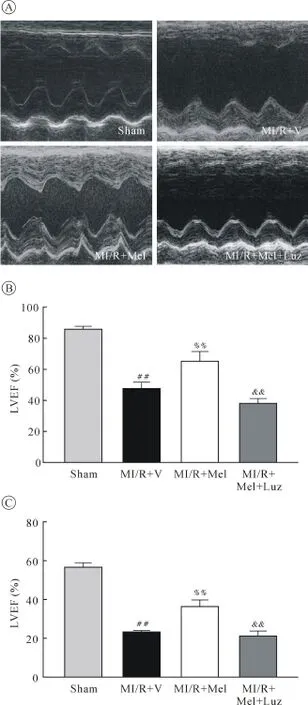
图1 各组心功能的比较

图2A
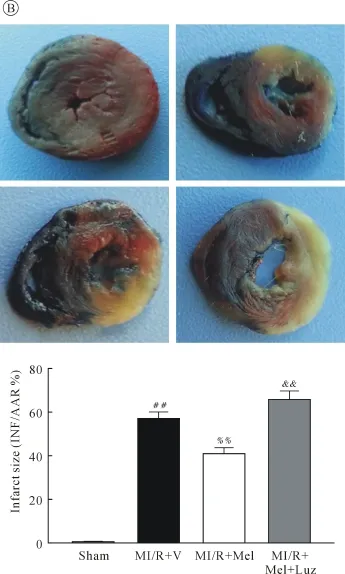
图2 各组心肌细胞凋亡率及梗死面积的比较
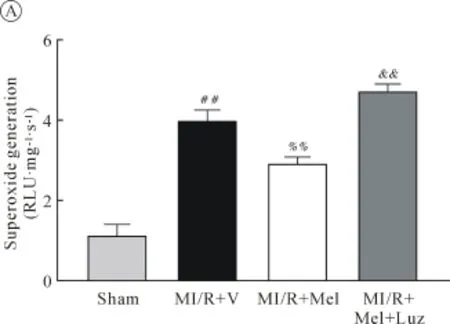
图3A
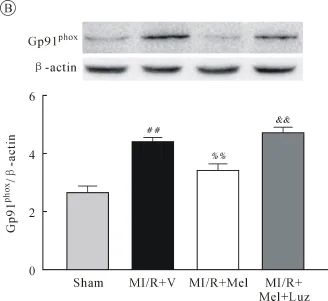
图3B

图3C

图3 各组Superoxide generation、gp91phox、SOD、MDA的比较
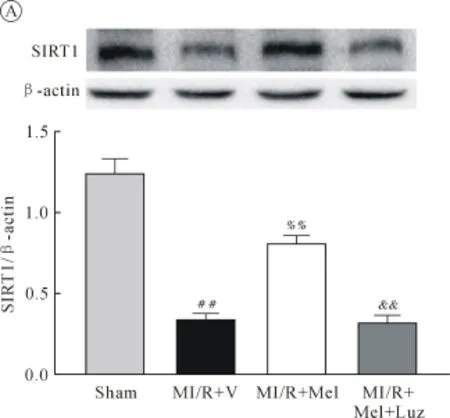
图4A

图4D
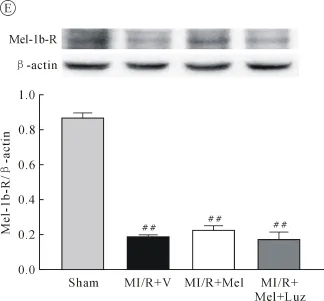
图4 各组SIRT1、凋亡相关蛋白及MR表达的比较
3 讨 论
MI/R损伤是指在阻断冠状动脉一定时间后缺血的心肌在开放循环再灌注期间出现的心脏功能、代谢及结构上的损伤。在恢复血流再灌注后,早期缺血心肌损伤加重,引起更多心肌细胞死亡,心肌梗死面积变大,进而进一步损害心功能[7-8]。本研究和前期研究发现,Mel对MI/R损伤和血管内皮细胞氧化应激损伤有明确的拮抗作用[3]。
迄今为止,褪黑素的膜受体(褪黑素受体a、b)和核受体(视黄酸相关孤儿受体 α)已被发现[9]。研究证实Mel可直接发挥清除自由基抗氧化作用,但其间接抗氧化作用很可能是由膜受体介导的[10-11]。此外,有证据显示Mel膜受体参与心脏保护作用:膜受体抑制剂Luz显著抑制Mel对MI/R损伤的保护作用[12],而Mel抗环孢素A诱导的心脏毒性也被证明是由膜受体介导的[13]。近年来研究发现SIRT1是目前心脏保护方面最基本的内源性抗凋亡相关转录因子之一[2]。SIRT1是存在于哺乳动物的酵母沉默信息调节因子Sir2(silence information regulator)的同源物,是一种具有烟酰胺腺嘌呤二核苷酸(NAD)+依赖的组蛋白去乙酰化酶(HDACs)活性的多功能转录调节因子,以组织特异性方式调节细胞的增殖、凋亡、分化、衰老和代谢[14]。笔者的前期研究发现,Mel可发挥抗凋亡作用减轻MI/R损伤并改善心功能,其具体机制可能与其激活SIRT1信号通路并降低Ac-Foxo1水平有关[3],而Mel膜受体是否参与此过程尚无报道。
本实验发现:MI/R损伤后MR表达下降,同时伴有SIRT1表达下降及Ac-Foxo1水平上升,可能是MI/R损伤的重要机制之一。而使用Mel治疗后明显上调SIRT1的表达并降低Ac-Foxo1水平,发挥抗凋亡并改善心脏功能的作用。外源加入Mel膜受体特异性阻断剂Luz可显著下调SIRT1表达,抑制Mel抗氧化应激减轻MI/R损伤的作用。以上结果表明:MI/R损伤下调心肌Mel膜受体表达,下调Mel下游保护性信号通路,而外源性给予Mel可激动褪黑素膜受体,激活下游SIRT1信号,保护缺血心肌。
总之,本研究证实:MI/R后MR表达水平降低,Mel下游信号受损可能是MI/R损伤加重的重要因素,而Mel治疗可在不改变MR表达水平情况下激活下游保护性信号通路,发挥抗氧化应激、抗凋亡作用,显著减轻MI/R损伤。本研究揭示了Mel及其受体参与缺血心肌保护新机制,为MI/R损伤治疗提供了新靶点,并为Mel相关内源性药物的开发和临床应用提供了实验依据。
[1] 赵志青,臧益民.再灌注心脏保护的新策略:后处理和预处理的比较(英文)[J].心脏杂志,2006,18(1):1-7.
[2] Kwon H S,Ott M.The ups and downs of SIRT1[J].Trends Biochem Sci,2008,33(11):517-525.
[3] 于立明,杨阳,刘丽君,等.褪黑素减轻心肌缺血/再灌注损伤的作用及机制[J].心脏杂志,2015,27(3):255-259.
[4] Yu J,Wei J,Ji L,etal.Exploration onmechanism ofa new type ofmelatonin receptor agonist Neu-p11 in hypoxia-reoxygenation injury of myocardial cells[J].Cell Biochem Biophys,2014,70(2):999-1003.[5] 陈雯,费广鹤.哮喘大鼠血清褪黑素及海马褪黑素受体1的变化[J].中国药理学通报,2014,30(8):1142-1146.
[6] Sengupta A,Molkentin JD,Yutzey KE.FoxO transcription factors promote autophagy in cardiomyocytes[J].J Biol Chem,2009,284(41):28319-28331.
[7] Zheng X,Lian D,Wong A,et al.Novel small interfering RNA-containing solution protecting donor organs in heart transplantation[J].Circulation,2009,120(12):1099-1107.
[8] Smith CC,Mocanu MM,Davidson SM,etal.Leptin,the obesity-associated hormone,exhibits direct cardioprotective effects[J].Br JPharmacol,2006,149(1):5-13.
[9] Dubocovich ML,Masana MI,Iacob S,et al.Melatonin receptor antagonists that differentiate between the human Mel1a and Mel1b recombinant subtypes are used to assess the pharmacological profile of the rabbit retina ML1 presynaptic heteroreceptor[J].Naunyn Schmiedebergs Arch Pharmacol,1997,355(3):365-375.
[10] Reiter RJ,Tan DX,Gitto E,etal.Pharmacologicalutility ofmelatonin in reducing oxidative cellular and molecular damage[J].Pol JPharmacol,2004,56(2):159-170.
[11] Karbownik M,Reiter RJ.Antioxidative effects of melatonin in protection against cellular damage caused by ionizing radiation[J].Proc Soc Exp Biol Med,2000,225(1):9-22.
[12] Lochner A,Genade S,Davids A,et al.Short-and long-term effects ofmelatonin on myocardial post-ischemic recovery[J].J Pineal Res,2006,40(1):56-63.
[13] Rezzani R,Rodella LF,Bonomini F,et al.Beneficial effects of melatonin in protecting against cyclosporine A-induced cardiotoxicity are receptormediated[J].JPineal Res,2006,41(3):288-295.
[14] Finkel T,Deng CX,Mostoslavsky R.Recent progress in the biology and physiology ofsirtuins[J].Nature,2009,460(7255):587-591.
The role ofmelatonin receptor in the protective effects ofmelatonin againstm yocardial ischem ia reperfusion injury in rats
Zhao Guo-long,Zhang Qiu-fang,Zhai Meng-en,Yu Li-ming,Gao Wen-li,Jin Zhen-xiao,Duan Wei-xun,Yu Shi-qiang,Wang Yun
Ningxia Medical University,Yinchuan,750004,Ningxia,China
Wang Yun,Email:wywarrenw@hotmail.com
Yu Shi-qiang,Email:shiqiangyu210@126.com
ObjectiveTo investigate the protective effectofmelatonin(Mel)onmyocardial ischemia/reperfusion(MI/R)injury and the influence ofmelatoninmembrane receptor(MR)on MI/R injury.MethodsEighty male Sprague-Dawley rats were subjected to myocardial ischem ia/reperfusion(M I/R,I 30 m in,R 6 h)operation and random ly divided into 4 groups:Sham,MI/R+V,MI/R+Mel and MI/R+Mel+Luz(Luzindole,the specific antagonist of MR).The cardiac function 72 h after reperfusion,oxidative stress damage related indicators,apoptotic index,infarct size,MR expression,SIRT1 expression,Ac-Foxo1 expression were detected.ResultsCompared with the MI/R+V group,melatonin treatment group showed improved left ventricular ejection fraction(LVEF)(65.18±5.863)vs(47.37±4.201),(P<0.01)and left ventricular fractional shortening(LVFS)(36.19±3.299)vs(22.80±0.8881),(P<0.01),decreased myocardium superoxide generation(2.881±0.1908)RLU/(mg·s)vs(3.955±0.3022)RLU/(mg·s),(P<0.01),malondialdehyde(MDA)level(269.1±11.24)pmol/mg vs(412.7±24.39)pmol/mg,(P<0.01)and gp91phox expression(3.404±0.2440)vs(4.388±0.1463),(P<0.01),up-regulated SIRT1 expression(0.8033±0.05357)vs(0.3313±0.04337),(P<0.01),down-regulated Ac-Foxolexpression(0.2393±0.01440)vs(0.3536±0.01384),(P<0.01).Moreover,Luz exposure significantly blockedmelatonin's cardioprotective effect(all P<0.01).ConclusionThe experimentshowed thatMel protected the heart against MI/R injury by reducing oxidative stress damage via activation of SIRT1 signaling in a MR dependentmanner.
Melatonin,Melatonin receptor,Myocardial ischemia/reperfusion injury,SIRT1,Cardioprotection
2015-04-07)
2015-04-13)
10.13498/j.cnki.chin.j.ecc.2015.02.12
国家自然科学基金(81470415);国家自然科学基金(81470411);陕西省科技统筹创新工程计划(2013KTCL03-01);
作者单位:750004银川,宁夏医科大学(赵国龙、高文丽、王 云);710004西安,第四医院影像科(张秋芳);710032西安,第四军医大学西京医院心脏外科(翟蒙恩、于立明、金振晓、段维勋、俞世强)
王 云,Email:wywarrenw@hotmail.com;俞世强,Email:shiqiangyu210@126.com

