自噬在肥胖所致心功能不全中的作用
李朝阳,杨丽芳
·综 述·
自噬在肥胖所致心功能不全中的作用
李朝阳,杨丽芳
心血管疾病;自噬;胰岛素抵抗;肥胖
2004年美国健康和营养协会调查发现肥胖在美国成年人中的发生率为32.2%,由于肥胖是胰岛素抵抗、2型糖尿病、高血压、脑卒中、癌症和其他一些人类疾病的主要危险因素之一,关于这些并发症的精确机制研究是很重要的。最近的研究表明,胰岛β细胞的自噬失调可能与肥胖人群的胰岛素抵抗有关,脂肪组织的自噬改变也参与其中[1]。值得关注的是,有学者认为肥胖直接影响了心肌组织自噬流的活动,诠释了肥胖与肥胖所致心血管疾病的紧密联系。当前的回顾性研究集中于探索自噬尤其是自噬流在胰岛β细胞、脂肪组织和心肌细胞的病理生理和功能,特别强调自噬在肥胖和肥胖相关心血管疾病(cardiovascular disease,CVD)发展中的作用。
1 肥胖和心血管疾病
肥胖,尤其是腹型肥胖,与心血管疾病发病率和死亡率风险的增加紧密相关。肥胖可以引起2型糖尿病、高血压和血脂异常,所有这些疾病都可以促进心血管疾病的发展。多种环境和遗传因素与肥胖的发生发展有关。一项成年男性双胞胎的研究发现这些人群体重的差异明显低于同龄其他人群,该研究证实了遗传对肥胖的影响。在另外一项高脂饮食的研究中发现,高脂饮食的人群和喂养高脂饲料的小鼠肌肉中线粒体氧化磷酸化和过氧物酶体增殖活化受体γ-1(PGC1)基因的改变促进了肥胖的发生和发展[2]。
脂肪组织中,炎症和脂肪细胞分化相关基因与肥胖的发生发展有关[2-4]。还有一些基因与肥胖的发展相关,包括固醇调节元件结合蛋白(sterol regulatory element-binding protein,SREBP)、硬脂酰辅酶A去饱和酶(stearoyl-coenzyme A desaturase,Scd1)和硫氧还原蛋白相互作用蛋白(又被称为VitD3上调基因1)[2-4]。此外,热量摄入与能量消耗之间的不平衡可以引起体脂的蓄积,最终引起肥胖[2-4]。
2 自噬
自噬维持着真核细胞内蛋白质合成与降解之间的平衡。参与调节蛋白降解和循环的通路主要有两条:①泛素-蛋白酶体途径;②自噬-溶酶体途径。自噬通过吞没细胞内成分形成自噬体并与溶酶体融合从而降解这些蛋白/细胞器,它是一种高度动态的过程,特点是自噬体的形成。自噬体可以结合溶酶体,形成一种结构叫自噬溶酶体或自溶酶体,在这个过程中,自噬体的外膜与溶酶体的外膜结合,自噬体的内膜和胞浆成分将最终被溶酶体水解酶降解(图1)。根据底物运输到溶酶体的方式和系统选择性,将自噬分为三种不同的形式:①分子伴侣调节自噬;②微自噬;③巨自噬。本文主要讨论的是巨自噬。
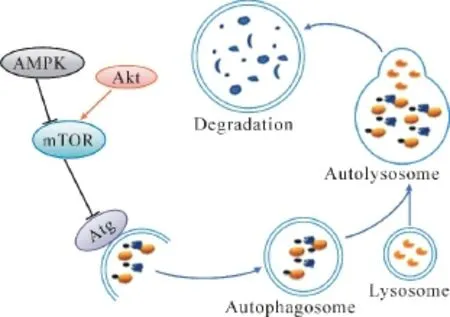
图1 自噬的动态过程及部分调节机制
自噬通路可以被不同的上游调节物质调节,包括自噬调节基因Atg家族和哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)激酶。自噬调节蛋白家族首次在酵母体内发现,其中许多成分在真核细胞中有同源基因。目前发现有30多种自噬调节基因在自噬中发挥着重要调节作用,这些基因编码的蛋白调节自噬空泡的形成、隔离双层膜的形成、自噬体的成熟以及与溶酶体结合形成自溶酶体等过程。另一个调节自噬的关键蛋白是mTOR,它是在多种刺激应答中降低自噬的主要分子(图 1)。PI3-K/Akt信号通路是一个重要的mTOR上游激活途径,在对胰岛素样生长因子和其他一些生长因子作出应答时抑制自噬。与Akt相反,AMP活化的蛋白激酶(AMP-activated protein kinase,AMPK)抑制mTOR的磷酸化从而激活自噬。生理状态下,自噬主要通过降解缺陷蛋白和细胞器起到“管家”的作用,避免异常蛋白质的聚集,提供氨基酸来维持细胞ATP水平和合成代谢通路。虽然一些功能与泛素-蛋白酶体系统相似,自噬通路的独特之处在于它降解完整的细胞器,包括线粒体、内质网和过氧物酶体。
自噬的增加并非都是细胞保护,在某些情况下可能是有害的,例如一些压力超负荷引起的心衰。Beclin-1基因的杂合中断是防止病理性结构改变的心肌保护机制,但是Beclin-1过表达却导致病理性重构的恶化。此外,再灌注阶段抑制自噬减少了心肌梗死的范围、抑制了Beclin-1+/-小鼠心肌细胞凋亡。
3 自噬与肥胖
3.1 胰岛β细胞中的自噬 Ebato的研究证明β细胞Atg7的特异性敲除引起了泛素化蛋白、肿胀线粒体、肿胀内质网的累积以及β细胞质量和胰岛素颗粒数的减少[5]。在细胞水平,自噬的缺陷导致了β细胞凋亡增加和增殖下调,功能分析发现自噬缺陷降低了基础血糖和高糖刺激的胰岛素分泌功能。在Atg7敲除的β细胞内Ca2+的聚集也是被干扰的,结果发现自噬缺陷小鼠出现了低胰岛素酶和高溶酶体酶,表明基础自噬在胰岛β细胞中起保护作用[5]。
有研究发现高脂饮食可以引发胰岛β细胞自噬上调,增加了受损蛋白和细胞器的降解,减少了细胞死亡和糖尿病的发生[5]。2型糖尿病小鼠模型与非糖尿病小鼠相比自噬体的形成显著增加,结果表明糖尿病小鼠模型引起的自噬上调是胰岛β细胞在对肥胖作出应答时维持自身结构与功能的保护性反应[6]。
3.2 脂肪组织的自噬 肥胖是白色脂肪组织大量堆积的结果,自噬在脂肪形成过程中发挥着重要作用。在脂肪组织形成过程中,最初的白色脂肪细胞由成纤维细胞样前体脂肪细胞分化而来,自噬参与了细胞成分的降解[7]。在离体脂肪形成模型中,抑制自噬有效地阻断了3T3-L1前体脂肪细胞向成熟脂肪细胞的分化。在体Atg7敲除的白色脂肪组织自噬下调不仅抑制了脂肪组织的增殖和分化,而且促进了白色脂肪组织向棕色脂肪组织的分化转移。最近,人们发现线粒体自噬可能在白色脂肪组织分化以及饮食引起的肥胖中发挥着重要作用。
肥胖中自噬的上调不仅发生在胰岛β细胞中,同时发生于脂肪组织,尤其是肥胖人群的网膜脂肪组织[8]。自噬上调的程度与肥胖和脂肪细胞肥大的程度相关,在动物模型中,上调自噬对肥胖的发展极为不利,Atg7特异性敲除的小鼠抵抗高脂饮食引起的肥胖,显著改善胰岛素的敏感性[9]。在体和离体研究表明脂肪组织的形成过程中自噬显著上调,当Atg5基因敲除时,脂肪组织形成降低[10]
3.3 心肌自噬 肥胖可以导致胰岛素抵抗、心肌肥厚、心功能损害并最终导致心肌死亡,有研究表明心肌自噬是由肥胖引起的,在肥胖相关的2型糖尿病(RCS10)小鼠模型中,左心室质量明显增加,但短轴缩短率、左室收缩末期和舒张末期直径相对没有变化。在15周大的 RCS10小鼠,自噬显著激活,LC3BII、Beclin-1和Atg5–12的表达上调,这些发现与自噬在肥胖和糖尿病患者心脏中激活的说法是一致的。在自噬流的进一步研究中发现,心肌自噬在2型糖尿病小鼠模型中被激活[11]。
在营养充足或者肥胖的情况下,Akt信号通路是典型激活的,Akt磷酸化并激活下游mTOR激酶,该酶是主要的自噬抑制调节剂,同时也是核内转录因子FoxO家族的成员。最近的一项对果蝇的研究发现,mTOR通路参与调节高脂饮食引起的肥胖和心功能不全,抑制该通路保护了心脏避免高脂饮食引起的心功能不全[12]。尽管在这项研究中没有发现自噬激活,考虑到mTOR是该自噬通路主要的抑制调节剂,由此可以合理地推测,在经过高脂饮食喂养之后心肌自噬可能被抑制。最近一项研究报道心肌自噬在1型糖尿病小鼠模型中是抑制的,在这些1型糖尿病小鼠的心脏中,发现了LC3BII下调,证明自噬活动降低[13-14]。甲福明二甲双胍引起AMPK慢性激活预防小鼠糖尿病性心肌病可能与自噬的提高有关。
4 结 论
基于最近关于自噬在胰岛β细胞的生理和病理发现,笔者可以合理地猜测基础自噬活动和肥胖引起的自噬可能是维持这些细胞形态与功能的保护性活动。尽管没有直接证据证明自噬在肥胖患者心肌中的代偿性改变是否是保护性的,但是肥胖很可能抑制自噬流,这一点对心脏是有害的。此外,mTOR在调控自噬中的作用需要进一步探索。
参考文献:
[1] Goldman SJ,Zhang Y,Jin S.Autophagic degradation of mitochondria in white adipose tissue differentiation[J].Antioxid Redox Signal,2011,14(10):1971-1978.
[2] Keller MP,Attie AD.Physiological insights gained fromgene expression analysis in obesity and diabetes[J].Annu Rev Nutr,2010,30:341-364.
[3] Li Y,Xu S,Mihaylova MM,etal.AMPK phosphorylatesand inhibits SREBP activity to attenuate hepatic steatosis and atherosclerosis in dietinduced insulin-resistant mice[J].Cell Metab,2011,13(4):376-388.
[4] Thorn K,Hovsepyan M,Bergsten P.Reduced levels of SCD1 accentuate palmitate-induced stress in insulin-producing beta-cells[J].Lipids Health Dis,2010,9:108-115.
[5] Ebato C,Uchida T,ArakawaM,etal.Autophagy is important in islet homeostasis and compensatory increase of beta cellmass in response to high-fat diet[J].Cell Metab,2008,8(4):325-332.
[6] Hur KY,Jung HS,Lee MS.Role of autophagy in beta-cell function andmass[J].Diabetes Obes Metab,2010,12(Suppl.2):20-26.
[7] Goldman S,Zhang Y,Jin S.Autophagy and adipogenesis.Implications in obesity and type II diabetes[J].Autophagy,2010,6(1):179-181.
[8] Baerga R,Zhang Y,Chen PH,et al.Targeted deletion of autophagy-related 5(atg5)impairs adipogenesis in a cellularmodel and in mice[J].Autophagy,2009,5(8):1118-1130.
[9] Ezaki J,Matsumoto N,Takeda-Ezaki M,et al.Liver autophagy contributes to the maintenance of blood glucose and amino acid levels[J].Autophagy,2011,7(7):727-736.
[10] LasG,ShirihaiOS.The role of autophagy in beta-cell lipotoxicity and Type 2 diabetes[J].DiabetesObesMetab,2010,12(Suppl.2):15-19.
[11] Mellor KM,Bell JR,Young MJ,etal.Myocardial autophagy activation and suppressed survival signaling is associated with insulin resistance in fructose-fed mice[J].J Mol Cell Cardiol,2011,50(6):1035-1044.
[12] Birse RT,Choi J,Reardon K,et al.High-fat-diet-induced obesity and heart dysfunction are regulated by themTOR pathway in Drosophila[J].Cell Metab,2010,12(5):533-544.
[13] Shende P,Plaisance I,MorandiC,etal.Cardiac raptor ablation impairs adaptive hypertrophy,alters metabolic gene expression,and causes heartfailure in mice[J].Circulation,2011,123(10):1073-1082.
[14] Zhang D,Contu R,Latronico MV,et al.AmTORC1 regulates cardiac function and myocyte survival through 4E-BP1 inhibition in mice[J].JClin Invest,2010,120(8):2805-2816.
2015-04-07)
2015-04-13)
10.13498/j.cnki.chin.j.ecc.2015.02.15
陕西省国际合作基金(2015KW-046)
710032西安,第四军医大学学员一旅三营九连(李朝阳);第四军医大学西京医院麻醉科(杨丽芳)
杨丽芳,Email:yanglf@fmmu.edu.cn

