硫化氢通过P物质介导促进小鼠肺组织的神经源性炎性反应
赵倩 王长谦 乔建瓯 张绘莉
(上海交通大学医学院附属第九人民医院 a心内科,b呼吸内科,上海 200011)
·论著·
硫化氢通过P物质介导促进小鼠肺组织的神经源性炎性反应
赵倩a王长谦a乔建瓯b张绘莉a
(上海交通大学医学院附属第九人民医院a心内科,b呼吸内科,上海200011)
摘要目的:探讨硫化氢对小鼠肺组织神经源性炎性反应的影响及其作用机制。方法: 饲养8周龄的雄性Balb/c小鼠,分别予以CP-96345(2.5 mg/kg,腹腔注射)、辣椒素(50 mg/kg,皮下注射)或capsazepine(15 mg/kg,皮下注射)预处理,然后随机腹腔注射0.9%氯化钠溶液或硫氢化钠(NaHS;10 mg/kg),即分为对照组、NaHS组、CP-96345+NaHS组、辣椒素+NaHS组和capsazepine+NaHS组。用药1 h后处死小鼠,采用酶联免疫吸附试验(ELISA)法检测血浆P物质以及肺组织匀浆中肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)和白细胞介素-1β(interleukine-1 beta,IL-1β)水平,并用四甲基联苯胺反应液测定肺组织匀浆中髓过氧化物酶(myeloperoxidase,MPO)活性,通过HE染色法观察肺组织的病理学变化。另选8周龄、雄性、前速激肽原A(pre-pro-totchykinin A,PPT-A)基因敲除小鼠(PPT-A-/-)和相同遗传背景的同龄、野生型Balb/c小鼠(PPT-A+/+),分别随机腹腔注射0.9%氯化钠液或NaHS(2.5 mg/kg),1 h后处死小鼠,检测肺组织匀浆中MPO活性、TNF-α和IL-1β水平,并观察肺组织的病理学变化。结果:NaHS可显著升高小鼠血浆P物质浓度(P<0.05),提高肺组织匀浆中的MPO活性以及TNF-α和IL-1β水平(均P<0.05),导致肺组织炎性损伤。敲除小鼠编码P物质的PPT-A基因或者予以CP-96345、辣椒素或capsazepine预处理阻断P物质信号通路后,NaHS不能显著升高肺组织中MPO活性以及TNF-α和 IL-1β水平,与单纯NaHS处理组相比差异有统计学意义(均P<0.05);而且NaHS所致的肺组织损伤也明显减轻。结论:硫化氢可能通过刺激神经末梢纤维释放P物质,促进肺组织发生神经源性炎性反应,最终导致肺组织损伤。
关键词硫化氢;炎性反应;P物质;肺损伤
当气道或肺组织受到刺激时,感觉神经末梢会释放P物质和降钙素基因相关肽(calcitonin gene related peptide,CGRP)等神经肽,作用于多种效应细胞,如气道平滑肌细胞、胆碱能神经节、炎性细胞和黏液腺等,导致血管通透性增高、气道平滑肌收缩和组织水肿等,引起神经源性炎性反应,造成组织或器官损伤[1-2]。硫化氢是人体内发现的第3个气体介质,与肺损伤的发生和发展密切相关[3-6]。然而,硫化氢诱导的肺损伤是否与神经源性炎性反应有关,目前尚不明确。本研究应用硫氢化钠(NaHS)作为外源性硫化氢供体诱导肺损伤,观察小鼠肺组织中神经源性炎性反应介质—P物质及其相关通路的变化情况,以明确硫化氢诱导肺损伤与神经源性炎性反应的关系。
1资料与方法
1.1材料NaHS、P物质信号通路相关拮抗剂(CP-96345、辣椒素、capsazepine)以及检测髓过氧化物酶(myeloperoxidase,MPO)活性的四甲基联苯胺反应液(tetramethyl benzidine,TMB)均购自美国Sigma公司;Cartrige C18色谱柱购自美国Bachem公司;检测P物质的酶联免疫吸附试验(ELISA)试剂盒购自美国半岛实验室(Peninsula Laboratories);检测肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)和白细胞介素-1β(interleukine-1 beta,IL-1β)的ELISA试剂盒购自美国R&D公司。
1.2动物8周龄、雄性Balb/c小鼠共110只,体质量为20~24 g,购于中国科学院上海实验动物中心,并在SPF级环境下饲养。8周龄、体质量为20~25 g、前速激肽原A(pre-pro-totchykinin A,PPT-A)基因敲除的雄性Balb/c小鼠(PPT-A-/-)共16只,由美国加州大学旧金山分校Basbaum教授惠赠,并在SPF级环境下饲养。
1.3给药及分组将110只8周龄、雄性Balb/c小鼠随机分为对照组、NaHS组、CP-96345+NaHS组、辣椒素+NaHS组和capsazepine+NaHS组。对照组和NaHS组小鼠腹腔分别注射 0.9%氯化钠液0.1 mL或NaHS(10 mg/kg),并于1 h后腹腔注射致死剂量(90 mg/kg)的苯巴比妥处死小鼠,每组10只小鼠;CP-96345+NaHS组小鼠腹腔注射CP-96345(2.5 mg/kg),30 min后腹腔注射NaHS(10 mg/kg),1 h后腹腔注射致死剂量的苯巴比妥处死小鼠,同时设未处理组和单纯NaHS干预组作为对照,每组10只小鼠;辣椒素+NaHS组小鼠连续每天皮下注射辣椒素(50 mg/kg),6 d后腹腔注射NaHS(10 mg/kg),1 h后腹腔注射致死剂量的苯巴比妥处死小鼠,同时设未处理组和单纯NaHS干预组作为对照,每组10只小鼠;capsazepine+NaHS组小鼠皮下注射capsazepine(15 mg/kg),30 min后腹腔注射NaHS 10 mg/kg,1 h后腹腔注射致死剂量的苯巴比妥处死小鼠,同时设未处理组和单纯NaHS干预组作为对照,每组10只小鼠。处死小鼠时留取血液标本,注入4 ℃抗凝管中,摇匀,于4 ℃以10 000 r/min速度离心10 min,分离血浆,保存于-80 ℃待测。同时,分离双侧肺组织,在液氮中速冻后,保存于-80 ℃待测。
8周龄、雄性PPT-A-/-小鼠和相同遗传背景的同龄、野生型小鼠(PPT-A+/+)随机分为PPT-A-/-+0.9%氯化钠液组、PPT-A-/-+NaHS组、PPT-A+/++0.9%氯化钠液组和PPT-A+/++NaHS组,前两组每组8只,后两组每组10只。PPT-A-/-和PPT-A+/+小鼠按分组情况腹腔注射0.9%氯化钠液(0.1 mL)或NaHS(10 mg/kg),1 h后腹腔注射致死剂量的苯巴比妥处死小鼠,然后分离血浆和双侧肺组织,保存于-80 ℃待测。
1.4ELISA法检测血浆P物质浓度和肺组织匀浆中TNF-α、IL-1β 水平取小鼠血浆600 μL,通过Cartrige C18色谱柱吸附分离P物质,再以1.5 mL的75%乙腈溶液洗脱吸附的P物质,将洗脱物冻干后重新溶解于P物质Assay Buffer中。根据P物质ELISA检测试剂盒说明书步骤测定血浆P物质浓度。血浆P物质的质量浓度单位为ng/mL。
取小鼠肺组织匀浆100 μL,按照ELISA试剂盒说明书步骤测定TNF-α和IL-1β水平。ELISA测定值除以肺组织匀浆DNA浓度即为肺组织匀浆中的TNF-α和IL-1β水平,单位为pg/μg DNA。
1.5TMB法测定肺组织匀浆MPO活性肺组织匀浆中MPO活性可用于评估肺组织中性粒细胞的浸润情况。取小鼠肺组织50 mg,置于匀浆器中,加入1 mL磷酸钠缓冲液(20 mmol/L,pH7.4),冰浴匀浆后离心(13 000×g,10 min,4 ℃)。弃上清液,加入含0.5%十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,HTAB)的磷酸钠缓冲液(50 mmol/L,pH6.0)1 mL,混匀后反复冻融4次,并超声粉碎2 min后离心(13 000×g,5 min,4 ℃)。取上清液50 μL,加入TMB反应液50 μL,混合物于37 ℃反应110 s后,加入0.18 mol/L的H2SO450 μL以终止反应,随后立即在分光光度计405 nm波长下检测反应物的吸光度。吸光度值除以肺组织匀浆中DNA浓度即为肺组织匀浆中的MPO活性。
1.6苏木精-伊红染色(hematoxylin-eosin staining)法观察肺组织的病理学变化处死各组小鼠后,开胸取出肺脏,寻找气管分叉,从右肺下叶取一块肺组织,迅速放人10%中性甲醛溶液中固定24 h,然后进行石蜡包埋和HE染色,观察肺组织损伤程度。

2结果
2.1NaHS对血浆P物质浓度和肺组织炎性反应的影响如表1和图1所示,与对照组相比较,NaHS(10 mg/kg,腹腔注射)可显著提高小鼠血浆P物质浓度、肺组织匀浆中的MPO活性以及肺组织匀浆中的TNF-α 和IL-1β水平(均P<0.05),加重肺组织的炎性反应和肺损伤。光学显微镜下可见对照组小鼠的肺泡结构清晰完整;而NaHS组小鼠肺组织充血水肿,有大量炎性细胞浸润,肺泡间隔明显增宽、增厚,肺泡腔变窄甚至消失。
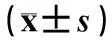

组别n血浆P物质/(ng/mL)肺MPO活性肺TNF-α/(pg/μgDNA)肺IL-1β/(pg/μgDNA)对照组100.0564±0.00871.00±0.162589.73±446.212428.99±362.12NaHS组100.0778±0.0111*1.48±0.33*3192.11±506.93*3210.72±482.20**
注:与对照组相比,*P<0.05,**P<0.01.

图1 光学显微镜下观察NaHS干预对肺组织结构的影响(HE染色,×400)
2.2CP-96345、辣椒素或capsazepine预处理对NaHS诱导的小鼠肺组织炎性反应和肺损伤的影响为明确硫化氢是否通过促进P物质的释放而引起肺损伤,本研究应用相关拮抗剂阻断P物质信号通路后观察NaHS对肺组织炎性反应和肺损伤的影响。部分小鼠分别予以神经激肽1(neurokinin 1,NK1)受体拮抗剂CP-96345预处理,阻断小鼠P物质与NK1受体的结合;或予以辣椒素预处理,耗竭小鼠神经末梢P物质;或予以瞬时受体电位通道香草醛亚型1(transient receptor potential vanilloid type 1,TRPV1)受体选择性阻断剂capsazepine预处理,抑制神经末梢释放P物质。然后,予以NaHS干预,再检测肺组织中的细胞因子水平和肺损伤情况。结果如表2所示,CP-96345、辣椒素或capsaze-pine预处理并进行NaHS干预后,肺组织匀浆中MPO活性、TNF-α和IL-1β水平较单纯NaHS干预组均显著降低,差异有统计学意义(均P<0.05)。另一方面,如图2所示,CP-96345、辣椒素或capsazepine预处理可显著减轻NaHS引起的肺损伤,减少肺组织炎性细胞浸润。
2.3NaHS对PPT-A-/-小鼠肺组织炎性反应和肺损伤的影响本研究进一步应用PPT-A-/-小鼠观察了NaHS对肺组织炎性反应和肺损伤情况的影响。敲除编码小鼠P物质的PPT-A基因后,小鼠血浆P物质浓度极低。腹腔注射10 mg/kg NaHS 1 h后,PPT-A-/-小鼠的肺MPO活性、肺TNF-α 和IL-1β水平均无明显升高,且明显低于野生型PPT-A+/+小鼠经NaHS处理后的相应水平(P<0.05);显微镜下观察发现,PPT-A+/++NaHS组小鼠肺组织的炎性反应和肺损伤情况亦不明显。见表3、图3。

表2 CP-96345、辣椒素或capsazepine预处理对NaHS诱导肺组织炎性反应的影响
注:△与单纯NaHS干预组相比,P<0.05;*与未处理组相比,P<0.05

图2 光学显微镜下观察CP-96345、辣椒素或capsazepine预处理对NaHS诱导的肺损伤的影响(HE染色,×400)

组别n肺MPO活性肺TNF-α/(pg/μgDNA)肺IL-1β/(pg/μgDNA)PPT-A+/++0.9%氯化钠液组101.00±0.265049.01±1186.713289.61±932.11PPT-A+/++NaHS组101.31±0.34*6755.39±990.50*5179.49±714.41*PPT-A-/-+0.9%氯化钠液组81.00±0.334157.73±798.012755.09±785.60PPT-A-/-+NaHS组81.02±0.22△3944.98±798.59△3091.38±422.78△
注:*与PPT-A+/++0.9%氯化钠液组相比,P<0.05;△与PPT-A+/++NaHS组相比,P<0.05

图3 光学显微镜下观察NaHS干预对PPT-A-/-小鼠肺组织结构的影响(HE染色,×400)
3讨论
气道非肾上腺素能非胆碱能(nonadrenergic noncholinergic,NANC)神经分布在各层气道管壁,受到辣椒素、酸、烟雾和空气污染物等刺激后迅速释放速激肽类炎性介质,趋化炎性细胞浸润并使其释放炎性介质,引起神经源性炎性反应,导致气道痉挛、血浆渗漏和黏膜水肿等[1],从而引起气道和肺组织损伤。P物质是NANC神经纤维末梢释放的一种主要的速激肽类神经源性炎性介质,与急性胰腺炎和败血症等所致的急性肺损伤密切相关[7-8]。有研究[4-6]显示,新型气体介质硫化氢在急性胰腺炎、烧伤和败血症等相关的肺损伤中起着重要作用。因此,本研究从神经源性炎性反应的角度,探讨了硫化氢对神经源性炎性介质P物质的影响及其与肺损伤的关系。此外,本研究分别应用药物CP-96345、辣椒素和capsazepine阻断P物质信号通路以及应用PPTA-/-小鼠,观察硫化氢能否继续诱发肺组织炎性反应,从而进一步明确硫化氢与P物质释放的关系。
本研究发现,小鼠腹腔注射外源性硫化氢供体NaHS后血浆P物质浓度明显升高,同时,肺组织的中性粒细胞浸润程度(以肺组织MPO活性反映)和肺组织细胞因子水平(以TNF-α和IL-1β水平反映)也显著升高,肺组织出现充血水肿、炎性细胞浸润和结构损伤。这一结果提示,NaHS可以刺激气道NANC神经纤维末梢释放P物质,促进中性粒细胞浸润,收缩气道平滑肌,增加肺血管通透性,最终导致肺损伤。另一方面,本研究通过3种方法预处理阻断P物质作用通路:(1)腹腔注射CP-96345以阻断P物质的主要作用受体NK1受体;(2)连续皮下注射辣椒素以耗竭神经末梢P物质;(3)皮下注射capsazepine以选择性拮抗TRPV1,阻断神经末梢P物质的释放。这些预处理均可以显著抑制硫化氢对肺组织的促炎性反应作用和致损伤作用。此外,本研究还观察了PPT-A-/-小鼠对NaHS的反应性,结果显示,NaHS并不能在PPT-A-/-小鼠肺组织中引起明显的炎性反应和肺损伤,即敲除小鼠编码P物质的基因后,硫化氢并不能够引起肺炎性反应,也不能导致肺损伤。这些实验结果进一步明确了硫化氢诱导肺损伤的机制与促进气道神经末梢释放P物质紧密相关。
关于硫化氢与P物质等速激肽类神经源性炎性介质之间的关系,其他学者也有相关研究报道。例如,Trevisani等[9]应用不同浓度的NaHS处理豚鼠离体气道后,发现气道P物质的释放明显增加,并且NaHS刺激气道产生了剂量依赖性的收缩反应;然而,用辣椒素耗竭神经纤维中的P物质、阻断辣椒素特异性TRPV-1受体或阻断速激肽特异性受体NK1和NK2受体后,NaHS诱导的支气管收缩反应消失。另外,Patacchini等[10-11]发现,30 μmol/L~3 mmol/L浓度的NaHS可诱发大鼠离体膀胱平滑肌收缩,而用NK1和NK2受体拮抗剂或辣椒素预处理则阻断了NaHS的这一作用。近期Qgawa等[12]用大鼠足炎模型进行研究发现,硫化氢通过激活瞬时受体电位锚蛋白1通道(transient receptor potential ankyrin 1,TRPA1)而不是TRPV1,可以升高感觉神经元细胞内游离钙离子(Ca2+i)浓度,引起疼痛反应尤其是炎性反应状态下的疼痛反应;而在TRPA1基因敲除小鼠中应用TRPA1受体拮抗剂后,NaHS提高Ca2+i浓度和诱导炎性疼痛的作用明显减弱。总之,以上这些研究结果均提示,硫化氢可能通过激活辣椒素特异性TRPV-1受体或TRPA1,促进传入神经纤维末梢的Ca2+内流,从而释放包括P物质等速激肽类神经源性炎性介质,这些速激肽又通过激活NK1和NK2受体引起炎性细胞趋化和聚集,释放炎性介质,从而使平滑肌收缩,血管通透性增加,最终引起肺损伤。
此外,Ang等[13-14]在小鼠败血症相关肺损伤模型中进一步观察了硫化氢通过神经源性炎性反应加重肺损伤的具体分子机制。该研究结果显示,硫化氢通过激活TRPV1,促进肺组织P物质的释放,进而激活细胞外信号调节激酶1/2(extracellular-signal regulated kinase 1/2,ERK1/2)- 核因子κB(nuclear factor-κB,NF-κB)通路,上调肺组织中环氧合酶2(cyclooxygenase 2,COX-2)的表达和活性,促进前列腺素E(prostaglandin E,PGE)的代谢,进一步加重败血症相关的肺组织炎性反应和肺损伤。
综上所述,本研究主要从神经源性炎性反应的角度观察了硫化氢诱导肺损伤的可能机制。本研究发现,硫化氢主要通过促进气道感觉神经末梢释放P物质,引起肺组织中的中性粒细胞浸润,释放TNF-α和IL-1β等细胞因子,导致肺损伤;而阻断P物质的释放可以减轻硫化氢诱导的炎性反应以及肺损伤。
参考文献
[1]Richardson JD, Vasko MR. Cellular mechanisms of neurogenic inflammation[J]. J Pharmacol Exp Ther, 2002, 302 (3):839-845.
[2]Groneberg DA, Quarcoo D, Frossard N, et al. Neurogenic mechanisms in bronchial inflammatory disease[J]. Allergy, 2004, 59(11):1139-1152.
[3]Bhatia M, Wong FL, Fu D, et al. Role of hydrogen sulfide in acute pancreatitis and associated lung injury[J]. FASEB J, 2005, 19(6): 23-625.
[4]Zhang H, Zhi L, Moore PK, et al. Role of hydrogen sulfide in cecal ligation and puncture-induced sepsis in the mouse[J]. Am J Physiol Lung Cell Mol Physiol, 2006, 290(6):L1193-L1201.
[5]Esechie A, Kiss L, Olah G, et al. Protective effect of hydrogen sulfide in a murine model of acute lung injury induced by combined burn and smoke inhalation[J]. Clin Sci (Lond), 2008, 115(3):91-97.
[6]Li T, Zhao B, Wang C, et al. Regulatory effects of hydrogen sulfide on IL-6, IL-8 and IL-10 levels in the plasma and pulmonary tissue of rats with acute lung injury[J]. Exp Biol Med (Maywood), 2008, 233(9):1081-1087.
[7]Bhatia M, Slavin J, Cao Y, et al. Preprotachykinin-A gene deletion protects mice against acute pancreatitis and associated lung injury [J]. Am J Physiol, 2003, 284(5):G830-G836.
[8]Puneet P, Hegde A, Ng SW, et al. Preprotachykinin-A gene products are key mediators of lung injury in polymicrobial sepsis[J]. J Immunol, 2006, 176(6):3813-3820.
[9]Trevisani M, Patacchini R, Nicoletti P, et al. Hydrogen sulfide causes vanilloid receptor 1-mediated neurogenic inflammation in the airways[J]. Br J Pharamcol, 2005, 145(8):1123-1131.
[10]Patacchini R, Santicioli P, Giuliani S, et al. Hydrogen sulfide (H2S) stimulates capsaicin-sensitive primary afferent neurons in the rat urinary bladder[J]. Br J Pharmacol, 2004, 142(1):31-34.
[11]Patacchini R, Santicioli P, Giuliani S, et al. Pharmacological investigation of hydrogen sulfide (H2S) contractile activity in rat detrusor muscle [J]. Eur J Pharmacol, 2005, 509(2/3):171-177.
[12]Ogawa H, Takahashi K, Miura S, et al. H2S functions as a nociceptive messenger through transient receptor potential ankyrin 1 (TRPA1) activation[J]. Neuroscience, 2012(218):335-343.
[13]Ang SF, Sio SW, Moochhala SM, et al. Hydrogen sulfide upregulates cyclooxygenase-2 and prostaglandin E metabolite in sepsis-evoked acute lung injury via transient receptor potential vanilloid type 1 channel activation[J]. J Immunol, 2011, 187(9):4778-4787.
[14]Ang SF, Moochhala SM, MacAry PA, et al. Hydrogen sulfide and neurogenic inflammation in polymicrobial sepsis: involvement of substance P and ERK-NF-κB signaling[J]. PLoS One, 2011, 6(9):e24535.
Hydrogen Sulfide Induces the Neurogenic Inflammatory Reaction of Lung Tissues in Mice Mediated by P Substance
ZHAOQianaWANGChangqianaQIAOJian’oubZHANGHuiliaaDepartmentofCardiology,bDepartmentofRespiratoryMedicine,AffiliatedNinthPeople’sHospital,ShanghaiJiaoTongUniversitySchoolofMedicine,Shanghai200011,China
AbstractObjective:To investigate the effect of hydrogen sulfide on the neurogenic inflammation in mouse lung tissues, and its mechanism. Methods:Eight-week old, male Balb/c mice were randomly divided into the following groups: control group, NaHS group, CP-96345 + NaHS group、capsaicin + NaHS group and capsazepine + NaHS group. The mice were pretreated with vehicle, CP-96345 (2.5 mg/kg, i.p.), capsaicin (50 mg/kg, s.c.) or capsazepine (15 mg/kg, s.c.) and then received NaHS (10 mg/kg, i.p.) or 0.9% NaCl solution. One hour after intervention, the mice were sacrificed, then the concentration of substance P in plasma and the levels of tumor necrosis factor-alpha (TNF-α) and interleukine-1 beta (IL-1β) in lung homogenate were measured by ELISA assay. Myeloperoxidase (MPO) activity in lung tissues was detected by tetramethyl benzidine (TMB). The pathological changes of lung tissues were stained with hematoxylin and eosin. On the other hand, the preprotachykinin-A (PPT-A) gene knockout mice (eight-week old, female, PPT-A-/-) and their corresponding wild-type Balb/c mice (eight-week old, female, PPT-A+/+) were randomly given 0.9% NaCl solution or NaHS (10 mg/kg, i.p.). One hour after intervention, the mice were sacrificed, then MPO activity, TNF-α and IL-1β levels in lung tissues as well as the pathological changes of lung tissues were examined. Results: Hydrogen sulfide donor drug NaHS elevated significantly plasma substance P concentration (P<0.05), lung MPO activity as well as lung TNF-α and IL-1β levels (allP<0.05), resulting in lung inflammatory injury. The knockout of PPT-A gene, or pretreatment with CP-96345, capsaicin or capsazepine abolished significantly the elevation of lung MPO activity, lung TNF-α and IL-1β levels, as well as the lung injury induced by NaHS (allP<0.05). Conclusions: Hydrogen sulfide may induce lung inflammatory injury through stimulating the release of substance P in nerve endings.
Key WordsHydrogen sulfide;Inflammation;Substance P;Lung injury
通讯作者张绘莉,E-mail: lilyzhang815@hotmail.com;乔建瓯,E-mail:qjou@163.com
基金项目:上海市自然科学基金(编号:13ZR1424200)
中图分类号R563.1
文献标识码A

