转化生长因子β1对大鼠肺成纤维细胞内皮素受体类型的影响
孙燕妮 刘淑清 吴晓艳 杨洁 王丽敏 承解静 刘军
(1上海中医药大学附属普陀医院a急诊内科,b中医内科,上海 200062)
·论著·
转化生长因子β1对大鼠肺成纤维细胞内皮素受体类型的影响
孙燕妮a刘淑清b吴晓艳a杨洁a王丽敏a承解静a刘军a
(1上海中医药大学附属普陀医院a急诊内科,b中医内科,上海200062)
摘要目的:探讨转化生长因子β1(transforming growth factor-β1, TGF-β1)对大鼠肺成纤维细胞内皮素受体(endothelin receptor, ETR)类型的影响。方法: 体外培养大鼠肺成纤维细胞株,并随机分为TGF-β1 干预组、对照组。TGF-β1干预组加入含TGF-β1(10 ng/mL)的FM培养基1 mL,对照组加入1 mL FM培养基。分别培养1 d、3 d、5 d,每组每时间点设3复孔。采用荧光定量PCR法观察各组各时间点ETRA、ETRB mRNA的表达水平。用Western blotting法观察各组各时间点ETRA、ETRB蛋白的表达水平。结果:TGF-β1 干预组ETRA表达随着时间变化呈降低趋势, 3 d、5 d时显著低于模型组(P<0.01);而ETRB表达随着时间变化呈升高趋势,3 d时高于模型组(P<0.05),5 d时显著高于模型组(P<0.01)。结论:TGF-β1刺激可诱导大鼠肺成纤维细胞ETR类型发生变化,ETRA表达减少,ETRB表达增加。
关键词特发性肺间质纤维化;内皮素受体;转化生长因子-β1 ;大鼠肺成纤维细胞
特发性肺间质纤维化(idiopathic pulmonary fibrosis,IPF)原因不明,以弥漫性肺泡炎、肺泡结构紊乱以及最终的肺间质纤维化为特征。多数IPF患者起病隐匿,以干咳和进行性呼吸困难为主要表现,病情持续发展,最终死于呼吸衰竭。本病多为散发,发病率3~5/10万,好发于50~70岁男性,占所有间质性肺病的65%左右,且近年来有逐步上升的趋势[1]。本病发病机制尚不完全清楚,治疗棘手,预后不良;确诊病例即使早期对激素治疗有反应,平均生存时间也仅2~3年,5年病死率达65%[2]。
动物实验和临床研究[3]表明,内皮素-1(endothelin-1,ET-1)、转化生长因子β1(transforming growth factor-β1,TGF-β1)等细胞因子对IPF的形成有促进作用。本研究通过观察TGF-β1对体外培养的大鼠肺成纤维细胞内皮素受体(endothelin receptor,ETR)类型的影响,探索IPF的治疗机制。
1资料与方法
1.1材料大鼠肺成纤维细胞株、成纤维细胞专用FM培养基均购自Science Cell Research Laboratories,实验时用3~5代细胞。TGF-β1、Trizol购自美国Sigma公司。ETRA(ab117521)、ETRB(ab117529)抗体购自艾博抗(上海)贸易有限公司。β-actin 抗体购自天德悦(北京)生物科技有限责任公司。辣根过氧化物酶标记的IgG购自美国Santa cruz公司。PrimeScript RT-PCR Kit和Premix EX Taq 试剂盒购自宝生物工程(大连)有限公司。荧光探针、蛋白抽提试剂盒购自上海博谷生物科技有限公司。
1.2实验方法
1.2.1实验分组及干预1×106个/mL大鼠肺成纤维细胞分别接种于6孔板中,培养18 h后,分为TGF-β1 干预组和对照组。TGF-β1干预组加入含TGF-β1(10 ng/mL)的FM培养基1 mL,对照组加入FM培养基1 mL,继续培养。各组均观察1 d、3 d、5 d共3个时间点,每组各时间点均设3复孔。
1.2.2实时荧光定量PCR检测肺组织中ETRA、ETRB mRNA的表达水平收集细胞(1×106个/mL),用Trizol抽提组织总RNA,所有RNA样品经光密度分析260 nm/280 nm均为1.8~2.0。按照逆转录试剂盒说明书合成cDNA。20 μL反应体系的建立参照 SYBR Premix Ex Taq TM试剂盒[宝生物工程(大连)有限公司]说明书:Premix Ex Taq (2×) 10μL,PCR Forward Primer (10 μM)0.5 μL,PCR Reverse Primer(10 μM)0.5 μL,TaqMan probe 1.0 μL,cDNA模板2.0 μL,ddH2O 6 μL。以肌动蛋白B-actin为内参照。样品和内参均设3复管。PCR反应条件: 95℃ 30 s,95℃ 5 s,60℃ 31 s,50个循环。反应结束后,采用ABI7300 SDS Software自动分析荧光信号并将其转换成Ct值(取3复管平均值)。以2-ΔΔCt法计算目的基因与内参基因荧光比值。
1.2.3Western blotting法检测ETRA、ETRB蛋白的表达收集细胞(1×106个/mL),按蛋白抽提试剂盒说明书抽提蛋白,采用BCA法检测蛋白浓度,调整样品终浓度为4 mg/mL,煮沸5 min变性后置-70℃冰箱备用。以20 μg蛋白上样,通过SDS-PAGE电泳分离条带(电泳条件:浓缩胶恒压90 V,约20 min;分离胶恒压160 V,通过预染蛋白分子标志物来确定电泳停止时间)。转膜(300 mA恒流,1 h),封闭,洗膜,加用3%牛血清白蛋白(BSA)-TBST(Tris buffered saline with Tween)稀释500倍的ETRA、ETRB多克隆抗体后室温孵育10 min,4℃过夜。洗涤,二抗室温孵育2 h,洗涤后X线胶片曝光。扫描保存图片,用凝胶图像系统处理分析条带灰度值,计算ETRA/ Beta-actin、ETRB/ Beta-actin比值。

2结果
2.1实时荧光定量PCR法检测肺组织中ETRA、ETRB mRNA的表达水平TGF-β1干预组在TGF-β1刺激后3 d、5 d ETRA mRNA表达显著降低(P<0.01);而ETRB mRNA在TGF-β1刺激后3 d升高(P<0.05),5 d时升高更显著(P<0.01)。见表1~2。

±s)
注:与对照组比较,★★P<0.01

±s)
注:与对照组比较,★P<0.05,★★P<0.01
2.2Western blotting法检测ETRA、ETRB蛋白的表达TGF-β1刺激后3 d、5 d ETRA蛋白表达显著降低(P<0.01);而ETRB蛋白在TGF-β1刺激后3 d升高(P<0.05),5 d时升高更显著(P<0.01)。见表3~4、图1~2。

±s)
注:与对照组比较,★★P<0.01
±s)
注:与对照组比较,★P<0.05,★★P<0.01
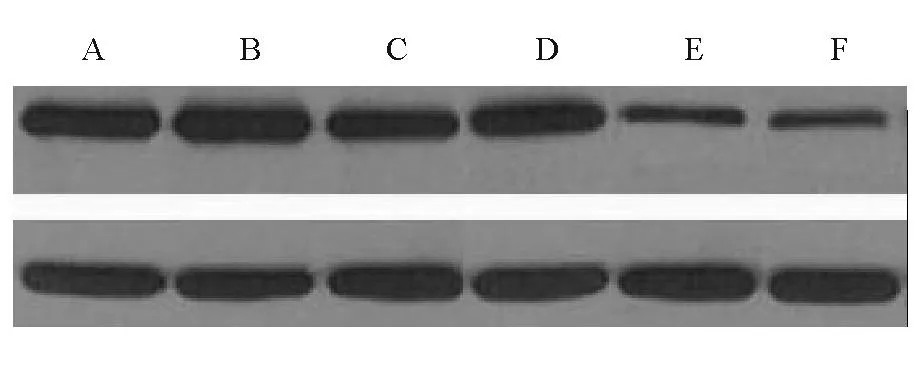
注:A为对照组1 d,B为对照组3 d,C为对照组5 d,D为TGF-β1干预组1 d,E为TGF-β1干预组3 d,F为TGF-β1干预组5 d
图1Western blotting法检测ETRA蛋白的表达

注:A为对照组1 d,B为对照组3 d,C为对照组5 d,D为TGF-β1干预组1 d,E为TGF-β1干预组3 d,F为TGF-β1干预组5 d
图2Western blotting法检测ETRB蛋白的表达
3讨论
在肺内,ET-1主要由肺成纤维细胞、内皮细胞和上皮细胞等分泌。肺损伤发生后,ET-1与ETR结合,一方面介导上皮-间充质转化(epithelial-mesenchymal transition,EMT)[4],通过激活PKC、PI3K、MAPK等多个信号通路, 作用于附近的肺平滑肌细胞和肺成纤维细胞等成分, 合成并释放炎性因子,引起肺气道和血管平滑肌收缩;并使肺成纤维细胞转变为肌成纤维细胞,后者具有收缩功能且能够合成并分泌大量细胞外基质(extracellular matrix, ECM)及多种细胞因子[5]。另一方面,ET-1还可以通过p38 促MAPK和PI3K/AKT信号途径抑制成纤维细胞的凋亡,使组织修复功能失衡,使肺成纤维细胞易被ET-1和TGF-β1活化,导致胶原蛋白和ECM过度合成,最终促进IPF的发生及发展[6]。
在纤维化鼠模型中观察发现,ET-1及其受体的表达水平增高,且ET-1的增多与胶原的沉积增加和肺损伤的严重程度呈正相关,而双重ETR拮抗剂波生坦可以减轻IPF[7]。
ETR亚型在不同的组织是不一样的,在动脉硬化时平滑肌细胞以表达ETRB为主[8],心肌纤维化时则以表达ETRA为主[9]。ETRA和ETRB与不同的Gα蛋白结合,导致其信号转导途径的改变。
TGF-β1与肺纤维化关系密切,是肺纤维化过程中的最直接的细胞因子。研究[10]发现,无论在博莱霉素诱导的肺纤维化小鼠模型中还是在IPF患者肺中,TGF-β1蛋白表达均升高。IGF-β1一方面可以促进成纤维细胞增殖并激活肺成纤维细胞转化为肌成纤维细胞[11];另一方面可以抑制ECM的降解和成纤维细胞的凋亡[12]。Busnadieqo等[13]提出了TGF-β1/ET-1轴的概念,他们的研究结果表明,无论TGF-β1阻断剂还是ETR拮抗剂均能减轻EMT并延缓组织纤维化进程。
本研究中,大鼠肺成纤维细胞经TGF-β1刺激后3 d、5 d时ETRA表达均显著降低(P<0.01);ETRB在TGF-β1刺激后3 d时升高(P<0.05),5 d时升高更显著(P<0.01)。从而证实TGF-β1刺激可诱导大鼠肺成纤维细胞的ETR类型从ETRA向ETRB转变,与国外文献[14]一致。
参考文献
[1]Raghu G,Collard HR,Egan JJ,et al. An official ATS,ERS,JRS,ALAT statement:idopathic pulmonary fibrosis:evidence-based guidelines for diagnosis and management[J].Am J Respjr Crit Care Med,2011,183(6):788-824.
[2]Fernandez PR,Daniels CE,Schroeder DR,et al. Incidence,prevalence,and clinical course of idopathic pulmonary fibrosis: a population-based study[J]. Chest,2010,137(1):129-137.
[3]Sonnylal S,Shi-wen X,Leoni P,et al.Selective expression of connective tissue growth factor in fibroblasts in vivo promotes systemic tissue fibrosis[J]. Arthritis Rheum,2010,62(5):1523-1532.
[4]Ohbayashi M,Kubota S,Kawase A,et al.Involvement of epithelial-mesenchymal transition in methotrexate-induced pulmonary fibrosis[J]. J Toxicol Sci, 2014,39(2):319-330.
[5]Zhang J,Yang W,Hu B,et al.Endothelin-1 Activation of the Endothelin B Receptor Modulates Pulmonary Endothelial CX3CL1 and Contributes to Pulmonary Angiogenesis in Experimental Hepatopulmonary Syndrome[J]. Am J Pathol,2014,184(6):1706-1714.
[6]Cargnello M,Roux PP.Activation and function of the MAPKs and their substrates,the MAPK-activated protein kinases[J]. Microbiol Mol Biol Rev, 2011,75(1):50-83.
[7]Akamata K,Asano Y,Aozasa N,et al.Bosentan reverses the pro-fibrotic phenotype of systemic sclerosis dermal fibroblasts via increasing DNA binding ability of transcription factor Fli1[J].Arthritis Res Ther,2014,16(2):R86.
[8]Iwasa S, Fan J, Shimokama T,et al. Increased immunoactivity of endothelin-1 and endothelin B receptor in human artheosclerotic lesions. A possible role in artherogenesis[J]. Arteriosclerosis,2009,146:93-100.
[9]Drimal J, Mislovicova M, Ismail A,et al.Detrimental subtype-specific endothelin-1 (ET-1) signaling in myocardial cells: the ETA mediated proliferation and ETB receptor down-regulation[J]. Physiol Res,1999,48(1):9-19.
[10]López - Hernández FJ,López - Novoa JM. Role of TGF-β in chronic kidney disease an integration of tubular, glomerular and vascular effects[J]. Cell Tissue Res,2012,347(1):141-154.
[11]Agostini C,Gurrieri C.Chemokine /cytokine cocktail in idiopathic pulmonary fibrosis.Proc Am Thorac Soc,2006,3(4):357-363.
[12]Yanagita M. Inhibitors/ antagonists of the TGF -β1 system in kidney fibrosis[J]. Nephrol Dial Transplant,2012,27(10):3686 -3691.
[13]Busnadieqo O,Loureiro-Alvarez J,Sandoval P,et al.A pathogenetic role for endothelin-1 in peritoneal dialysis-associated fibrosis[J]. J Am Soc Nephrol,2015,26(1):173-182.
[14]Angelika H,Christoph L,Gabriele S,et al.Signalling and regulation of collagen I synthesis by ET-1 and TGF-β1[J].FEBS Journal,2011, 272 (24): 6297-6309.
Effects of Transforming Growth Factor-β1 on the Types of Endothelin Receptor of Rat Lung Fibroblasts
SUNYanniaLIUShuqingbWUXiaoyanaYANGJieaWANGLiminaCHENGXiejingaLIUJun11.aDepartmentofEmergency,bDepartmentofTraditionalChineseMedicine,PutuoHospital,ShanghaiUniversityofTraditionalChineseMedicine,Shanghai200062,China
AbstractObjective:To investigate the effect of transforming growth factor-β1(TGF-β1) on the types of endothelin receptor(ETR) of rat lung fibroblasts. Methods:Rat lung fibroblasts were cultured in vitro and randomly divided into the TGF-β1 group and the control group. In TGF-β1 group 1 mL FM cell culture medium which contained 10 ng/mL TGF-β1 was added, while 1 mL FM cell culture medium was directly added into control group. Time points were set at 1 d, 3 d, 5 d in each group, and each group was made in triplicate at each time point. The mRNA expression levels of ETRA and ETRB in each group at each time point were observed with fluorescence quantitative PCR. The protein expression levels of ETRA and ETRB in each group at each time point was observed with Western blotting. Results: The expression of ETRA in TGF-β1 group decreased over time, and was significantly lower than that in control group at 3 d and 5 d (P<0.01). However, the expression of ETRB, which increased over time, was higher than that in the control group at 3 d(P<0.05), and significantly higher than that in control group at 5 d (P<0.01). Conclusions: The types of ETR of rat lung fibroblasts change after stimulation of TGF-β1, the ETRA expression decreasing and the ETRB expression increasing.
Key WordsIdiopathic pulmonary fibrosis;Endothelin receptor;Transforming growth factor-β1;Rat lung fibroblasts
通讯作者刘军,E-mail:pzxliujun1964@163.com
基金项目:上海中医药大学附属普陀医院重点课题(编号:2013ZD190Ⅰ)
中图分类号R 563.9
文献标识码A

