杏香兔耳风中5种单体对LPS诱导RAW264.7细胞内NO生成的影响*
杏香兔耳风中5种单体对LPS诱导RAW264.7细胞内NO生成的影响*
★谢斌1*第一作者:谢斌(1975—),男,副教授。研究方向:中医药抗感染。E-mail:331080826@qq.com。吴蓓2欧阳辉1黎田儿1李艳1张武岗1杨世林1冯育林1*通信作者:冯育林,男,教授。研究方向:中药化学成分。E-mail:fengyulin2003@hotmail.com。(1.江西中医药大学中药固体制剂制造技术国家工程研究中心南昌 330006;2.南昌市食品药品检验所南昌 330038)
摘要:目的:观察从杏香兔耳风中分离得到的木犀草素、木犀草苷、绿原酸、3,5-二咖啡酰基奎宁酸(3,5-DCQA)和4,5-二咖啡酰基奎宁酸(4,5-DCQA)5种中药单体对LPS诱导的炎症状态中细胞内NO含量的影响,从而初步筛选出具有抗炎作用的中药单体。方法:以LPS诱导RAW264.7巨噬细胞建立炎症反应模型,采用木犀草素等5种不同中药单体预处理细胞,另设正常对照组及LPS单独处理组,采用Griess试剂法分别测定各组NO生成含量。结果:5种单体均能降低LPS诱导的炎症状态下RAW264.7细胞内NO的生成,且与各单体的浓度相关。结论:杏香兔耳风中5种单体可明显降低LPS诱导的RAW264.7细胞NO的含量从而发挥抗炎作用。
关键词:杏香兔耳风;5种单体;NO;炎症
炎症是十分常见而又重要的基本病理过程。炎症不同于感染,但很多炎症又是基于感染而发生的。在临床治疗上,抗炎药物也是仅次于抗感染药物的第二大类药物。许多传统中药都有显著的抗炎作用,从中分离得到的中药单体也具有很好的抗炎作用[1-2]。中药单体成分简单,作用机制及其毒副作用易明确等优点,使得开发安全有效的中药制剂成为治疗炎症的研究热点。本实验拟通过LPS诱导RAW264.7巨噬细胞建立炎症反应模型[3],观察从杏香兔耳风中分离得到的木犀草素、木犀草苷、绿原酸、3,5-二咖啡酰基奎宁酸(3,5-DCQA)和4,5-二咖啡酰基奎宁酸(4,5-DCQA)五种中药单体对LPS诱导的炎症状态中细胞内NO含量的影响,以期初步筛选出具有抗炎作用的中药单体。
1材料与方法
1.1药品与试剂五种中药单体木犀草甘、木犀草素、绿原酸、3,5-二咖啡酰基奎宁酸、4,5-二咖啡酰基奎宁酸均由本实验室自制,纯度大于98%。Griess试剂由上海碧云天生物科技有限公司提供,货号为S0021。RPMI1640购自Hyclone公司,货号为SH30809。FBS购自BinInd公司,货号为04-001-EA。
1.2主要仪器CO2细胞培养箱(Thermo Scientific 8000),低速离心机(上海卢湘仪TDZ4B-WS),分光光度计(BIO-RAD SmartSpench plus),倒置显微镜(Olympus IX71)。
1.3细胞培养及处理RAW264.7小鼠单核/巨噬细胞系由本实验室提供,置于37℃、5%CO2的培养箱中孵育。于96孔细胞培养板中每孔加入200μL细胞悬液,2×104个细胞/孔,将培养板置于CO2培养箱中培养12h。分别加入2,4,6mg/mL LPS 100μL,再于每个浓度的LPS中分别加入不同浓度的五种单体,每个单体设4个浓度(100,200,400,800μg/mL),每个浓度设3给平行孔,另设正常对照孔。加药后,培养板于微孔板振荡器上振荡混匀,置于37℃CO2培养箱中继续培养24h。
1.4NO含量检测吸取培养液上清,根据Geriss说明书进行NO含量检测,用分光光度计于540nm处测定吸光度值,绘制标准曲线,计算样品中NO含量。
2结果
2.12 mg/mL LPS诱导RAW264.7细胞NO生成的影响表1结果显示,正常RAW264.7细胞内NO生成很低,当加入LPS诱导后,RAW264.7细胞内NO的生成显著增加(P<0.01)。经LPS处理后分别给予五种单体,检测其NO含量,实验数据表明加入单体后细胞内NO含量显著降低(P<0.01),但多数仍高于正常对照组(P<0.01)。表明这五种单体在一定程度上能够部分抑制LPS诱导的NO生成,且在本实验浓度范围内,各单体浓度越大,NO含量越低。此外,当单体浓度增加为800μg/mL时,绿原酸和3,5-二咖啡酰基奎宁酸处理的细胞内NO含量低于正常组,推测随着单体浓度的增大,NO含量可能低于正常细胞内NO的含量。表明这五种单体能够部分甚至完全抑制炎症状态下单核/巨噬细胞内NO的生成,且该抑制作用与其浓度有关。
2.24 mg/mL LPS诱导RAW264.7细胞NO生成的影响由表1结果可知,当LPS为2 mg/mL时,木犀草素等五种单体能够降低NO的生成,那么我们考虑当增加LPS的浓度时,这五种单体与NO的关系又是如何?实验结果如表2所示,当LPS的浓度上升为4 mg/mL时,细胞内NO的生成也随之相应上升,较正常组有显著性差异(P<0.01)。同样,经LPS处理后分别加入五种单体,从表中可以看出细胞内NO的生成减少,且单体浓度越大,NO含量越低(P<0.01)。除800 μg/mL的3,5-DCQA组细胞内NO含量降至正常外,其余均高于正常组。表明当LPS浓度增大时,木犀草素等5种单体同样能部分甚至完全抑制细胞内NO的生成,且单体浓度越大抑制作用越强。
2.36 mg/ml LPS诱导RAW264.7细胞NO生成的影响为了进一步验证以上实验结果,我们将LPS的浓度增加为6mg/mL,实验结果与上述一致。如表3数据所示,当LPS浓度上升为6mg/mL时,RAW264.7细胞内NO生成显著增加(P<0.01)。同样,在LPS处理后给予五种单体也能降低细胞内NO的生成,但仍显著高于正常水平(P<0.01)。此外,从表中还可以看出单体浓度越大,NO含量越低。表明在高浓度的LPS诱导的炎症状态下,木犀

表1 2 mg/mL LPS诱导RAW264.7细胞NO生成的影响
注:与正常对照组比较,*P<0.01;与单独LPS组比较,#P<0.01。
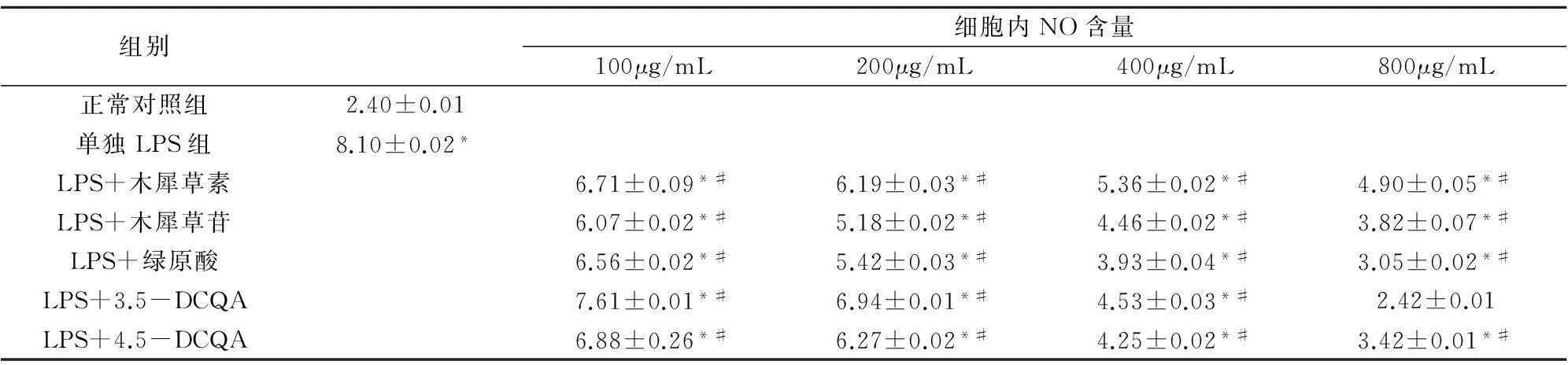
表2 4 mg/mL LPS诱导RAW264.7细胞NO生成的影响
注:与正常对照组比较,*P<0.01;与单独LPS组比较,#P<0.01。

表3 6mg/mL LPS诱导RAW264.7细胞NO生成的影响
草素等五种单体能部分但不能完全抑制NO的生成。
以上实验数据表明,当LPS浓度为2mg/mL、4mg/mL或6mg/mL时,木犀草素、木犀草苷、绿原酸、3,5-DCQA和4,5-DCQA都能呈浓度依赖的抑制LPS诱导RAW264.7细胞内NO的生成。表明这五种单体具有一定程度的抗炎作用。
3讨论
NO是介导炎症反应的关键因子,可杀灭侵入机体的病原微生物,维持机体正常的免疫防御功能。各种动物组织和细胞内NO的合成均由一氧化氮合成酶(NOS)催化L-精氨酸形成。NOS有三种亚型,其中诱导型一氧化氮合成酶(iNOS)是合成NO的唯一途径。少量的NO是维持正常细胞功能必不可少的物质,然而研究表明LPS和/或细胞因子等刺激因子能诱导单核巨噬细胞高表达iNOS从而合成过量的NO,造成细胞毒性和组织损伤等一系列炎症反应[5-7]。LPS是格兰阴性菌致病的主要因素,能通过与细胞膜受体相互作用,作用于宿主细胞,并通过细胞内信号传递级联基因表达发生变化[4]。LPS能够刺激体内多种细胞合成和释放众多内源性生物活性因子,如NO、PGE2、TNF-a、IL-6等,导致全身炎症反应发生。
本实验选取了五种中药单体检测其抗炎活性,分别是木犀草素、木犀草苷、绿原酸、3,5-DCQA和4,5-DCQA。其中木犀草素和木犀草苷均属黄酮类化合物,是天然黄酮的代表性物质。木犀草素具有抗肿瘤、保护心血管、调节免疫系统和抗炎等多种药理学作用[8-11]。木犀草苷,又名木犀草素-7-O-葡萄糖苷,木犀草苷也是重要的生物活性物质,具有抗肿瘤、抗氧化、消炎和抗病毒等多种活性[12-14]。绿原酸是植物体在有氧呼吸过程中合成的一种苯丙类物质,也具有抗菌消炎、免疫调节、抗病毒、抗肿瘤等多种药理学功能[15-16]。而3,5-DCQA和4,5-DCQA的活性目前尚不清楚。
本实验通过LPS诱导RAW264.7巨噬细胞建立细胞炎症反应模型,检测木犀草素等五种单体的抗炎作用。实验结果表明,木犀草素、木犀草苷、绿原酸、3,5-DCQA和4,5-DCQA这五种单体均能降低LPS诱导的RAW264.7细胞内NO的含量。且单体浓度越大,NO的含量越低。表明这五种单体均具有抗炎作用。另外实验结果还表明这五种中药单体之间除个别外均具有显著性差异(P<0.05),但尚不能表明这五种单体有优劣之分。这些中药单体有望成为在NO介导的相关疾病中发挥抗炎作用。
参考文献
[1]刘艳,宋方闻,胡毅文,等.复方甘草甜素治疗慢性乙型肝炎临床疗效观察[J].中国药房,2002,13(7):B4201.
[2]Lee KJ, Kim JY, Jung KS, et al. Suppressive effects of platycodon grandiflorum on the progress of carbon tetrachloride-induced hepatic fibrosis[J].Arch Pharm Res,2004,27(12):1 238-1 244.
[3]Ralph R, Nakoinz I, et al. Antibody-dependent killing of erythrocyte and tumor targets by macrophage-related cell lines: enchancement by PPD and LPS[J].The Journal of Immunology,1977(119):3 950-3 954.
[4]吴丽颖,王兴鹏.阻断内毒素信号传导通路治疗脓毒症或脓毒性休克的研究进展[J].中华急诊医学杂志,2003,12(2):135-137.
[5]Krncke, Fehsel,Kolb-Bachofen.Inducible nitric oxide synthase in human diseases[J].Clinical & Experimental Immunology,1998,113(2):147-156.
[6]Tetsuo Umino , Eiji Kusano , Shigeaki Muto , et al. AVP inhibits LPS- and IL-1β-stimulated NO and cGMP via V1 receptor in cultured rat mesangial cells[J].American Journal of Physiology-Renal Physiology,1999,276(3):433-441.
[7]Xie F, Lang Q,Zhou M,et al.The dietary flavonoid luteolin inhibites Aurora B kinase activity and blocks proliferation of cancer cells[J].Eur J Pharm Sci,2012,2(2):86-90.
[8]Attoub S, Hassan AH, Vanhoecke B, et al. Inhibition of cell survival, invasion, tumor growth and histone deacetylase activity by the dietary flavonoid luteolin in human epithelioid cancer cells[J].Eur J Pharmacol,2011,651(1-3):18-25.
[9]Choi AY, Choi JH, Yoon H, et al. Luteolin induces apoptosis through endoplasmic reticulum stress and mitochondrial dysfunction in Neuro-2a mouse neuroblastoma cells[J].Eur J Pharmacol,2010,642(1-3):19-27.
[10]Zhu DQ,Liu K,Yi JK,et al.Luteolin inhibits inflammatory response and improves insulin sensitivity in the endothelium[J].Biochimie,2011,93(3):506-512.
[11]Frum Y, Viljoen A M, Van Heerden F R. Verbascoside and luteolin-5-O-β-D-glucoside isolated from Halleria lucida L. exhibit antagonistic anti-oxidant properties in vitro[J].South Afr J Bot,2007,73(4):583-587.
[12]Jung H A, Jin S E, Min B S, et al. Anti-inflammatory activity of Korean thistle Cirsium maackii and its major flavonoid, liteolin 5-O-glucoside[J].Food Chem Toxicol,2012,50(6):1 271-1 279.
[13]Tian Y,Sun L M,Liu X Q,et al.Anti-HBV active flavones glucosides from Euphorbia humifusa Willd[J].Fitoterapia,2010,81(7):799-802.
[14]Bandyopadhyay G,Biswas T,Roy KC,et al.Chlorogenic acid inhibits Bcr-Abl tyrosine kinase and triggers p38 mitogen-activated protein kinase-dependent apoptosis in chronic myelogenous leukemic cells[J].Blood,2004,104(8):2 514-2 522.
[15]WU L.Effect of chlorogenic acid on antioxidant activity of Flos Loniceras extracts[J].J Zhejiang Univ Sci B,2007,8(9):673-679.
(收稿日期:2015-10-14)编辑:翟兴英
中图分类号:R285
文献标识码:B
*基金项目:国家自然科学基金项目(81560636,81102787);江西省自然科学基金重点项目(20133ACB21005)。

