前驱体合成条件对LiNi0.5MnO3性能的影响
刘丽丽,韩恩山,朱令之,寇艳娟
(河北工业大学化工学院,天津 300130)
前驱体合成条件对LiNi0.5MnO3性能的影响
刘丽丽,韩恩山,朱令之,寇艳娟
(河北工业大学化工学院,天津 300130)
以氨水为络合剂、NaOH为沉淀剂,采用氢氧化物共沉淀法合成锂离子电池正极材料LiNi0.5MnO3。研究前驱体合成时过渡金属离子浓度和反应溶液pH值对产物电化学性能的影响。最佳反应条件为:过渡金属离子浓度为1.5 mol/L、反应溶液pH值为11.0。在此条件下合成的样品在2.2~5.0 V充放电,0.1C首次放电比容量达到158.6 mAh/g,库仑效率为85.3%,以0.2C循环20次,容量保持率为75.0%。
LiNi0.5MnO3; 共沉淀法; 锂离子电池; 电化学性能
尖晶石LiMn2O4的资源丰富、成本低廉、对环境友好且安全性能好,但Mn3+产生的Jahn-Teller效应及锰的溶解,使材料的循环性能恶化,容量衰减快[1]。针对这一缺点,人们采用掺杂金属阳离子来改性。过渡金属阳离子取代的尖晶石型锂锰氧化物,不但可抑制Jahn-Teller效应,提高材料的循环寿命,还可使电池的充放电电压提高至5 V左右,提高材料的能量密度[2]。在这些5 V级正极材料中,LiNi0.5MnO3具有高容量(理论比容量192.6 mAh/g)、高电压(4.7 V)和良好的循环性能,且目标产物中不含Co,成本较低。
共沉淀法可使前驱体混合更均匀,所得产物的放电比容量更高。本文作者通过氢氧化物共沉淀法结合高温固相法合成LiNi0.5MnO3正极材料,对产物的电化学性能进行分析。
1 实验
1.1 LiNi0.5MnO3的氢氧化物共沉淀法制备
按照物质的量比2∶1,称取MnSO4·H2O(天津产,AR)、NiSO4·6H2O(天津产,AR),讨论过渡金属离子浓度时,pH值设定为11.0,总金属离子浓度分别为0.5 mol/L、1.0 mol/L、1.5 mol/L和2.0 mol/L。将沉淀剂NaOH(天津产,AR)溶液的浓度配成总金属离子浓度的两倍,为使碱金属全部沉淀,络合剂NH3·H2O(天津产,AR)配成与总金属离子浓度相同的溶液。以氨水为底液,调节pH值为11.0,在持续搅拌的状态下,同时滴加3种溶液,通过控制氨水滴加速度控制溶液的pH值,以600 r/min的转速搅拌2 h,得到Ni0.5Mn(OH)3前驱体。当最佳过渡金属离子浓度确定后,再分别在pH值为9.0、10.0、11.0和12.0时,制备相应的前驱体。恒温水浴加热,控制整个过程的反应温度为50 ℃。将前驱体抽滤,用去离子水反复洗涤3次,再在100 ℃下烘干12 h。
将前驱体与Li2CO3(天津产,AR)按物质的量比2.00∶1.02称量后,加入分散剂乙醇(天津产,AR),在SHQM-0.4L球磨机(连云港产)中以200 r/min的转速球磨(球料比20∶1)5 h,再在100 ℃下烘干12 h。将所得粉末置于马弗炉中,在450 ℃下预烧4 h,再在850 ℃下煅烧12 h,升温速率均为10 ℃/min,制备LiNi0.5MnO3。
1.2 电池的组装
将制备的材料、乙炔黑(焦作产,AR)和聚偏氟乙烯(日本产,AR)按质量比8∶1∶1混匀,溶于N-甲基吡咯烷酮(天津产,AR)中,搅拌成浆状,涂覆在16 μm厚的铝箔(广东产,AR)上,在110 ℃下干燥3 h,冲成直径为8 mm的圆片[3]。
以金属锂片(河北产,99.5%)为对电极,Celgard 2400膜(日本产)为隔膜,1 mol/L LiPF6/EC+DMC+EMC(体积比1∶1∶1,韩国产,电池级)为电解液,在RH < 5%的手套箱中,组装半径15 mm、高20 mm的圆柱形模拟电池。
1.3 材料分析和电化学性能测试
用HEUVEN型热分析仪(北京产)对Li2CO3和前驱体的混合物进行TG-DTA分析,空气气氛下,以10 ℃/min的速度从室温升温至1 000 ℃;用Optima 7300V电感耦合等离子体原子发射光谱(ICP-AES)仪(美国产)分析制备的LiNi0.5MnO3的组成;用D8-Focus型X射线衍射仪(德国产)对合成的材料进行物相分析,CuKα,管压40 kV、管流150 mA,步宽为0.02 °,扫描速度为12(°)/min;用NanoSEM 450扫描电子显微镜(美国产)观察材料的微观形貌;用CHI-660C电化学工作站(上海产)对电池进行循环伏安性能测试,扫描速度为0.1 mV/s,电位为2.2~4.9 V;用CT2100A型电池测试系统(武汉产)进行恒流充放电测试,以0.1C、0.2C和0.5C各循环20次,电压为2.2~5.0 V。
2 结果与讨论
2.1 Li2CO3和前驱体混合物热重差热分析
Li2CO3和前驱体混合物的TG-DTA曲线见图1。
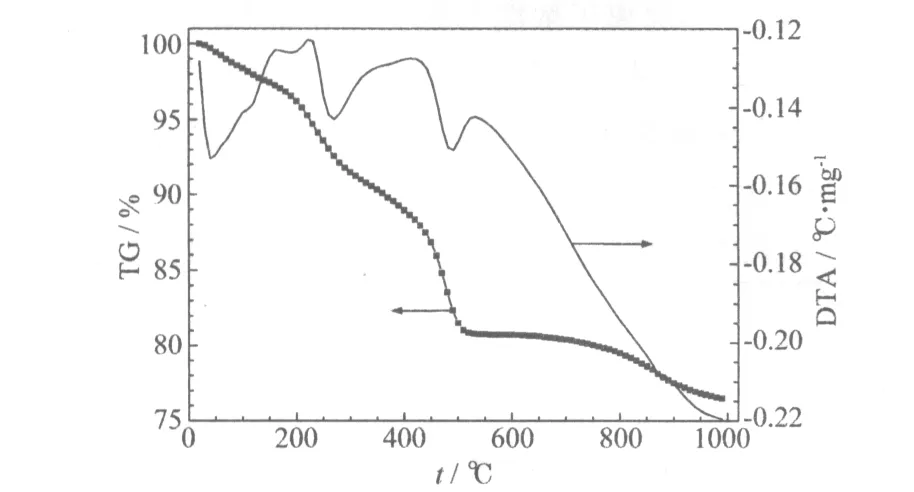
图1 Li2CO3和前驱体混合物的TG-DTA曲线Fig.1 TG-DTA curves of mixture of Li2CO3 and precursor
从图1可知,在测试范围内,TG曲线有3个质量损失阶段。在室温到150 ℃范围内,是材料本身所含水分挥发和杂质分解所致,质量损失约为7%。在200~400 ℃的失重,可能是过渡金属氢氧化物分解所致,对应DTA曲线的一个吸热峰,质量损失约为10%。在400~500 ℃的失重,可能与Li2CO3的分解[4]有关,质量损失约为8%。Li2CO3的分解温度高达1 310 ℃,分析TG曲线可知,Li2CO3的分解可能是受过渡金属盐分解产物的催化作用。温度高于500 ℃后,材料的质量基本上没有变化,伴随着持续的吸热,是金属离子发生晶格重组形成目标产物晶体的阶段。在800~900 ℃,TG曲线出现微量的质量损失,DTA曲线对应位置也出现一个较小的吸热峰,可能是因为反应温度过高,造成混合物中少量Li挥发。
综上所述,制备LiNi0.5MnO3的预烧温度定为450 ℃,煅烧温度定为850 ℃。
2.2 LiNi0.5MnO3的元素组成和形貌分析
LiNi0.5MnO3的元素分析结果见表1。
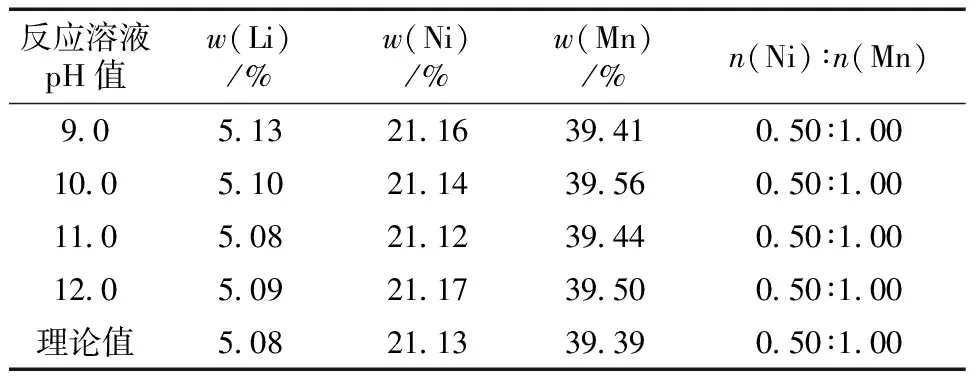
表1 不同反应溶液pH值制备的LiNi0.5MnO3的实验和理论元素含量
从表1可知,不同pH值下制得样品的n(Ni)∶n(Mn)与标准值相同,说明制得样品的Ni、Mn含量准确;Li的含量说明在煅烧过程中Li的损失不容忽视。

图2 不同反应溶液pH值制备的LiNi0.5MnO3的SEM图
从图2可知,正极材料粉末形态和粒子大小没有明显差别,合成的样品多半呈尖晶石结构,棱角分明,颗粒大小比较均匀,基本保持在3 μm以下,但当pH值达到12.0时,样品表面明显不光滑。
与过渡金属离子浓度相比,pH值对产物影响较大,所以优先分析不同反应溶液pH值合成产物的元素组成和形貌分析。分析得知,pH值对产物的组成和形貌影响不大。
2.3 过渡金属浓度对LiNi0.5MnO3电化学性能的影响
不同前驱体合成过渡金属离子浓度制备LiNi0.5MnO3的0.1C首次充放电曲线见图3a,循环性能见图3b。
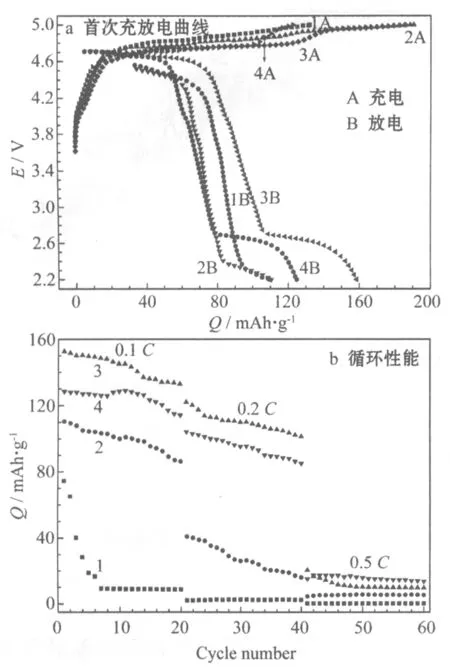
1 0.5 mol/L 2 1.0 mol/L 3 1.5 mol/L 4 2.0 mol/L
从图3a可知,过渡金属离子浓度为0.5 mol/L、1.0 mol/L、1.5 mol/L和2.0 mol/L制备的样品,0.1C首次放电比容量分别为109.5 mAh/g、110.5 mAh/g、158.6 mAh/g、144.9 mAh/g。放电比容量较高的样品,过渡金属离子浓度为1.5 mol/L和2.0 mol/L。放电曲线呈现出两个电压平台,分别位于4.7 V和2.8 V。在4.7 V处的充放电平台,对应Ni2+/Ni4+氧化还原;2.8 V处的充放电平台,对应Mn3+/Mn4+氧化还原,说明材料中含有Mn3+。锂离子电池采用恒流充电,电压起始升高较快,容量一般随时间线性增加,因此充电曲线不是呈现两个电压平台。从图3b可知,过渡金属离子浓度为0.5 mol/L、1.0 mol/L、1.5 mol/L和2.0 mol/L制备的样品,以0.1C循环20次的容量保持率分别为11.7%、78.0%、85.3%和84.7%。过渡金属离子浓度为1.5 mol/L制备的样品,容量保持率最高,在0.5C大倍率下的循环性能也较稳定,保持在10 mAh/g。综合考虑合成材料的性能,选择过渡金属离子浓度1.5 mol/L。
不同前驱体合成过渡金属离子浓度制备的LiNi0.5MnO3的循环伏安曲线见图4。
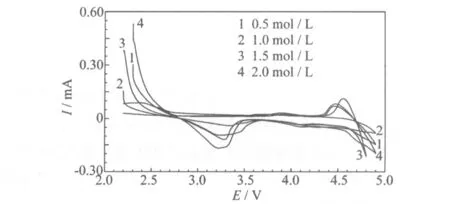
图4 不同过渡金属离子浓度制备的LiNi0.5MnO3的循环伏安曲线
从图4可知,曲线上存在两对强的氧化还原峰,分别对应着Li+在正极材料中的脱出和嵌入。氧化峰对应着Li+的脱出,即充电,还原峰对应着Li+的嵌入,即放电。3.2 V附近是Mn3+/Mn4+氧化还原峰,4.7 V附近是Ni2+/Ni4+氧化还原峰。说明Li+的嵌脱都是分两步进行的。曲线上Mn3+/Mn4+氧化还原峰,说明材料中3 V平台不可以忽略,与充放电曲线上2.8 V区放电容量较大相对应。高电压附近,峰电位差Δφ=0.2 V,比较小。Δφ反应了电化学极化的程度,Δφ越小,极化越轻。综合分析图4可知,过渡金属离子浓度为1.5 mol/L制备的样品,Δφ最小,说明极化较轻,因此Li+嵌脱的性能较好。这与电化学性能测试的结果一致。
综上所述,过渡金属离子的最佳浓度为1.5 mol/L。
2.4 反应溶液pH值对LiNi0.5MnO3电化学性能的影响
不同反应溶液pH值制备的LiNi0.5MnO3的0.1C首次充放电曲线见图5a,循环性能见图5b。
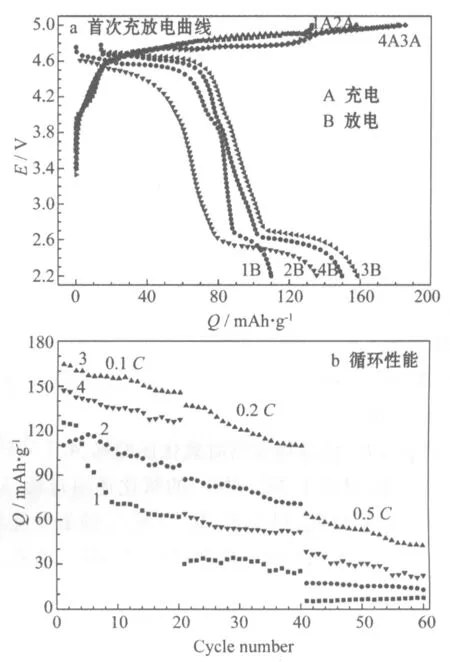
1 pH=9.0 2 pH=10.0 3 pH=11.0 4 pH=12.0图5 不同反应溶液pH值制备的LiNi0.5MnO3的电化学性能
从图5a可知,反应溶液pH值为9.0、10.0、11.0和12.0制备的样品,0.1C首次放电比容量分别为109.9 mAh/g、134.7 mAh/g、158.6 mAh/g和149.8 mAh/g,首次库仑效率分别为79.1%、82.7%、85.3%和74.6%。溶液pH值为11.0制备的样品,首次放电比容量最高,并有较好的充放电效率。首次不可逆容量损失主要是固体电解质相界面(SEI)膜的形成消耗Li+导致的。SEI膜形成消耗了电池中有限的Li+,造成了能量转换的不可逆性,也增加了电极/电解液界面的电阻,造成一定的电压滞后。从图5b可知,反应溶液pH值为9.0、10.0、11.0和12.0制备的样品,以0.1C循环20次的容量保持率分别为54.6%、76.7%、85.7%和84.8%,其中溶液pH值为11.0和12.0制备的样品,容量保持率较高。0.1C循环20次后,再分别以0.2C和0.5C较大倍率循环20次,溶液pH值为11.0制备的样品的保持率最高。综合考虑合成材料的容量、倍率性能,选择反应溶液pH值为11.0是最优条件。反应溶液pH值过大或过小,会导致氨水的络合反应与沉淀反应发生竞争,使Ni、Mn离子沉淀不完全,因此放电比容量偏低。
从图5可知,在最优条件(过渡金属离子浓度1.5 mol/L、反应溶液pH值11.0)下制备的样品,0.1C首次放电比容量为158.6 mAh/g,首次循环的库仑效率为85.3%,第20次0.1C循环的放电比容量为146.0 mAh/g,以0.2C循环20次,放电比容量仍保持有110.0 mAh/g,容量保持率为75.0%,在大电流0.5C下循环20次,放电比容量仍能达到42.6 mAh/g,具有较好的容量和倍率循环性能。
不同反应溶液pH值制备的LiNi0.5MnO3的循环伏安曲线见图6。
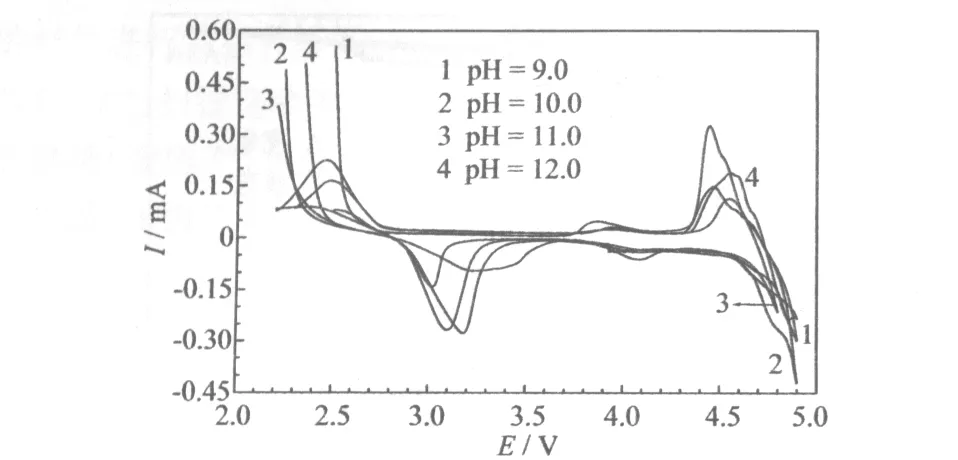
图6 不同反应溶液pH值制备的LiNi0.5MnO3的循环伏安曲线
从图6可知,样品均有两对氧化还原峰,4.7 V附近的氧化还原峰较强,对应于Ni2+/Ni4+的氧化还原过程,3.2 V附近的氧化还原峰较弱,对应于Mn3+/Mn4+的氧化还原过程,这与前面充放电曲线的两个放电平台相一致。溶液pH值为11.0制备的样品,峰电位差较小,说明电化学可逆性良好,与电化学性能测试的结果一致。
2.5 最优条件下制备的LiNi0.5MnO3的XRD分析
采用最优条件(过渡金属离子浓度1.5 mol/L,反应溶液pH值为11.0)合成前驱体,在850 ℃下煅烧制备LiNi0.5MnO3进行XRD分析,实验结果见图7。
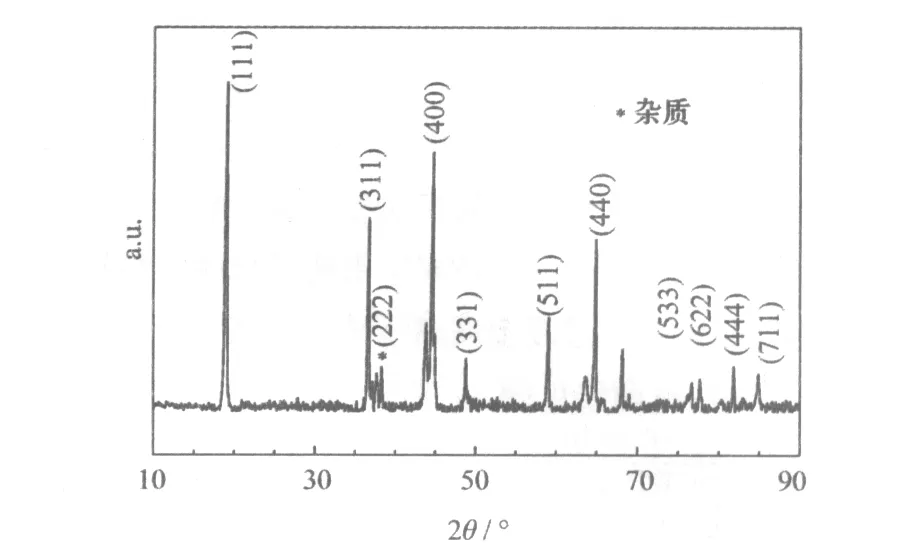
图7 在最优条件下制备的LiNi0.5MnO3的XRD图
从图7可知,样品的衍射峰与尖晶石LiMn2O4标准卡片(PDF35-782)相符,制备的材料LiNi0.5MnO3为立方晶系,尖晶石结构,属于Fd3m空间点群,但有杂质峰存在。样品在37.4 °处有少量杂质峰,是高温生成LizNi1-zO杂质相所致。高温下制备的材料中,由于氧缺陷,会形成少量的LizNi1-zO杂质相,因而出现少量杂质峰。除了杂质峰外,图谱峰形尖锐,说明材料的结晶度非常好。用Jade软件对XRD图进行全谱拟合,得到晶胞参数:a=0.493 6nm、b=0.853 1 nm、c=0.968 6 nm,V=0.401 66 nm3,R=2.45。R值大于1.2,说明所合成材料的Ni+、Li+混排程度较理想。
3 结论
分别以氨水和NaOH为络合剂和沉淀剂,采用氢氧化物共沉淀法制备LiNi0.5MnO3,考察前驱体合成时过渡金属离子浓度、反应溶液pH值对材料性能的影响。当前驱体合成的反应溶液过渡金属离子浓度为1.5 mol/L、pH值为11.0时,制备的样品在2.2~4.9 V充放电,0.1C放电比容量为158.6 mAh/g,以0.2C循环20次,容量保持率为75.0%。
致谢:本项目得到张忠爱硕士的大力帮助,特此致谢。
[1] ZHOU Yi-feng(周艺峰),NIE Wang-yan(聂王焰),CHEN Chun-hua(陈春华),etal. 锂离子电池正极材料LiMn2O4的改性研究[J]. Functional Materials(功能材料),2006,37(9):1 381-1 385.
[2] Arrebola J C,Caballero A,Hernan L,etal. Expanding the rate capabilities of the LiNi0.5Mn1.5O4spinel by exploiting the synergistic effect between nano and microparticles[J]. Electrochem Solid-State Lett,2005,8(12):A641-A645.
[3] ZHAO Ling(赵玲),HAN En-shan(韩恩山),ZHU Ling-zhi(朱令之),etal. 前驱体合成条件对LiCo0.05Mn1.95O4性能的影响[J]. Battery Bimonthly(电池),2013,43(4):211-216.
[4] Xiang Y H,Yin Z L,Zhang Y H,et al. Effects of synthesis condition on the structural and electrochemical properties of the Li-rich material Li[Li0.2Ni0.17Co0.16Mn0.47]O2via the solid-state method[J]. Electrochim Acta,2013,91:214-218.
Effects of precursor synthesizing conditions to the performance of LiNi0.5MnO3
LIU Li-li,HAN En-shan,ZHU Ling-zhi,KOU Yan-juan
(SchoolofChemicalEngineeringandTechnology,HebeiUniversityofTechnology,Tianjin,300130,China)
Cathode material LiNi0.5MnO3for Li-ion battery was synthesized by hydroxide co-precipitation using NaOH as precipitating agent and ammonia as chelating agent,effects of transition metal ion concentration and pH values of reaction solution while precursor synthesizing to the electrochemical performance of product were discussed. The best synthetic process was as follows:the transition metal ion concentration was 1.5 mol/L and reaction solution pH value was 11.0. When product synthesized under this condition charged-discharged in 2.2~5.0 V,the 0.1Cspecific discharge capacity was 158.6 mAh/g and Columbic efficiency was 85.3%,after 20 cycles at 0.2C,the capacity retention rate was 75.0%.
LiNi0.5MnO3; co-precipitation method; Li-ion battery; electrochemical performance
刘丽丽(1989-),女,河北人,河北工业大学化工学院硕士生,研究方向:锂离子电池材料;
TM912.9
A
1001-1579(2015)06-0305-04
2015-06-12
韩恩山(1963-),男,山东人,河北工业大学化工学院教授,博士,研究方向:锂离子电池材料,本文联系人;
朱令之(1963-),女,山东人,河北工业大学化工学院副教授,博士,研究方向:锂离子电池材料;
寇艳娟(1989-),女,河北人,河北工业大学化工学院硕士生,研究方向:锂离子电池材料。

