宫颈癌中CSN6对E6AP的调节作用及其临床意义
王超 宋昱 郭奇桑 刘艳梅 高蜀君
(复旦大学附属妇产科医院妇科,*宫颈疾病诊疗中心,上海 200011)
·论著·
宫颈癌中CSN6对E6AP的调节作用及其临床意义
王超宋昱*郭奇桑*刘艳梅*高蜀君*
(复旦大学附属妇产科医院妇科,*宫颈疾病诊疗中心,上海200011)
摘要目的:探讨宫颈癌中组成型光形态发生因子9信号复合体亚单位6(constitutive photomorphogenesis 9 signalosome subunit 6,CSN6)对E6AP的调节作用。方法: 在癌症和肿瘤基因图谱(The Cancer Genome Atlas,TCGA)数据库中检索CSN6和E6AP基因,比较分析其相关性。采用质粒转染、蛋白质印迹(Western blotting)、四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)、流式细胞术等方法检测CSN6对E6AP表达及细胞生物学的影响。通过在裸鼠皮下接种不同CSN6表达状态的Hela细胞株建立动物模型,观察CSN6对肿瘤生长的影响。结果:数据库资料显示,CSN6和E6AP在肿瘤中有过表达和突变的现象。CSN6可以上调E6AP蛋白的表达,抑制CSN6的表达可以使E6AP表达下降,细胞增殖能力降低,细胞周期停滞于G0-G1期。动物实验显示,敲除CSN6可以显著抑制肿瘤生长,且肿瘤中E6AP蛋白表达水平下降,p53蛋白表达水平增加。结论:CSN6可以通过上调E6AP蛋白的表达而促进宫颈癌的发生发展。
关键词宫颈癌;人乳头瘤病毒;感染;组成型光形态发生因子9信号复合体;E6AP
宫颈癌是女性生殖系统三大常见恶性肿瘤之一,其发病率在女性所有恶性肿瘤中位居第四,在15~44岁年龄段的女性的恶性肿瘤中位居第二。2012年的数据统计显示,全世界每年新增宫颈癌病例数527 624例,死亡265 653例[1]。目前我国宫颈癌发病率高居世界第2位,仅次于智利,且发病呈年轻化趋势明显。
宫颈癌的发病与持续性的人乳头瘤病毒(human papilloma virus,HPV)感染关系密切[2-3]。至少15种HPV亚型被列入高危型HPV(high risk HPV,HR-HPV),可引起生殖道及非生殖道的恶性肿瘤,16和18型HPV在超过70%的宫颈癌中可被检测出[4-5]。HR-HPV E6和E7蛋白是其编码的主要癌蛋白。HR-HPV E6参与了多条凋亡通路的调控,其中最为经典的是E6通过E6AP介导的p53泛素化降解。E6AP作为泛素连接酶,可与E6和p53形成三聚体,从而特异性介导p53的泛素化降解,阻断凋亡信号的传递[6]。
组成型光形态发生因子9信号复合体(constitutive photomorphogenesis 9 signalosome,COP9 or CSN)是一种存在于真核细胞中的结构高度保守的多亚基蛋白复合体,与组成型光形态发生(constitutive photomorphogenesis,COP)现象密切相关[7]。CSN与26S蛋白酶体的19S“盖子”复合物具有同源性;19S“盖子”被认为具有识别泛素化底物并将其传送至蛋白水解核心复合物进行降解的功能[8];CSN被认为是连接信号传导和蛋白降解的分子平台[9],在调控多聚泛素链降解中具有重要的催化作用[10]。大量的研究[11-13]证明:CSN能通过调控细胞的分裂和分化、影响信号传导、活化细胞转化及调节DNA损伤应答等多种途径参与肿瘤的发生及发展;CSN的2个亚单位CSN5和CSN6在多种恶性肿瘤(例如乳腺癌[14]、肺癌[15-16]、甲状腺癌[17]等)中呈高表达且影响肿瘤的发生及发展。
CSN6可以抑制MDM2的自身泛素化,使其在细胞中稳定表达,持续发挥泛素化降解p53的作用,导致p53对细胞生长、凋亡和DNA修复的调控作用丢失,促进肿瘤形成[18]。有研究[19]证实,在宫颈癌中,MDM2-p53通路因HR-HPV E6的参与而特异性转换为E6-E6-AP-p53通路。但目前宫颈癌中E6AP的上游调节机制尚不明确,CSN6是否同样可以通过E6AP促进p53的降解,目前尚无相关报道,CSN6在宫颈癌中的作用也未见报道。因此,本研究探讨了CSN6在宫颈癌中的作用以及其对E6AP和p53的影响。
1资料与方法
1.1细胞和主要试剂HPV阳性细胞系(Hela和Caski)、HPV阴性细胞系(C33a)以及正常细胞(HEK-293T)购自美国标准生物品典藏中心(ATCC)。DMEM F12培养基(含10%胎牛血清)购自美国Gibco公司。MG132(C2211)购自美国Sigma公司。抗体来源如下:CSN6、 E6-AP购自瑞士ENZO life Sciences公司;p53、Flag(M2 monoclonal antibody)、Actin购自美国Sigma公司;Myc购自英国Abcam公司。Flag-CSN6和Myc-CSN6见参考文献[18]。shRNA-CSN6、N-CSN6(1-170 aa)、C-CSN6(160-327 aa)、CSN6(S60A)和CSN6(S60D)突变体的构建见参考文献[15,20-21]。
1.2shRNA-CSN6稳定细胞株的构建每60 mm细胞培养皿中铺入4×105个Hela细胞,18 h后进行细胞转染。重组慢病毒质粒GIPZ12-pshRNA-CSN6和阴性对照质粒转染采用Lipofectamine TM 2000转染试剂,用2 μg/mL嘌呤霉素(puromycin)进行筛选,每隔48 h更换一次新鲜培养基,维持puromycin的浓度,持续培养至14 d左右可形成细胞克隆,挑选克隆进行扩大培养,以备后续实验使用。
1.3蛋白质印迹(Western blotting)和免疫共沉淀法吸净培养液,用磷酸盐缓冲液(phospahate buffered saline,PBS)小心漂洗2次,加入预冷的含有蛋白酶/磷酸化酶抑制剂的1×裂解缓冲液[0.5L 1×裂解缓冲液组成成分:7.5 g 1 mol/L Tris(美国Fisher公司),15 mL 5 mol/L NaCl(美国Fisher公司),0.5 mL NP-40(美国USB Corp公司),0.5 mL TritonX-100(美国Sigma公司)和1 mL 0.5 mol/L乙二胺四乙酸(美国Fisher公司)。蛋白酶/磷酸化酶抑制剂组分:5 mmol/L矾酸钠(NaV),1 mmol/L氟化钠(NaF),1 μmol/L 二硫苏糖醇(DTT),0.1 mg/mL胃蛋白酶抑制剂(Pepstatin)A,1 mmol/L苯甲基磺酰氟(phenylmethylsulfonyl fluoride)和1000×全蛋白酶抑制剂混合物(瑞士Roche公司)], 于4 ℃或冰上放置20 min裂解细胞,4 ℃以13 000 r/min离心15 min。将离心后的上清液分为2份:1份加入6×十二烷基硫酸钠(sodium dodecyl sulfate,SDS)样品缓冲液,混匀后于100 ℃煮沸10 min,作为总细胞裂解液于-20 ℃保存;另1份用于免疫沉淀,1 mL细胞裂解液加入10 μL Protein A/G琼脂糖珠,于4 ℃共振1 h,以10 000 r/min离心10 min,取上清备用,将琼脂糖珠分别与目的抗体、IgG抗体(阴性对照)混合并加入上面的上清液中,混匀器匀速旋转(4 ℃过夜);将免疫沉淀后的溶液于4 ℃以3000 r/min离心3 min,去上清液,用1×裂解缓冲液洗涤琼脂糖珠,离心后弃上清液,共洗涤3次。将1×裂解缓冲液与6×SDS样品缓冲液混合,于100 ℃煮沸10 min,作为免疫共沉淀样本。最后将总细胞裂解液和免疫共沉淀样本等量上样于10%聚丙烯酰胺凝胶并电泳,电泳完毕后将蛋白转移至聚偏氟乙烯膜,用5%牛血清白蛋白封闭1 h,加入一抗后4 ℃反应过夜。第2天洗膜后加入辣根过氧化物酶标记的二抗,室温孵育1 h,用电化学发光法检测。
1.4细胞增殖测定采用四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)法检测细胞生长速率。按照每孔3×103个细胞的密度接种到96孔板,在37 ℃、CO2体积分数为5%的培养箱中培养。培养第1、2、3天后,分别将20 μ LMTT加入各孔中并继续培养2 h,然后每孔加入二甲基亚砜100 μL,在570 nm波长处检测。
1.5流式细胞术检测细胞周期抑制CSN6表达48 h后,消化并收集细胞,调整细胞浓度为1×106/L,加入490 μL工作浓度的结合缓冲液,振荡混匀细胞,同时加入5 μL Annexin V-FITC和5 μL碘化吡啶(propidium iodide,PI),室温下避光染色20 min后用流式细胞仪进行双参数分析,测定subG1率。用于检测细胞周期的标本用70%乙醇固定后再用流式细胞仪检测。
1.6动物模型选取4~5周龄雌性BALB/c裸鼠10只,来自德克萨斯MD安德森肿瘤中心动物饲养中心。将10只裸鼠随机分为实验组和对照组,各5只。实验组裸鼠皮下接种shRNA-CSN6稳定细胞株(1×106个细胞重悬于0.1 mL PBS),对照组接种与实验组等量的shRNA-VECTOR稳定细胞株。自接种第5天起,每周测量肿瘤体积3次,直至裸鼠接受安乐死。
2结果
2.1在临床宫颈癌患者中CSN6及E6AP的mRNA表达情况及与主要分子蛋白的相关性在http://www.cbioportal.org网站的癌症和肿瘤基因图谱(The Cancer Genome Atlas,TCGA)数据库里检索CSN6和E6AP基因,结果发现,CSN6在大多数肿瘤中呈过表达(红色),见图1;而E6AP多以突变为主,见图2。在宫颈鳞状上皮癌和颈管内腺癌(cervical squamous cell carcinoma and endocervical adenocarcinoma,CESC)中发现,CSN6(基因名称为COPS6)和E6AP(基因名称为UBE3A)主要表现为mRNA水平的扩增,COPS6在宫颈癌中无突变,UBE3A有3%的突变,二者在宫颈鳞状细胞癌和CESC中的表达呈负相关(pearson相关系数为-0.327,P<0.05),见图3。从TCGA上下载所有CESC患者的CSN6和E6AP的mRNA水平信息,共253例患者,采用Prism 6.0t-test检验COPS6低水平组和高水平组的UBE3A表达差异,COPS6低水平组的UBE3A表达水平明显高于COPS6高水平组(P<0.01),见图4。同时下载所有CESC患者的反时相蛋白的阵列(reverse-phase protein lysate array,RPPA)数据,共155例患者,根据患者的序列号合并患者的COPS6、UBE3A及RPPA数据,运用R语言分别计算CSN6和E6AP与192种蛋白分子的相关性,COPS6与smad1、smad3、smad4、src-pY416、src-pY527、src、STAT3、STAT5、Stathmin蛋白分子水平呈负相关(P<0.05,见图5),而UBE3A与192种蛋白分子没有明显相关性。

图1 TCGA数据库中CSN6 基因在肿瘤中的表达情况
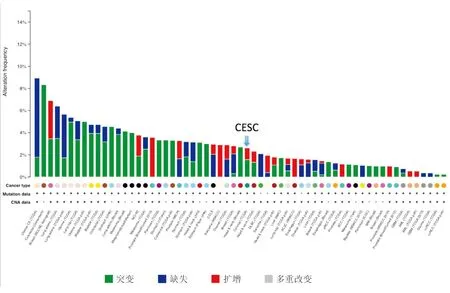
图2 TCGA数据库中E6AP基因在肿瘤中的表达情况
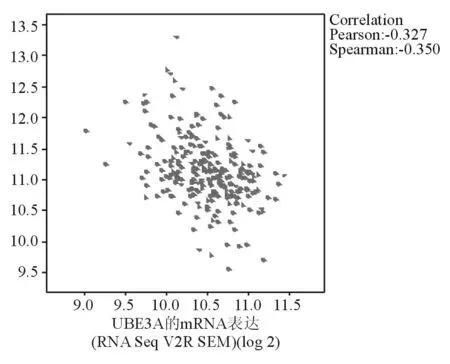
图3 TCGA数据库中CSN6与E6AP基因表达的相关性

图4 TCGA数据库中253例CESC患者的

图5 TCGA数据库中CSN6 mRNA水平与RPPA中9种蛋白分子表达的相关性
2.2CSN6对E6AP表达的调节
2.2.1CSN6可与E6AP相互结合前述分析表明,CSN6和E6AP存在相关性。免疫共沉淀结果发现,宫颈癌Hela细胞株内的CSN6蛋白可以和E6AP蛋白结合,见图6。抑制CSN6的表达后,E6AP的表达减少,见图7。

(IP:免疫共沉淀;IB:免疫印迹;WCL:全细胞裂解液)
2.2.2CSN6对E6AP的调节依赖HPV的感染为进一步了解CSN6与E6AP的相关性,用myc-CSN6质粒转染了4株宫颈癌细胞系:Hela和Caski
(合并HR-HPV感染),C33A(不合并HR-HPV感染,伴有p53突变)和人胚胎源肾上皮细胞株HEK-293T。结果显示,HPV阳性细胞中,随着外源性CSN6表达增加,E6AP表达水平呈剂量依赖性递增;而在HPV阴性细胞中则无此现象;见图8。

图7 CSN6敲除对E6AP蛋白表达的影响

图8 4种细胞系中过表达CSN6对E6AP蛋白表达的影响
2.3抑制CSN6后细胞增殖能力下降、凋亡增加MTT结果显示,转染shRNA-CSN6的Hela细胞的增殖能力明显低于对照组,见图9。流式细胞术检测结果显示,CSN6的敲除增加了细胞的凋亡率并促进细胞G0-G1期的停滞,见图10a~10c。
2.4下调CSN6的表达可抑制肿瘤生长为进一步证实CSN6在宫颈癌中的作用,分别用感染CSN6 shRNA的Hela细胞和转染对照空载体的Hela细胞接种裸鼠,观察肿瘤的生长情况。结果显示,CSN6敲除组肿瘤生长受到显著抑制。Western blotting证实CSN6的敲除不仅降低E6AP蛋白表达水平,同时增加了p53蛋白表达水平,见图11a、11b。

图9 抑制CSN6对细胞增殖能力的影响(MTT)
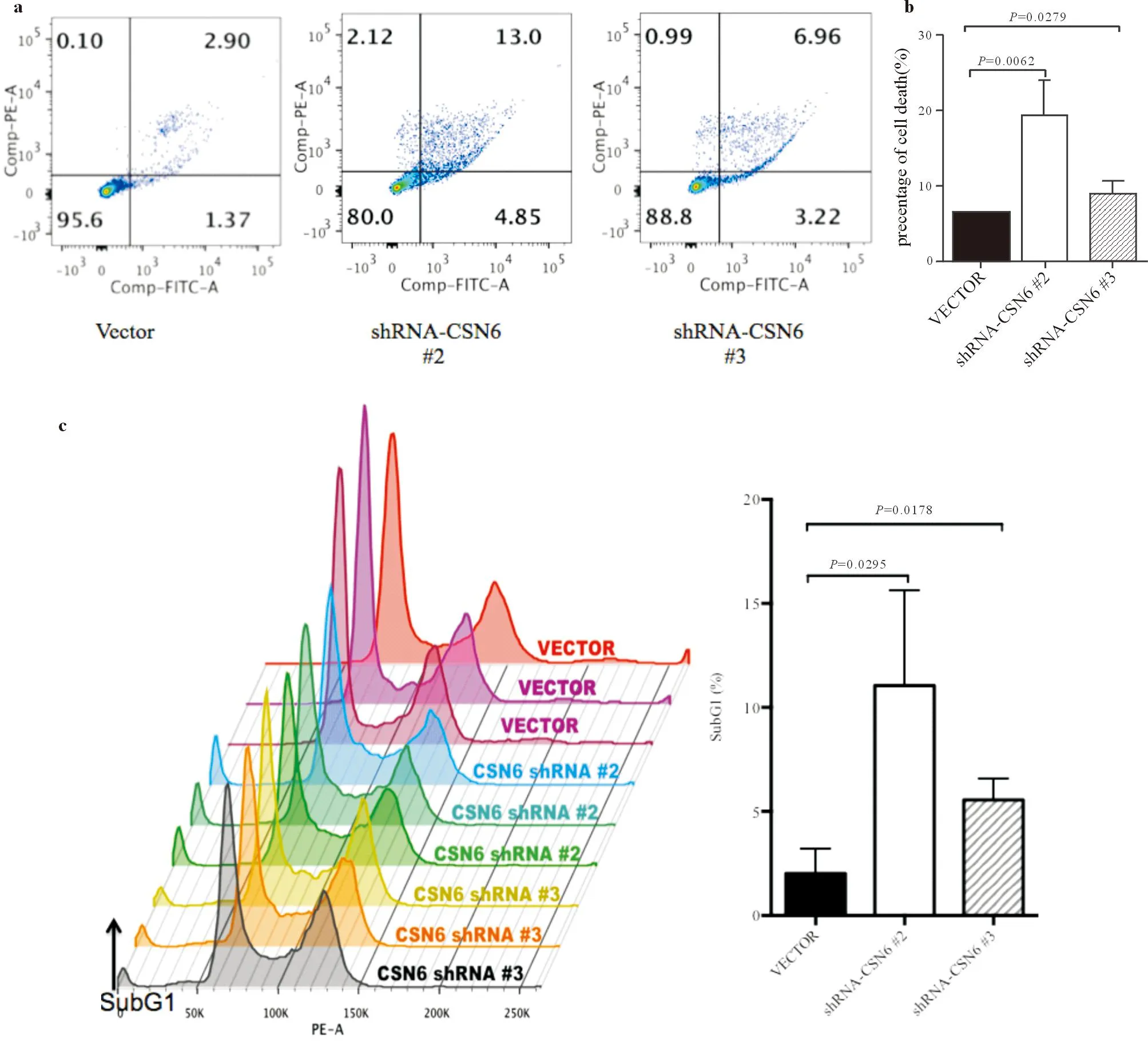
a:抑制CSN6可促进细胞凋亡并促进细胞G0-G1期停滞(左下象限代表存活细胞,左上象限代表坏死细胞,右下象限代表早期凋亡细胞,右上象限代表晚期凋亡细胞);b:为a的统计柱状图;c:抑制CSN6促进细胞G0-G1期停滞
图10流式细胞术检测结果
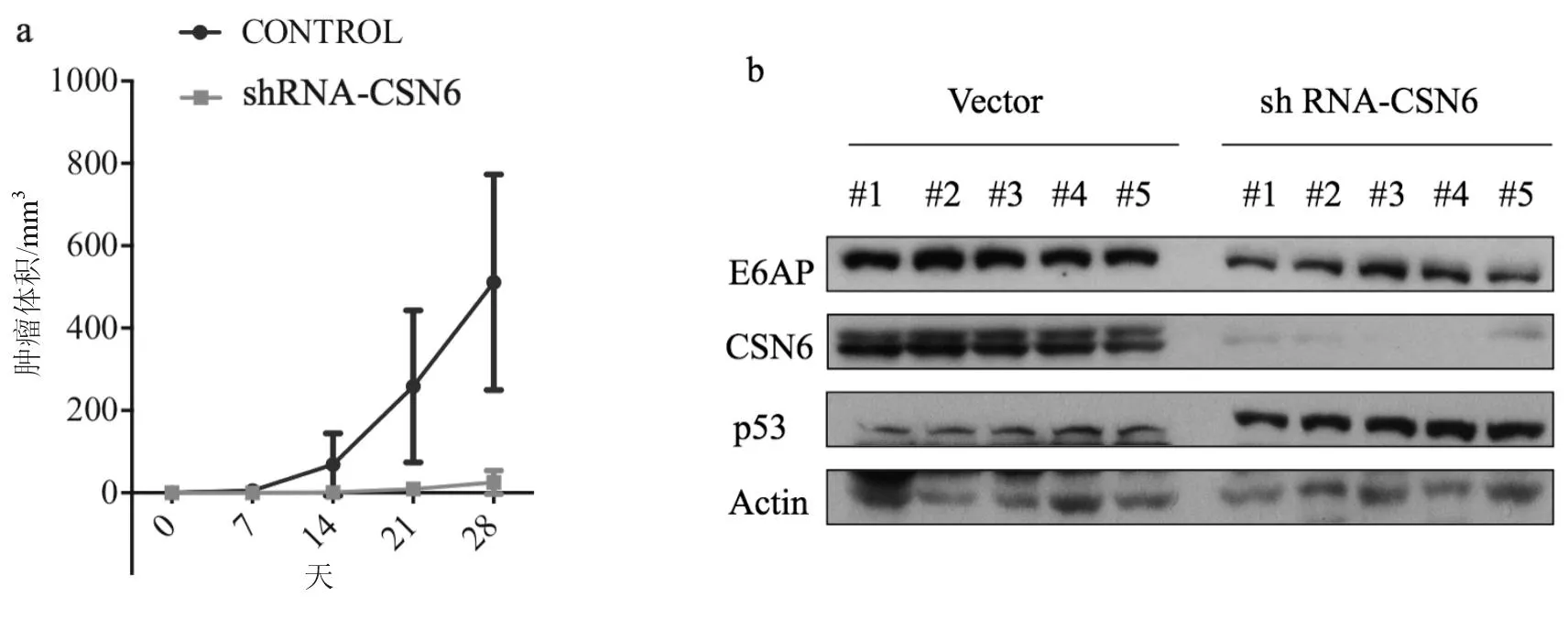
a:宫颈癌移植成瘤实验;b:Western blotting结果显示,抑制CSN6可减少E6AP蛋白的表达水平,增加p53蛋白的表达水平,(#1~ #5分别为实验组和实验对照组和编号1~5 裸鼠)
图11下调CSN6抑制肿瘤生长
3讨论
目前认为,HPV的E6、E7蛋白是与宫颈癌关系最密切的2个癌蛋白,对E6、E7蛋白作用机制的研究有望为宫颈癌的靶向治疗提供一定的理论依据。既往研究[22]证实,E6、E7蛋白均可以阻断凋亡通路,实现细胞的永生化,而且E6的抗凋亡作用被认为与p53/PUMA/Bax通路密不可分。E6AP介导了E6对p53的泛素化降解过程,预示着对E6AP的调节可能会成为宫颈癌靶向治疗的目标。本研究发现,与26S蛋白酶体的19S“盖子”复合物具有同源性的CSN6可以正向调节HPV阳性细胞的E6AP水平,而对HPV阴性细胞没有影响。CSN6表达水平越高,E6AP在细胞中越稳定,降低CSN6表达水平可增加E6AP蛋白的水解,因此,体外细胞实验结果提示CSN6在蛋白水平上正向调节E6AP。这似乎与临床患者中的mRNA水平分析结果不相吻合,253例宫颈癌患者的COPS6和UBE3A mRNA表达水平呈负相关。可能原因有:(1)细胞实验结果显示HPV阳性情况下CSN6正向调节E6AP,但253例患者中绝大多数未提供HPV是否感染的信息,仅少数注明HPV16或18型感染。因此,体外细胞实验得出的结论并不适用于这253例患者;(2)体外实验从蛋白水平进行研究,而临床数据来自mRNA水平,由于体内mRNA和蛋白表达调控的复杂性,二者不存在可比性。
p53是迄今为止发现的与肿瘤相关性最强的基因之一,在细胞周期调控、抑制细胞生长、诱导肿瘤细胞凋亡等方面有重要作用。既往研究证实,CSN6可以通过多种途径调节p53。例如有关CSN6-MDM2轴,研究[16,18]发现,人乳腺癌组织中CSN6与MDM2的表达呈正相关,CSN6与MDM2直接作用,作用的位点为MDM2的294-384aa,而MDM2自我泛素化的位点为赖氨酸364(位于MDM2与CSN6相互作用的区域内)。CSN6通过抑制MDM2的泛素化,增强MDM2的稳定性,导致p53的降解。此外,还有CSN6-14-3-3ó-Akt轴。14-3-3ó蛋白作为一种潜在的肿瘤抑制因子,是p53的下游靶点,可以负性调节Akt[23-24]。 研究[21]发现,CSN6能够通过稳定COP1而介导14-3-3ó蛋白的泛素化降解,从而减少14-3-3ó蛋白对p53稳定性的正向作用,该功能与MDM2无关。此外,14-3-3ó蛋白的减少可激活Akt蛋白,激活的Akt通过磷酸化MDM2的丝氨酸166和186位点使其磷酸化,从而经MDM2途径增强p53的泛素化和降解,促进细胞增殖。Xue等[15]还发现,Akt激酶可以磷酸化CSN6的丝氨酸60位点而使CSN6磷酸化,以减少泛素介导的CSN6降解,从而增加CSN6的稳态表达,进一步导致p53降解。本研究发现,除了以上途径之外,CSN6还可以通过E6AP起到调节p53的作用。E6AP是泛素连接酶(ubiquitin-ligase enzyme,E3)的HECT结构域家族成员。HPV E6蛋白与E6AP结合后将活化的泛素转移到p53蛋白上,最终p53蛋白在26S蛋白酶体的作用下沿泛素化降解途径降解。CSN有8个亚单位,CSN1、2、3、4、7及8的C端均具有高度保守的PCI域(COP9蛋白酶体启动因子),该结构有助于CSN各亚基间的相互结合以共同构建CSN复合体;而CSN5和CSN6的N端均具有高度保守的MPN域(Mpr1p-Pad1p的N端),该结构域对于CSN发挥促进肿瘤细胞增殖的作用非常重要[25-28]。 早期关于拟南芥的遗传学研究[26]表明,CSN6的MPN结构域对于构建CSN必不可少。本研究结果显示,在HPV阳性细胞系中,CSN6的过表达增加了E6AP蛋白的表达水平;而且shCSN6组p53蛋白表达水平较对照组明显增加,这也对应了动物实验中shCSN6组裸鼠的肿瘤生长明显较对照组缓慢的现象。
本研究发现,在宫颈癌中CSN6对E6AP有正向调节作用,从而降低p53的稳定性,这与宫颈癌的发生发展密切相关。有关CSN6的作用机制值得进一步研究,例如前面提到的CSN6与smad、STAT等的相关性。
参考文献
[1]Parkin DM.The global health burden of infection-associated cancers in the year 2002[J].Int J Cancer,2006,118(12):3030-3044.
[2]zur Hausen H.Papillomaviruses and cancer:from basic studies to clinical application[J].Nat Rev Cancer,2002,2(5):342-350.
[3]Bosch FX,de Sanjosé S.Chapter 1:Human papillomavirus and cervical cancer--burden and assessment of causality[J].J Natl Cancer Inst Monogr,2003,(31):3-13.
[5]Bernard HU,Burk RD,Chen Z,et al.Classification of papillomaviruses(PVs) based on 189 PV types and proposal of taxonomic amendments[J].Virology,2010,401(1):70-79.
[6]Scheffner M,Huibregtse JM,Vierstra RD,et al.The HPV-16 E6 and E6-AP complex functions as a ubiquitin-protein ligase in the ubiquitination of p53[J].Cell,1993,75(3):495-505.
[7]Wei N,Chamovitz DA,Deng XW.Arabidopsis COP9 is a component of a novel signaling complex mediating light control of development[J].Cell,1994,78(1):117-124.
[8]Li L,Deng XW.The COP9 signalosome:an alternative lid for the 26S proteasome?[J].Trends Cell Biol,2003,13(10): 507-509.
[9]Wei N,Deng XW.The COP9 signalosome[J].Annu Rev Cell Dev Biol,2003,19:261-286.
[10]Lee MH,Zhao R, Phan L,et al.Roles of COP9 signalosome in cancer[J].Cell Cycle,2011,10(18): 3057-3066.
[11]Duan W,Gao L,Wu X,et al.Differential response between the p53 ubiquitin-protein ligases Pirh2 and MdM2 following DNA damage in human cancer cells[J].Exp Cell Res,2006,312(17):3370-3378.
[12]Hetfeld BK,Peth A,Sun XM,et al.The COP9 signalosome-mediated deneddylation is stimulated by caspases during apoptosis[J].Apoptosis,2008,13(2):187-195.
[13]Richardson KS,Zundel W.The emerging role of the COP9 signalosome in cancer[J].Mol Cancer Res,2005,3(12): 645-653.
[14]Wang W,Tang M,Zhang L,et al.Clinical implications of CSN6 protein expression and correlation with mutant-type P53 protein in breast cancer[J].Jpn J Clin Oncol,2013,43(12):1170-1176.
[15]Xue Y,Chen J,Choi HH,et al.HER2-Akt signaling in regulating COP9 signalsome subunit 6 and p53[J].Cell Cycle,2012,11(22):4181-4190.
[16]Iyer SV, Iwakuma T. A novel link between the HER2-Akt and MDM2-p53 pathways via CSN6[J].Cell Cycle,2012,11(22): 4112.
[17]Birol M,Echalier A.Structure and function of MPN(Mpr1/Pad1 N-terminal) domain-containing proteins[J].Curr Protein Pept Sci,2014,15(5):504-517.
[18]Zhao R,Yeung SC,Chen J,et al.Subunit 6 of the COP9 signalosome promotes tumorigenesis in mice through stabilization of MDM2 and is upregulated in human cancers[J].J Clin Invest,2011,121(3):851-865.
[19]Hengstermann A,Linares LK,Ciechanover A,et al.Complete switch from Mdm2 to human papillomavirus E6-mediated degradation of p53 in cervical cancer cells[J].Proc Natl Acad Sci U S A,2001,98(3):1218-1223.
[20]Chen B,Zhao R,Su CH,et al.CDK inhibitor p57(Kip2) is negatively regulated by COP9 signalosome subunit 6[J].Cell Cycle,2012,11(24): 4633-4641.
[21]Choi HH,Gully C,Su CH,et al.COP9 signalosome subunit 6 stabilizes COP1,which functions as an E3 ubiquitin ligase for 14-3-3σ[J].Oncogene,2011,30(48):4791-4801.
[22]Vogt M,Butz K,Dymalla S,et al.Inhibition of Bax activity is crucial for the antiapoptotic function of the human papillomavirus E6 oncoprotein[J].Oncogene,2006,25(29):4009-4015.
[23]Lee MH,Lozano G.Regulation of the p53-MDM2 pathway by 14-3-3 sigma and other proteins[J].Semin Cancer Biol,2006,16(3):225-234.
[24]Yang H,Wen YY,Zhao R,et al.DNA damage-induced protein 14-3-3 sigma inhibits protein kinase B/Akt activation and suppresses Akt-activated cancer[J].Cancer Res,2006,66(6):3096-3105.
[25]Sharon M,Mao H,Boeri Erba E,et al.Symmetrical modularity of the COP9 signalosome complex suggests its multifunctionality[J].Structure,2009,17(1):31-40.
[26]Kotiguda GG,Weinberg D,Dessau M,et al.The organization of a CSN5-containing subcomplex of the COP9 signalosome[J].J Biol Chem,2012,287(50):42031-42041.
[27]Gusmaroli G,Figueroa P,Serino G,et al.Role of the MPN subunits in COP9 signalosome assembly and activity,and their regulatory interaction with Arabidopsis Cullin3-based E3 ligases[J].Plant Cell,2007,19(2):564-581.
[28]Zhang H,Gao ZQ,Wang WJ,et al.The crystal structure of the MPN domain from the COP9 signalosome subunit CSN6[J].FEBS Lett,2012,586(8):1147-1153.
Regulatory Effect of Constitutive Photomorphogenesis 9 Signalosome Subunit 6 on E6AP in Cervical Cancer and Its Clinical Significance
WANGChaoSONGYu*GUOQisang*LIUYanmei*GAOShujun*DepartmentofGynecology,*MedicalCenterofDiagnosisandTreatmentforCervicalDiseases,ObstetricsandGynecologyHospitalofFudanUniversity,Shanghai200011,China
AbstractObjective:To explore the role of constitutive photomorphogenesis 9 signalosome subunit 6(CSN6) in the regulation of E6AP in cervical cancer. Methods:CSN6 and E6AP genes were retrieved from The Cancer Genome Atlas(TCGA), and the correlation between them was analyzed. The effect of CSN6 on expression of E6AP and cytobiology was determined with transfection of plasmids and Western blotting,methyl thiazolyl tetrazolium(MTT) and flow cytometry(FCM).Nude mice were subcutaneously injected with Hela cell strains with different expression levels of CSN6, so as to set up the animal model. And the effect of CSN6 on growth of tumors was observed. Results: The database showed the overexpression and the mutation of CSN6 and E6AP in cancer. CSN6 could up-regulate the expression of E6AP. The inhibition on CSN6 could decrease the expression level of E6AP and the proliferation of cells, and induce the G0-G1 arrest.Animal expreiment showed that knock-out of CSN6 significantly inhibited the tumor growth, decreasing E6AP level and increasing p53 level. Conclusions: CSN6 could contribute to the occurrence and progression of cervical cancer by up-regulating the expression of E6AP.
Key WordsCervical cancer;Human papilloma virus;Infection;Constitutive photomorphogenesis 9 signalosome;E6AP
通讯作者高蜀君,E-mail:shujun99@163.com
基金项目:上海市科学技术委员会自然科学基金资助项目(编号:12ZR1403800)
中图分类号R 737.33
文献标识码A

