绿色木霉与黑曲霉混合发酵产纤维素酶的研究
姜伯玲,王曙阳 *,李文建,董妙音,陈积红,刘 敬,胡 伟
(1. 中国科学院近代物理研究所,甘肃 兰州 730000;2.中国科学院大学,北京 100049)
纤维素酶是一类能够将纤维素降解为葡萄糖的多组分酶系的总称,它们协同作用,分解纤维素产生寡糖和纤维二糖,最终水解为葡萄糖[1-2]。一般按照其催化功能可分为3大类:外切-β-1,4-葡聚糖酶(exo-l,4-β-D-glucanase,CBH)E.C.3.2.1.4、内切-β-1,4-葡聚糖酶(endo-1,4-β-D-glucanase,EG)E.C.3.2.1.91及β-葡萄糖苷酶(β-D-1,4-glucosidase,β-GA)E.C.3.2.1.21。天然纤维的组成和结构不同,3种酶必须同时参与才能将纤维素晶体降解为简单糖类[3-5]。
目前,纤维素酶在食品、纺织、畜牧业、医药工业、生物质能源开发及工农业废弃物回收等方面已广泛应用[6-8],市场对纤维素酶的需求量日益增加。能分泌纤维素酶的微生物是纤维素酶的主要来源,主要有真菌、细菌、放线菌和一些原生动物等[9-10]。真菌类的木霉属(Trichoderma)、曲霉属(Aspergillus)能产生3类纤维素酶且是胞外酶,降解纤维素的能力较强,因此是人们研究纤维素酶的热点领域。但应用研究发现,单菌发酵所产的纤维素酶存在酶系不完整和个别酶活低的缺陷,如绿色木霉及其近缘菌株发酵产内切葡聚糖酶活力较高,但所产的纤维素酶中普遍存在β-葡萄糖苷酶(β-GA)活力低的缺陷,而黑曲霉产β-葡萄糖苷酶能力较高,产内切和外切葡聚糖酶能力较低[11-13]。纤维素酶活高低是影响纤维素酶降解纤维素能力的一个重要指标,而纤维素酶系组分配比的合理性也是不可忽视的一个影响因素。DUFF S J B等[14-15]报道,β-GA与滤纸酶活力(filter paper activity,FPA)的比值在0.12~1.50范围内时,纤维素酶系完整,组分配比合理,可以有效降解天然纤维素。因此,开发产纤维素酶活高、酶系全、酶组分配比合理的多菌混合发酵在降低纤维素酶生产成本、提高纤维素酶降解能力等方面有重要意义[16]。
本研究利用绿色木霉与黑曲霉混合发酵生产纤维素酶,研究了绿色木霉与黑曲霉单独发酵及混合发酵产纤维素酶酶活的特点,优化黑曲霉的接种时间及混合发酵时间,使混合发酵所产纤维素酶系完整、降解纤维素能力增强,从而降低生产成本,利于工业生产。
1 材料与方法
1.1 材料与试剂
1.1.1 试验菌株
绿色木霉(Trichoderma viride)GSTCC 62010(NM01)、黑曲霉(Aspergillus niger)GSTCC 60108(NH01):甘肃省微生物菌种保藏中心;绿色木霉NMy及黑曲霉NHy由绿色木霉NM01、黑曲霉NH01混合发酵选育得到;黑曲霉NH11-1是黑曲霉NH01通过重离子辐照选育得到;选育得到的菌株均保存于中国科学院近代物理研究所微生物实验室。
1.1.2 主要试剂
羧甲基纤维素钠(carboxymethylatedcellulose,CMC-Na):天津市北辰方正试剂厂;微晶纤维素、水杨苷:加拿大Bio Basic股份有限公司;3,5-二硝基水杨酸(dinitrosalicylic acid,DNS):上海中秦化学试剂有限公司;琼脂:北京索莱宝科技有限公司。以上试剂均为分析纯。
1.1.3 培养基
(1)斜面培养基:马铃薯200 g,琼脂20 g,蔗糖20 g,水1 000 mL,pH自然,121 ℃灭菌30 min。
(2)种子培养基:CMC-Na 7.5 g,蛋白胨5.0 g,吐温-80 2.0 mL,MgSO4·7H2O 0.3 g,CaCl20.3 g,FeSO4·7H2O 0.005 g,MnSO4·H2O 0.001 6 g,ZnSO4·7H2O 0.001 4 g,CoCl20.002 g,蒸馏水1 000 mL,pH自然,121 ℃灭菌30 min。
(3)发酵培养基:CMC-Na 7.5 g,吐温-80 2.0 mL,(NH4)2SO41.4g,K2HPO42.0g,MgSO4·7H2O0.3g,CaCl20.3 g,FeSO4·7H2O 0.005 g,MnSO4·H2O 0.001 6 g,ZnSO4·7H2O 0.001 4 g,CoCl20.002 g,蒸馏水1 000 mL,pH自然,121 ℃灭菌30 min。
1.2 仪器与设备
SP-756PC型紫外可见分光光度计:上海光谱仪器有限公司;HZQ-X300型恒温振荡器、DHP-9082型电热恒温培养箱:上海一恒科学仪器有限公司;LDZX-50KBS型立式压力蒸汽灭菌器:上海申安医疗器械厂;TDZ5-WS型多管架自动平衡离心机:湘仪离心机仪器有限公司。
1.3 试验方法
1.3.1 绿色木霉和黑曲霉单独发酵培养方法
将4 ℃冰箱保存的绿色木霉NM01、NMy与黑曲霉NHy、NH11-1分别接种于新鲜的斜面培养基上,30 ℃恒温培养3 d,用无菌生理盐水洗下斜面孢子,利用血球计数板计数,控制孢子浓度为1×107个/mL,接种孢子悬液于种子培养基,30 ℃、200 r/min恒温振荡培养12 h。将种子培养基按5%的接种量接种至发酵培养基,30 ℃、200 r/min振荡培养5 d,取发酵液待测。
1.3.2 绿色木霉与黑曲霉混合发酵培养方法
将1.3.1中的种子培养基按绿色木霉NM01∶黑曲霉(NHy、NH11-1)=5∶1(V/V)的接种比例接种于发酵培养基,使绿色木霉NM01分别与黑曲霉NHy、NH11-1进行混合发酵,30 ℃、200 r/min恒温振荡培养5 d,取发酵液待测。
1.3.3 混合发酵中黑曲霉NH11-1接种时间的优化
将1.3.1中的绿色木霉NM01种子培养基按5%的接种量接种至发酵培养基,黑曲霉NH11-1种子培养基分别推迟24 h、48 h、72 h接种至绿色木霉NM01发酵培养基中,绿色木霉NM01与黑曲霉NH11-1的接种比例仍为5∶1(V/V),30 ℃、200 r/min振荡培养5 d,取发酵液待测。
1.3.4 纤维素酶活力和β-GA的测定
发酵液在20 ℃、4 000 r/min下离心10 min,取上清液即得粗酶液。FPA与β-GA的测定见参考文献[17]。一个滤纸酶活力和一个β-葡萄糖苷酶活力单位均定义为:在标准反应条件下每分钟生成1 μg葡萄糖所需的酶量(U/mL)。
1.3.5 总还原糖含量的测定
还原糖含量采用DNS方法进行测定,1.3.4中得到的粗酶液与相应底物反应后,添加3 mL DNS溶液,沸水浴中反应5 min,冷却至室温后,于波长520 nm处检测其吸光度值,根据葡萄糖标准曲线回归方程计算还原糖含量。
2 结果与分析
2.1 绿色木霉、黑曲霉单独发酵培养对产纤维素酶活的影响
绿色木霉NM01、NMy及黑曲霉NH11-1、NHy单独发酵5 d时,取样进行FPA与β-GA的检测,结果如图1所示。
由图1可知,绿色木霉NM01的FPA(204.60 U/mL)极显著(P<0.01)高于其他3个菌株;而黑曲霉NH11-1及NHy的β-GA分别为339.38 U/mL、333.67 U/mL,极显著(P<0.01)高于2株绿色木霉,而黑曲霉NH11-1的β-GA(339.38 U/mL)与NHy1的β-GA(333.67 U/mL)之间没有显著差异,这符合黑曲霉产纤维素酶的特点,即黑曲霉产β-葡萄糖苷酶的能力较强,但是产外切葡聚糖酶的能力较弱,致使纤维素酶的总体酶活不高;而绿色木霉存在β-葡萄糖苷酶酶活较低的缺陷,使得其所产的纤维素酶酶系结构不合理。此结果可作为混合发酵产纤维素酶的依据,即将FPA较高的绿色木霉NM01分别与β-GA较高的黑曲霉NH11-1及NHy进行混合发酵。
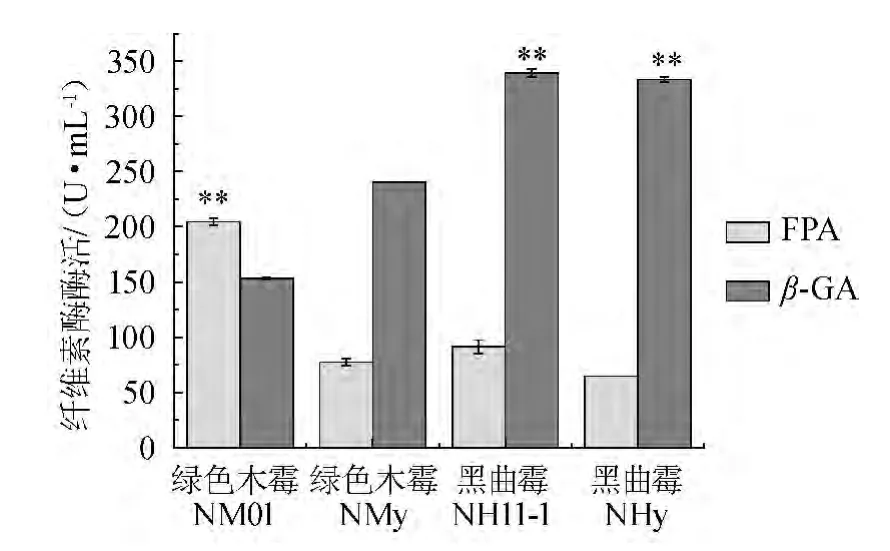
图1 绿色木霉、黑曲霉发酵培养对产纤维素酶酶活的影响Fig.1 Effect of fermentation by Aspergillus niger and Trichoderma viride on cellulase activities
2.2 菌株混合发酵培养对产纤维素酶酶活的影响
绿色木霉NM01分别与黑曲霉NH11-1、NHy混合(5∶1)发酵培养对产纤维素酶酶活的影响结果如图2所示。

图2 两菌株混合发酵培养对产纤维素酶酶活的影响Fig.2 Effect of mixed-culture fermentation by Aspergillus niger and Trichoderma viride on cellulase activities
由图2可知,绿色木霉NM01与黑曲霉NH11-1混合发酵的FPA与β-GA分别为239.59 U/mL和512.88 U/mL,2种酶活极显著(P<0.01)高于绿色木霉NM01与黑曲霉NHy混合发酵的FPA与β-GA相应酶活(65.82 U/mL,130.06 U/mL)。与绿色木霉NM01、黑曲霉NH11-1及NHy单独发酵相比混合发酵产β-GA效果具有明显优势,而所产的FPA没有明显提高。绿色木霉NM01与黑曲霉NH11-1混合发酵所产纤维素酶中β-GA与FPA的比值为2.14,超出0.12~1.50的范围,所以需要对黑曲霉NH11-1的接种时间进行优化,控制其所产纤维素酶活的大小,从而使β-GA与FPA的比值在0.12~1.50范围内。
2.3 混合发酵中黑曲霉NH11-1接种时间的优化
β-GA与FPA的比值在0.12~1.50范围内时,纤维素酶水解纤维素的能力较强,而且针对不同的底物有最适的比值。从理论上来讲,β-葡萄糖苷酶水解纤维二糖,从而减弱纤维二糖对酶解过程的抑制,提高酶解效率,所以在范围内其比值较大时酶解效果较好。黑曲霉NH11-1延迟接种时间对产纤维素酶酶活的影响结果见表1。

表1 黑曲霉NH11-1延迟接种时间对产纤维素酶酶活的影响Table 1 Effect of delayed inoculation time of Aspergillus niger NH11-1 on cellulase activities
由表1可知,以绿色木霉NM01和黑曲霉NH11-1单独发酵作为对照,当黑曲霉NH11-1与绿色木霉NM01混合接入培养基时,所得到的β-GA均明显高于绿色木霉NM01和黑曲霉NH11-1单独发酵所得到β-GA(153.19 U/mL、339.38 U/mL),但所得到的FPA没有明显高于绿色木霉NM01单独发酵所得到的FPA(204.60 U/mL)。说明黑曲霉NH11-1与绿色木霉NM01混合接种进行发酵时以黑曲霉NH11-1产β-葡萄糖苷酶为主,以绿色木霉NM01产纤维素酶为辅,而且β-GA与FPA的比值为2.14,超出0.12~1.50的范围,即此时纤维素酶对天然纤维素的降解能力不是很强。
黑曲霉NH11-1推迟24 h接种后发酵第5天的FPA最低(101.61U/mL),β-GA与FPA的比值为2.86,即黑曲霉NH11-1与绿色木霉NM01之间未形成协同作用,而是成了绿色木霉NM01产纤维素酶的干扰因素。黑曲霉NH11-1推迟72 h接种的β-GA与FPA的比值为1.51,说明以黑曲霉NH11-1产β-GA为主,其β-GA与FPA的比值与推迟24 h接种的混合发酵组均超出0.12~1.50的范围,即纤维素酶系不满足水解纤维素的最佳条件。
黑曲霉NH11-1推迟48 h接种后发酵第5天的β-GA与FPA的比值为1.22,表明纤维素酶系完整,纤维素酶各组分配比合理,且FPA和β-GA较高,满足其对纤维素进行完全水解的条件,说明此过程以绿色木霉产纤维素酶为主,而黑曲霉NH11-1起辅助协同作用。此结果不同于高星星等的报道[18],即黑曲霉推迟接种48 h与里氏木霉混合发酵产酶效果最佳,可能与所使用菌种、培养基碳源等条件有关。
2.4 发酵时间对混合发酵产纤维素酶酶活的影响
黑曲霉NH11-1推迟48 h接种与绿色木霉NM01混合发酵时间对产纤维素酶酶活的影响结果如图3所示。

图3 发酵时间对混合发酵产纤维素酶酶活的影响Fig.3 Effect of mixed-culture fermentation time on cellulase activity
由图3可知,在混合发酵第2~4天,FPA显著下降,β-GA呈上升趋势,说明黑曲霉NH11-1接种至绿色木霉NM01发酵瓶中后在初始阶段迅速生长,在发酵体系中以黑曲霉NH11-1产β-GA为主,绿色木霉NM01产纤维素酶为辅。发酵第4~6天FPA开始逐渐上升,β-GA仍呈上升趋势,说明此过程主要是绿色木霉NM01产纤维素酶,而黑曲霉NH11-1起辅助协同作用。绿色木霉NM01与黑曲霉NH11-1二者互利共生,绿色木霉产生大量的内切和外切葡聚糖酶,催化发酵培养基中的纤维素类底物产生大量纤维二糖,纤维二糖进一步诱导黑曲霉NH11-1生成大量β-GA,有效降解纤维二糖生成葡萄糖,供给绿色木霉NM01与黑曲霉NH11-1利用。在发酵第5天与第6天β-GA与FPA的比值分别为1.22、1.10,说明纤维素酶组分配比合理,同时纤维素酶活均较高,均满足降解纤维素的条件,但考虑到发酵的经济性,因此,选取发酵周期为5 d。
3 结论
与绿色木霉、黑曲霉单一培养相比,黑曲霉NH11-1与绿色木霉NM01混合发酵在产纤维素酶方面具有明显优势,二者可以兼容并发挥协同作用,改善纤维素酶的组分配比,并提高纤维素酶总体酶活。结果表明,黑曲霉NH11-1推迟48 h接种至绿色木霉NM01发酵瓶中进行混合发酵的产酶效果最佳,30 ℃、200 r/min恒温振荡培养5 d,FPA达到242.80 U/mL,是出发菌黑曲霉NH11-1的2.66倍;β-GA达到297.35 U/mL,是出发菌绿色木霉NM01的1.94倍;β-GA与FPA的比值为1.22,符合纤维素酶水解天然纤维素的最佳比例范围。
结果表明,绿色木霉NM01与黑曲霉NH11-1在同一发酵体系中二者可以兼容并发挥协同作用,可以改善纤维素酶的组分配比,并提高纤维素酶总体酶活,即混合发酵具有良好的大规模产纤维素酶的工业应用前景。
[1]刘晓晶,李 田,翟增强.纤维素酶的研究现状及应用前景[J].安徽农业科学,2011,39(4):1920-1921,1924.
[2]靳振江.纤维素酶降解纤维素的研究进展[J].广西农业科学,2007,38(2):127-130.
[3]BANSAL N,TEWARI R,SONI R,et al.Production of cellulases fromAspergillus nigerNS-2 in solid state fermentation on agricultural and kitchen waste residues[J].Waste Manage,2012,32(7):1341-1346.
[4]JUTURU V,JIN C W.Microbial cellulases:Engineering,production and applications[J].Renew Sust Ener Rev,2014,33(5):188-203.
[5]余兴莲,王 丽,徐伟民.纤维素酶降解纤维素机理的研究进展[J].宁波大学学报:理工版,2007,20(1):78-82.
[6]赵 琪,李亚兰,陈子欣,等.纤维素酶应用研究的最新进展[J].广州化工,2014,42(6):21-23.
[7]郝 月,杨翔华,洪 新.纤维素酶的应用研究[J].青海科技,2005(3):31-36.
[8]赵 珊,刘 杰,佘 容,等.纤维素酶在畜牧业中的应用及研究进展[J].黑龙江畜牧兽医,2014(1):30-33.
[9]顾方媛,陈朝银,石家骥,等.纤维素酶的研究进展与发展趋势[J].微生物学杂志,2008,28(1):83-87.
[10]HANIF A,YASMEEN A,RAJOKA M I.Induction,production,repression,and de-repression of exoglucanase synthesis inAspergillus niger[J].Bioresource Technol,2004,94(3):311-319.
[11]WEN Z,LIAO W,CHEN S.Production of cellulase/β-glucosidase by the mixed fungi cultureTrichoderma reeseiandAspergillus phoenicison dairy manure[J].Process Biochem,2005,40(3):3087-3094.
[12]TSAO G T,XIA L,CAO N,et al.Solid-state fermentation withAspergillus nigerfor cellobiase production[J].Appl Biochem Biotech,2000,84-86:743-749.
[13]杨 盛,侯红萍.高效降解纤维素混合菌的筛选及其产酶条件的研究[J].中国酿造,2008,27(21):20-23.
[14]DUFF S J B,MURRAY W D.Bioconversion of forest products industry waste cellulosics to fuel ethanol:a review[J].Bioresource Technol,1996,55(1):l-33.
[15]AHAMED A,VERMETTE P.Enhanced enzyme production from mixed cultures ofTrichoderma reeseiRUT-C30 andAspergillus nigerLMA grownasfed batchinastirredtankbioreactor[J].Biochem Eng J,2008,42(5):41-46.
[16]GUTIERREZ-CORREA M,PORTAL L,MORENO P,et al.Mixed culture solid substrate fermentation ofTrichoderma reeseiwithAspergillus nigeron sugar cane bagasse[J].Bioresource Technol,1999,68(6):173-178.
[17]陈 光,徐 杨,孙 旸,等.快中子辐射诱变对绿色木霉产纤维素酶的影响[J].吉林农业大学学报,2011,33(2):177-180.
[18]高星星,潘丽军,杨培周,等.里氏木霉与黑曲霉混合发酵产纤维素酶的条件优化[J].食品科学,2012,33(19):193-198.

