冷皂化—高效液相色谱法测定乳制品中叶黄素的5种顺反式异构体
陈万勤等
摘 要 建立了冷皂化高效液相色谱法测定乳制品中叶黄素的5种顺反式异构体。将乳制品进行冷皂化处理后, 经正己烷石油醚二氯甲烷(2∶2∶1, V/V)提取, 使用YMC C30色谱柱分离, 以甲醇和甲基叔丁基醚为流动相进行梯度洗脱, 采用二极管阵列检测器于445 nm波长下检测, 外标法定量; 在0.127~5.082 mg/L范围内的线性关系良好, 相关系数(R2)为0.9999, 回收率在96.7%~102.2%之间, RSD在4.1%~5.4%之间(n=6), 检出限为0.010 μg/g(S/N=3), 定量限为0.030 μg/g(S/N=10)。 本方法简单、准确、灵敏度高, 适用于乳制品中叶黄素5种异构体的检测。
关键词 高效液相色谱法; 叶黄素; 异构体; 乳制品
1 引 言
叶黄素(Lutein), 又名黄体素, 是存在于蔬菜、花卉、水果与某些藻类生物中的天然类胡萝卜素。叶黄素具有良好的预防人体衰老、动脉硬化[1]、抗氧化、抗癌功效[2]以及独特的护眼功能[3,4]等, 在保健品、化妆品和动禽类饲料等多个领域广泛应用。美国FDA于1995年批准了叶黄素作为食品补充剂用于食品中, 我国2007年批准了叶黄素作为营养强化剂添加到婴幼儿或儿童配方食品中[5]。叶黄素分子结构中含多个共轭碳碳双键结构, 由于烯键的存在, 叶黄素可以存在多种几何异构体。叶黄素不同异构体在生物体内的生物活性也不同, 其中全反式构象的生物活性较顺式构象要高很多[6,7]。目前市售的食品中很少有区分叶黄素不同异构体的含量。因此, 建立高效的叶黄素顺反异构体的检测方法具有重要的意义。
目前叶黄素的检测方法主要以高效液相色谱法[8~10]和液质联用法[11,12]为主。由于叶黄素在光和热的作用下容易发生顺反异构化[13,14], 因此样品的所有处理过程需在较低温度和避光条件下进行, 避免全反式叶黄素发生异构化。所以到目前为止, 国际市场上也只有全反式叶黄素标准物质在售, 尚未有叶黄素顺式异构体的标准物质, 对顺式异构体进行定量仍然是一个难题。本研究采用全反式叶黄素作为标准物质, 对5种叶黄素异构体进行定量分析, 并且对样品的前处理方法进行了研究, 采用冷皂化法进行样品的前处理, 避免叶黄素在高温皂化时叶黄素发生异构化, 采用液相色谱法结合YMC C30色谱柱对叶黄素异构体进行有效分离, 准确定量。
2 实验部分
2.1 仪器与试剂
Agilent1260高效液相色谱仪, 配二极管阵列检测器(美国Agilent公司); 紫外/可见分光光度计; 乙腈、甲醇(色谱纯, Merk公司); 甲基叔丁基醚、石油醚、二氯甲烷、正己烷、乙醇、四氢呋喃(色谱纯, Tedia公司); 2,6二叔丁基对甲苯酚(BHT, 纯度99.4%, SigmaAldrich公司); KOH(纯度>80%, SigmaAldrich公司); 实验用水为MilliQ超纯水。全反式叶黄素标准品(纯度99.8%, ChromaDex公司)。
2.2 全反式叶黄素标准溶液的配制
准确称取5.0 mg全反式叶黄素标准品于100.0 mL容量瓶中,用含0.003% BHT的乙醇溶解并定容。该溶液可在
40 ℃下完好保存6个月。准确吸取叶黄素标准储备液用含0.003% BHT乙醇配制成标准系列溶液Ⅰ,Ⅱ,Ⅲ,Ⅳ和Ⅴ。采用分光光度法[15]和高效液相色谱峰面积归一法校准标准系列溶液Ⅰ,Ⅱ,Ⅲ,Ⅳ,Ⅴ的浓度分别为5.082,2.033,1.016,0.254和0.127 mg/L。
2.3 色谱条件
液相色谱柱:YMC C30色谱柱(250 mm×4.6 mm, 3.5 μm, YMC公司); 柱温: 25 ℃; 进样量:100 μL; 以甲醇(A)和甲基叔丁基醚(B)为流动相, 梯度洗脱: 0.0~14.0 min, 85%A, 15%B; 14.0~15.0 min, 90%A,10%B; 15.0~18.0 min, 10%A, 90%B; 18.0~22 min, 85%A, 15%B。 流速1.0 mL/min; 检测波长: 445 nm, 参考波长: 550 nm。
2.4 样品前处理
样品的前处理过程都要在避光或者在经对紫外光过滤的灯光下进行, 以避免叶黄素发生异构化。称取粉末样品2 g(精确到0.001 g)或液态样品10 g(精确到0.001 g), 置于50.0 mL离心管中, (粉末样品加入10 mL实验室用水, 充分涡旋2 min), 加入四氢呋喃5 mL, 涡旋混匀, 加入5% KOH甲醇溶液10 mL, 漩涡振荡1 min, 于摇床上室温振荡反应30 min, 反应结束后加入含0.005%BHT的石油醚正己烷二氯甲烷(2∶2∶1, V/V)提取液10 mL, 加盖漩涡混匀60 s, 6000 r/min离心10 min, 取上层有机相于玻璃试管中; 再用10 mL提取液重复提取一次, 合并有机相, 有机相在35 ℃下氮气吹干, 用含0.003% BHT的乙醇溶液完全溶解, 并定容至5.0 mL, 用0.22 μm有机滤膜过滤, 供HPLC分析。
3 结果与讨论
3.1 方法定量原理
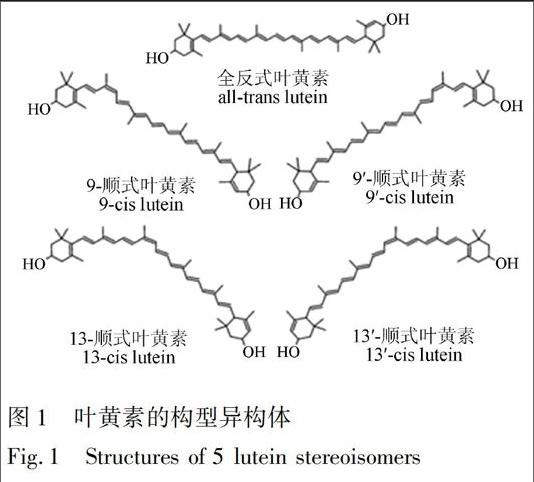
叶黄素属于类胡萝卜素, 其分子式为C40H56O2, 分子量为568.9, 热处理时, 全反式叶黄素异构化成为顺式叶黄素异构体, 其中最常见的是13顺式叶黄素、13′顺式叶黄素和9顺式叶黄素、9′顺式叶黄素, 叶黄素也易被氧化及光诱导异构化, 因此, 实验过程必须与氧气和白光隔绝, 并且所有操作在室温下进行, 全反式叶黄素的结构如图1所示。
由于叶黄素容易发生异构化, 难以获得顺式叶黄素标准物质。有报道采用全反式叶黄素制备顺式叶黄素标准物质的方法, 方法虽然可行, 但是不适用于检测机构日常检测工作。顺式叶黄素与反式叶黄素在445 nm的吸光系数存在着差异, 在定量顺式叶黄素异构体, 以反式叶黄素为标准, 使用修正系数0.7以修正顺式和反式异构体吸收峰和消光系数之间的差异, 因此本实验通过在445 nm下得到的顺式叶黄素峰面积与全反式叶黄素标准品的峰面积相比, 从而实现对全反式叶黄素的定量分析, 也可以对4种顺式叶黄素和全反式叶黄素同时进行计算, 最终计算总叶黄素含量。endprint
3.2 色谱条件的优化与叶黄素异构体的定性
C18色谱柱和C30色谱柱都可以用来检测类胡萝卜素, 但是C18色谱一般用于分析类胡萝卜素的总量, 而C30色谱柱具有良好的峰形和较长的保留时间等优越的性能, 通常用于类胡萝卜素的顺反异构体的分离。
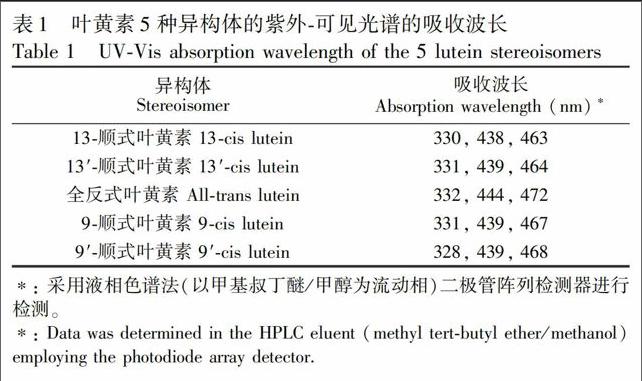
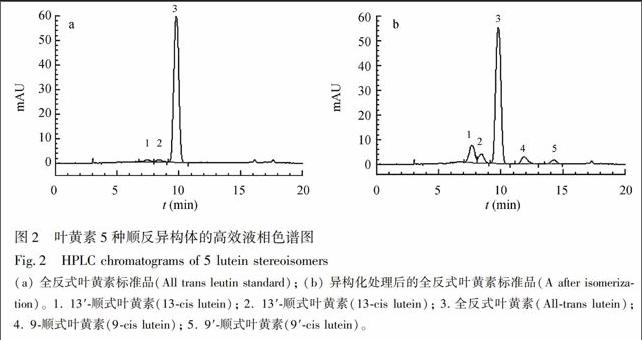
本研究参考了文献[16]的方法对全反式叶黄素进行异构化反应。将1 mg反式叶黄素用少量甲苯溶解后, 加入2 mg/L碘正己烷溶液, 使碘的含量为叶黄素质量的2%, 将混合液放在40 W日光灯下光照1 h, 然后用1 mol/L硫代硫酸钠溶液洗涤2次, 除去多余的碘, 有机相在30 ℃下氮气吹干后, 用含0.003%BHT的乙醇溶液复溶, 定容至10.0 mL, 得到顺式和反式叶黄素混合样品, 用于叶黄素的定性分析。为了消除上一个色谱样品杂质对下一个色谱样品目标物的干扰, 在目标物完全洗脱后, 采用大比例的甲基叔丁基醚对色谱柱进行洗脱, 保证可能存在杂质完全被洗脱出来后不干扰下一个样品的检测。在液相色谱系统中, 对5种叶黄素异构体的紫外可见光谱图进行全扫描, 叶黄素5种异构体的紫外可见光谱的吸收波长见表1, 9顺式和13顺式结构与全反式结构的叶黄素的最大吸收波长相差约4 nm, 这是由于顺式结构叶黄素发生了紫移现象, 与文献[8]报道一致。通过光谱对照并参照采用YMC C30色谱柱实现叶黄素5种顺反异构体完全分离的文献[8,17,18], 对叶黄素5种异构体进行定性分析。全反式叶黄素标准样品如图2a所示, 经过异构化处理的叶黄素标准样品中叶黄素5种顺反异构体如图2b所示, 各种叶黄素异构
体的分离效果良好。由于叶黄素标准对照品在运输和转移过程中, 不可避免会受光和热影响, 全反式叶黄素会发生微量的异构化, 因此采用面积归一化法得到全反式叶黄素的含量, 从而消除了微量顺式叶黄素对计算结果的影响。
3.3 样品制备方法的优化
叶黄素对光和热都很敏感, 操作过程要避光且防止高温, 因此实验在常温下对样品进行皂化, 使用甲醇KOH溶液作为皂化液的皂化效果优于KOH水溶液, 减少了水溶液的稀释作用, 同时甲醇作为有机溶剂加入, 有利于溶解叶黄素。为了防止提取过程中发生乳化, 促进叶黄素的溶解, 提高皂化效率, 在皂化过程加入四氢呋喃。
使用石油醚、正己烷、二氯甲烷作为提取溶剂, 发现3种试剂混合提取时效果较好; 考察了不同比例的混合溶液的提取效率发现, 当石油醚正己烷二氯甲烷(2∶2∶1, V/V)时, 提取效率高, 并且提取溶剂在提取液上层, 有利于提取操作, 减少了样品基质的干扰作用。不同萃取溶剂的萃取效果见表2。本研究采用石油醚正己烷二氯甲烷(2∶2∶1, V/V)溶液作为提取液。
3.4 线性范围、检出限和定量限
对全反式叶黄素标准液进行检测, 以仪器响应的峰面积A对全反式叶黄素的质量浓度C进行线性回归, 在0.127~5.082 mg/L范围内的线性关系良好, 回归方程为A=1368.4C-9.7, 相关系数(R2)为0.9999。在空白样品中添加叶黄素标准品, 以S/N=3确定方法的检出限, 以S/N=10确定方法的定量限, 得到叶黄素的检出限为0.010 μg/g, 定量限为0.030 μg/g。
3.5 回收率和精密度
对不含叶黄素乳粉样品进行全反式叶黄素回收率实验, 添加水平分别为0.200, 0.500和1.000 μg/g, 采用优化后的前处理方法对样品进行处理, 每个添加水平重复6次, 平均回收率分别为97.5%, 102.2%和96.7%, RSD分别为5.4%, 4.3%和4.1%。
3.6 实际样品测定
4 结 论
建立了乳制品中叶黄素5种顺反异构体的高效液相色谱法。采用冷皂化前处理, 保证样品在皂化过程中叶黄素能保持原有的构型, 使用YMC C30色谱柱对叶黄素5种顺反异构体进行了有效分离, 4种顺式异构体依据反式叶黄素标准物质进行准确定量分析。方法简单快速, 准确度和精密度高, 适用于乳制品中叶黄素5种顺反异构体的定量检测。
References
1 Rao A V, Rao L G. Pharmacol. Res., 2007, 55: 207-216
2 DruesnePecollo N, LatinoMartel P, Norat T, Barrandon E, Bertrais S, Galan P, Hercberg S. Int. J. Cancer, 2010, 127(1): 172-184
3 Beatty S, Boulton M, Henson D, Kob H H, Murray I J. Br. J.Ophthalmol., 1999, 83: 867-877
4 Berendschot T T, Goldbohm R A, Klpping W A, van deKraats J, van NorelJ, van NorrenD. Invest. Ophthalmol. Vis. Sci., 2000, 41(11): 3322-3326
5 Ministry of Health 2007 No.8 Bulletin of the Ministry of Health of The People′s Republic of China. www.moh.gov.cn/business/htmlfiles/mohwsjdj/pggtg/200804/17170.htm
中华人民共和国卫生部公告2007年第8号公告
6 Bohm V, PuspitasariNienaber N L, Ferruzzi M G, Schwartz S J. J. Agric. Food Chem., 2002, 50(1): 221-226endprint
7 Khachik F, Bernstein P S, Garland D L. Invest. Ophthalmol. Vis. Sci., 1997, 38(9): 1802-1811
8 Aman R, Biehl J, Carle R, Conrad J, Beifuss U, Schieber A. Food Chem., 2005, 92: 753-763
9 WANG LiNa, HUANG JunRong, ZHANG Li, FENG Feng, LING Yun, CHU XiaoGang, LI HongLiang. Chinese Journal of Chromatography, 2013, 31: 1228-1231
王丽娜, 黄峻榕, 张 立, 冯 峰, 凌 云, 储晓刚, 李宏梁. 色谱, 2013, 31(12): 1228-1231
10 Hsu B Y, Pu Y S, Stephen Inbaraj B, Chen B H. J. Chromatogr. B, 2012, 899: 36-45
11 Dachtler M, Glaser T, Kohler K, Albert K. Anal. Chem., 2001, 73: 667-674
12 Elena M O, Dmaso H M. Food Chem., 2012, 135(3): 1344-1352
13 Marx M, Stuparic M, Schieber A, Carle R. Food Chem., 2003, 83: 609-617
14 Castenmiller J J M, West C E. Annu. Rev. Nutr., 1998, 18: 19-38
15 Craft N E. J. Agric. Food Chem., 1992, 40: 431-434
16 Emenhiser C, Englert G, Sander L C, Ludwig B, Schwartz S J. J. Chromatogr. A, 1996, 719: 333-343
17 Emenhiser C, SanderL C, Schwartz S J. J. Chromatogr. A, 1995, 707(2): 205-216
18 Hadden W L, Watkins R H, Levy L W, Regalado E, Rivadeneira D M, van Breemen R B, Schwartz S J. J. Agric. Food Chem., 1999, 47: 4189-4194
Abstract A cold saponification method for determination of 5 lutein stereoisomers in dairy products by high performance liquid chromatography (HPLC) was developed. Samples were coldsaponified at room temperature and extracted by nhexane/petroleum/dichloromethane (2∶2∶1, V/V/V). Then 5 lutein stereoisomers were separated on a YMC C30 column with gradient elution using methanol/methyl tertbutyl ether as the mobile phase, and data were acquired by a photodiode array detector at wavelength of 445 nm. The calibration curve was linear in the range of 0.127-5.082 mg/L with correlation coefficient of 0.9999, and the recoveries were from 96.7% to 102.2% with the RSDs in the range of 4.1%-5.4% (n=6). The limit of detection was 0.010 μg/g (S/N=3), and the limit of quantification was 0.030 μg/g (S/N=10). By presenting results of good accuracy, precision and sensitivity, this method validates its suitability for routine analysis of 5 lutein stereoisomers in dairy products.
Keywords High performance liquid chromatography; Lutein; Stereoisomers; Dairy products
(Received 20 October 2014; accepted 17 December 2014)endprint

