柞蚕蛹发育过程中生理活性物质和蛋白质的变化研究
孟 楠 都兴范 温志新 李亚洁 马淑慧 李学军
(辽宁省农业科学院大连生物技术研究所,辽宁大连 116024)
柞蚕蛹发育过程中生理活性物质和蛋白质的变化研究
孟 楠 都兴范 温志新 李亚洁 马淑慧 李学军
(辽宁省农业科学院大连生物技术研究所,辽宁大连 116024)
为探讨柞蚕蛹的利用价值,研究了柞蚕蛹部分生理活性物质及蛋白质等随着发育进程的变化关系。结果表明:在有效积温为130℃时,柞蚕蛹血淋巴中溶菌酶(LSZ)、超氧化物歧化酶(SOD)的活力达到最高值,分别为0.82 U/mL和70.58 U/mL;在有效积温为90℃时,诱导抗菌活性物质的活力达到最高值,抑菌圈直径为2.89 mm;在有效积温为150℃时,磷脂的含量达到最大值,每克鲜蛹为44.5 mg;在滞育期(0℃)时,游离氨基酸的含量达到最大值,每毫升血淋巴为16.32 mg;蛋白质种类和含量以发育中期(在有效积温为150℃)时最多。
柞蚕蛹;发育;有效积温;生理活性物质;蛋白质;变化
柞蚕(Antheraea Pernyi)是完全变态昆虫,其个体发育经历卵、幼虫(蚕)、蛹和成虫(蛾)4个在形态和生理上完全不同的发育阶段,柞蚕蛹是柞蚕幼虫向成虫变态的过渡阶段,体内积累了丰富的营养物质[1]。目前,对柞蚕蛹营养成分分析及柞蚕幼虫不同发育时期黄酮和糖类等物质的变化研究已有报道[2-4],但有关柞蚕蛹发育过程中生理活性物质的变化研究国内外尚未见报道。因此,本研究对柞蚕蛹发育过程中的溶菌酶(LSZ)、超氧化物歧化酶(SOD)、磷脂等活性成分以及蛋白质与有效积温的动态变化关系进行了研究分析,以期为柞蚕蛹期发育、免疫防御机制及活性成分的高效利用提供理论数据参考。
1 材料与方法
1.1 试验材料
供试柞蚕茧品种:抗大,由辽宁省蚕业科学研究所提供。
主要仪器和试剂:V-5000型可见光分光光度计,上海元析仪器有限公司生产;HHS型电热恒温水浴锅,上海博讯实业有限公司医疗设备厂生产;Powerpac电泳仪,美国Bio-Rad公司生产。溶菌酶和超氧化物歧化酶活性检测试剂盒,由南京建成生物工程研究所生产;溶壁微球菌干粉,购自于中国科学院微生物研究所;聚丙烯酰胺、十二烷基硫酸钠、磷酸二氢钾等其余试验试剂均为市售分析纯。
1.2 试验方法
1.2.1 柞蚕蛹加温处理 将处于滞育期的柞蚕茧在0~4℃条件下储存50 d,待其解除滞育后,将柞蚕茧放置在塑料盒内进行加温,按照柞蚕蛹发育的起点温度10℃[1],计算每天的有效积温:第1、2天温度为15℃,每天的有效积温为5℃;从第3天开始温度升为20℃,每天的有效积温为10℃,相对湿度均保持在65%~80%,直至羽化出蛾。
1.2.2 柞蚕蛹血淋巴样品采集 取不同有效积温的雌雄柞蚕蛹各10头,采集血淋巴混匀后于100℃水浴中加热5 min,12 000 r/min离心10 min,取上清液备用。
1.2.3 柞蚕链球菌及菌液的制备 柞蚕链球菌为本实验室分离保存,菌液制备方法如下:在无菌条件下取指数生长期(用接种环从斜面上取一环菌种,接到链球菌培养基中,37℃培养18~20 h,次日转管继续培养6~7 h)的柞蚕链球菌菌液,用0.9%生理盐水稀释至20倍液,计数板计数,备用。
1.2.4 柞蚕蛹抗菌活性物质的诱导 取不同有效积温的雌雄柞蚕蛹各20头,用无菌的微量注射器从蚕蛹节间膜处注入柞蚕链球菌菌液(菌液浓度为104~106个/mL),按50 uL/头的剂量注射;置于22℃培养箱中培养3 d后采集血淋巴,100℃水浴中加热5 min,12 000 r/min离心10 min,取上清液用于抗菌活性物质的活性测定。
1.2.5 溶菌酶的活性测定 参照Hultmark等[5]的方法测定。以溶壁微球菌冻干粉为底物,将底物用0.1 mol/L、pH值6.4的磷酸钾盐缓冲液配成菌悬液,取3 mL制备的溶壁微球菌菌悬液于试管内,冰浴10 min,然后加入100 uL不同有效积温条件下的待测血淋巴,振荡混匀,于分光光度计570 nm波长处测定其吸光度值(A0),然后将试管移入37℃水浴中放置30 min,取出后立即置于冰浴中10 min后终止反应,测其吸光度值(A)。溶菌酶活力(UL)计算公式:溶菌酶活力(U/mL)=(A0-A)/A。

在不同的有效积温条件下,柞蚕蛹血淋巴超氧化物歧化酶活力定义为:每毫升反应液中超氧化物歧化酶抑制率达50%时,所对应的超氧化物歧化酶的量为1个超氧化物歧化酶活力单位(U)。
1.2.7 抗菌活性物质的活性测定 采用抑菌圈法[6-7]测定。将经过高压灭菌的LB琼脂培养基,在无菌条件下取10 mL于直径90 mm的培养皿中做成平板,凝固后在无菌条件下打孔,孔径2.7 mm。取1.2.4项诱导免疫后的柞蚕蛹血淋巴上清液5μL点到孔中,于4℃下放置2 h,然后转到37℃下培养18 h后取出观察,并测量抑菌圈直径。
1.2.8 磷脂、游离氨基酸含量的测定 根据GB/T 5537—2008粮油检验磷脂含量的测定标准[8]测定柞蚕蛹磷脂的含量,根据GB/T 5009.124—2003食品中氨基酸的测定标准[9]测定游离氨基酸的含量。
1.2.9 蛋白质种类和含量的电泳分析 将不同发育时期雌雄柞蚕蛹血淋巴样品,用5%浓缩胶和12%分离胶在电压(80~120 V)的条件下进行聚丙酰胺凝胶电泳,考马斯亮蓝染色30 min后于冰醋酸中脱色,然后进行观察分析。
2 结果与分析
2.1 柞蚕蛹发育过程中溶菌酶的活性变化
从柞蚕蛹血淋巴中溶菌酶活性与有效积温的关系(图1)可以看出,柞蚕蛹在滞育期血淋巴溶菌酶活力最低,为0.43 U/mL;随着柞蚕蛹感受有效积温的增加逐渐升高,当有效积温达到130℃时溶菌酶活力达到最高值,为0.82 U/mL,是最低值的1.91倍;随后逐渐下降,羽化前接近最低值。

图1 柞蚕蛹血淋巴中溶菌酶活性与有效积温的关系
2.2 柞蚕蛹发育过程中超氧化物歧化酶的活性变化
从柞蚕蛹血淋巴中超氧化物歧化酶活性与有效积温的关系(图2)可以看出,有效积温从0℃至130℃时,随着有效积温的增加,柞蚕蛹血淋巴中超氧化物歧化酶的活力也在逐渐提高,至130℃时活力达到最高值70.58 U/mL,随后急剧下降,至羽化前(210℃)达到最低值42.04U/mL。在柞蚕蛹发育过程中,超氧化物歧化酶活力最高值是最低值的1.68倍。

图2 柞蚕蛹血淋巴中超氧化物歧化酶活性与有效积温的关系
2.3 柞蚕蛹发育过程中血淋巴抗菌活性物质的活性变化
从柞蚕蛹发育过程中诱导血淋巴抗菌活性物质的活性与有效积温的关系(图3)可以看出,有效积温从0℃至90℃时,随着积温的逐渐增加,柞蚕蛹血淋巴中抗菌活性物质的活性也在逐渐提高,至90℃时活性达到最高,抑菌圈直径为11.65 mm;随后血淋巴中抗菌活性物质的活性急剧下降,羽化前(180℃)抑菌活性降至最低,其抑菌圈直径为2.89 mm。在柞蚕蛹发育过程中诱导的血淋巴抗菌活性物质的活性,最高值是最低值的4.03倍。
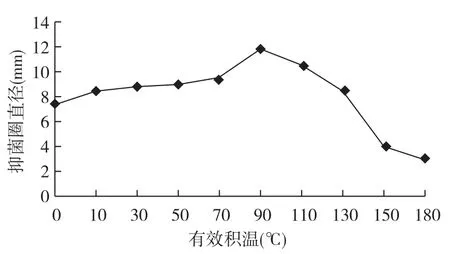
图3 柞蚕蛹发育过程中诱导血淋巴抗菌活性物质的活性与有效积温的关系
2.4 柞蚕蛹发育过程中磷脂含量的变化
从柞蚕蛹发育过程中磷脂含量与有效积温的关系(图4)可以看出,处于滞育期的柞蚕蛹磷脂含量最低,每克鲜蛹为38.3 mg,随着有效积温的增加,柞蚕蛹中的磷脂含量也在逐渐升高,至150℃时达到最高值,每克鲜蛹为44.5 mg,随后逐渐降低。在柞蚕蛹发育过程中,磷脂含量的最高值是最低值的1.16倍。
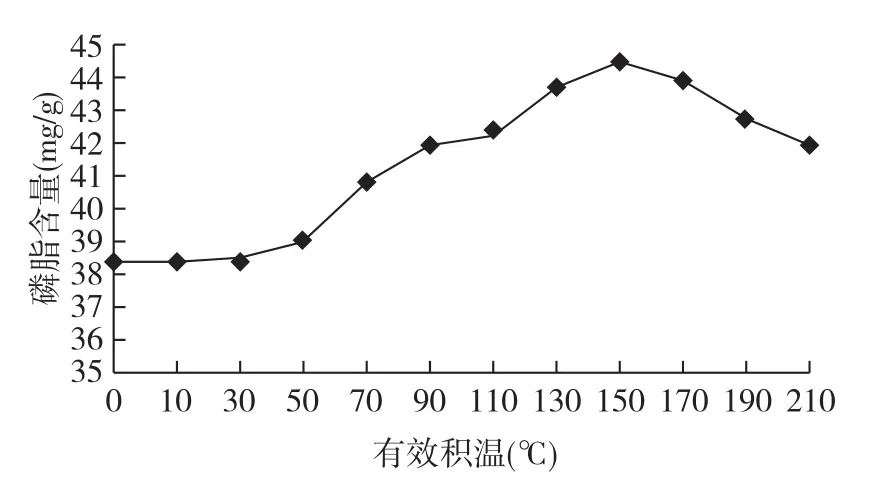
图4 柞蚕蛹发育过程中磷脂含量与有效积温的关系
2.5 柞蚕蛹发育过程中游离氨基酸含量的变化
从柞蚕蛹游离氨基酸含量与有效积温的关系(表1)可以看出,在柞蚕蛹4个不同发育阶段中,以柞蚕蛹滞育期(0℃)的氨基酸总量最高,每毫升血淋巴为16.32mg;随着有效积温的增加,氨基酸总量逐渐降低,至210℃时降至最低,每毫升血淋巴为8.63mg,滞育期的氨基酸总量是发育后期的1.89倍。4个不同发育阶段必须氨基酸的质量分数(EAA/TAA),分别为0.37、0.34、0.35和0.37。另外,不同发育时期的柞蚕蛹血淋巴中均含有16种游离氨基酸,其中,以脯氨酸(2.48 mg/mL)、苏氨酸(1.79 mg/mL)、丙氨酸(1.70 mg/mL)、组氨酸(1.61 mg/mL)、精氨酸(1.41 mg/mL)和赖氨酸(1.34 mg/mL)的含量较高;而且有10种氨基酸的含量随着有效积温的增加而降低,其余6种呈波动性变化。
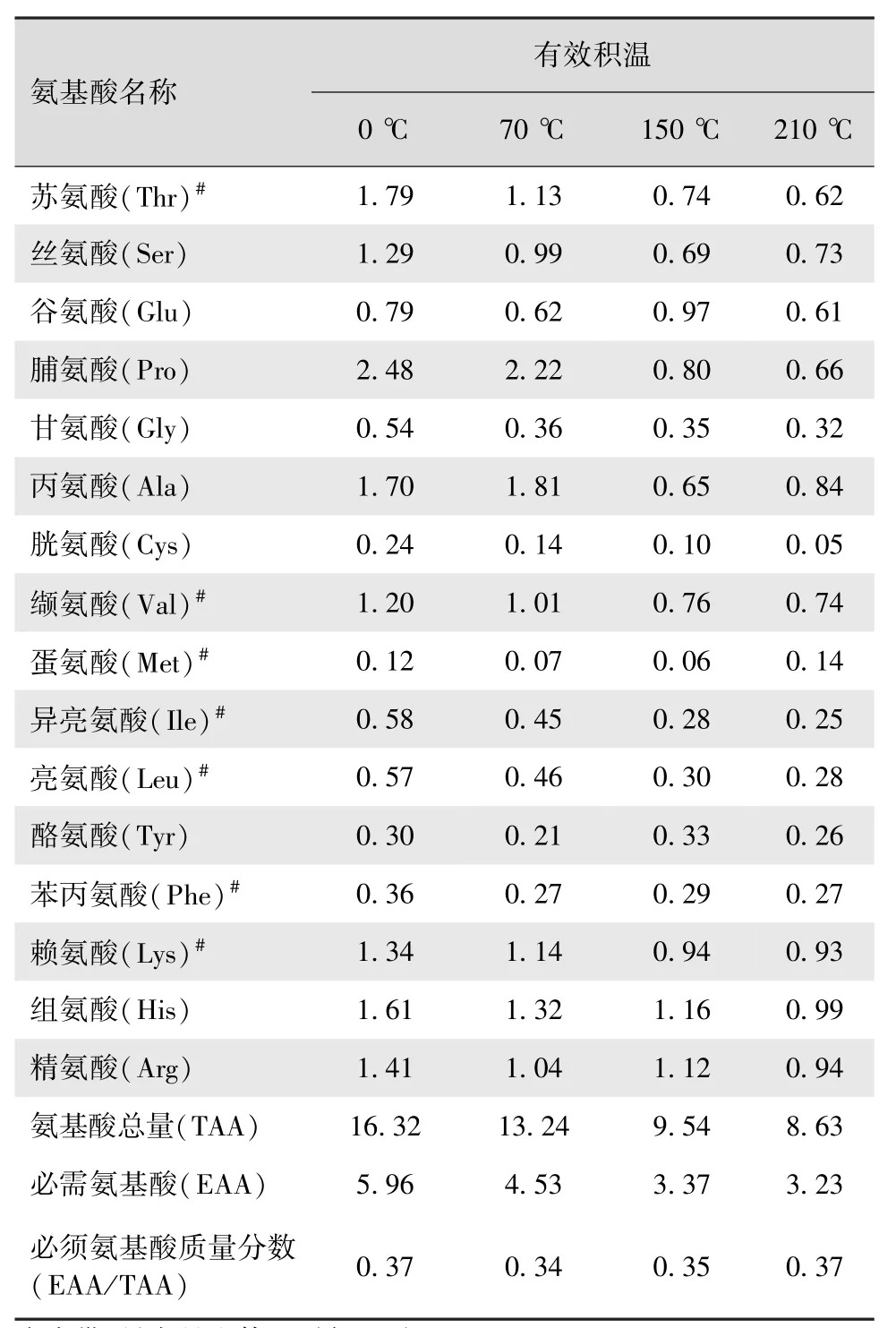
表1 柞蚕蛹游离氨基酸含量与有效积温的关系(mg/m L)
2.6 柞蚕蛹发育过程中蛋白质含量的变化
由柞蚕蛹发育过程中血淋巴蛋白质的电泳图谱(图5)可以看出,柞蚕蛹发育过程中蛋白质具有多样性,成分比较复杂,柞蚕蛹滞育期(0℃)和发育前期(70℃)血淋巴中蛋白质种类均较少,而且蛋白质含量较低;随着有效积温的增加,至发育中期(150℃)蛋白质种类和含量明显增加,表现为蛋白条带增多,颜色加重;发育后期(210℃)蛋白质种类和含量又逐渐减少和降低。在4个发育阶段,以分子量约为85 kD的蛋白质含量变化最为明显。
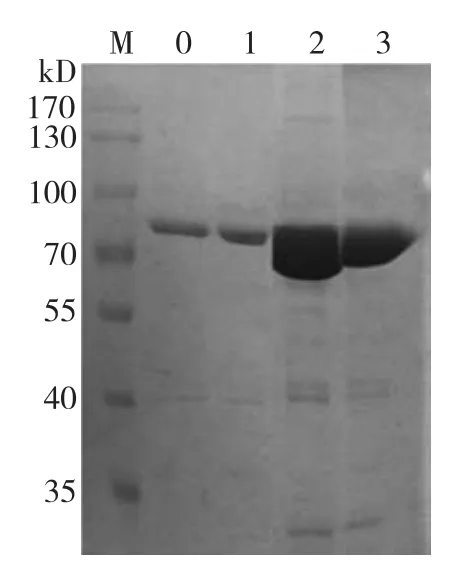
图5 柞蚕蛹发育过程中血淋巴蛋白质的电泳图谱
3 讨论
科学研究表明,昆虫体内的溶菌酶属于C型溶菌酶,这类蛋白酶可使细菌细胞壁破裂后内容物外溢,从而导致细菌溶解死亡,因此在昆虫的免疫防御体系中起着十分重要的作用[10];超氧化物歧化酶作为一种保护酶,可清除生物体代谢过程中产生的超氧自由基,保护机体免受毒害[11];而磷脂作为生物细胞不可缺少的成分,具有促进大脑发育,增强智力和防治老年性痴呆症等作用[12]。本研究表明,柞蚕蛹感温发育阶段含有溶菌酶、超氧化物歧化酶和磷脂等活性成分,且3种活性成分合成高峰期的有效积温分别为130、130、150℃,成分含量最高值分别是最低值的1.91倍、1.68倍、1.16倍,说明柞蚕蛹在发育过程中其生理活性物质含量的变化较大,为柞蚕蛹期活性成分的有效利用提供了理论依据。
昆虫的免疫应答是非专一性的,用柞蚕链球菌、大肠杆菌等诱导柞蚕蛹后可合成一系列抗菌活性物质,这些物质主要包括抗菌肽、溶菌酶和凝集素等多种活性成分[13];同时,昆虫不同发育时期的抗菌活性差别与其免疫防御系统有关[14]。本试验利用柞蚕链球菌诱导不同发育时期的柞蚕蛹发现,发育中期和前期的柞蚕蛹抗菌活性较高,发育后期的活性急剧下降。推测可能与发育中期和前期柞蚕蛹的免疫应答能力较强有关。
昆虫血淋巴中含有大量的游离氨基酸,其含量通常为脊椎动物血液中的50倍左右。这些氨基酸除作为合成蛋白质的物质外,还可能有一些特殊的功能,如渗透压的调节、废物的解毒、特殊条件下的能量来源及参与形态变异和生殖过程[15]。本试验中,随着柞蚕蛹的发育(有效积温的增加),游离氨基酸总量逐渐降低。这可能是由于柞蚕蛹解除滞育后发育至成虫阶段,需要消耗大量的游离氨基酸,致使氨基酸总量下降所致。
柞蚕蛹在发育过程中,虽然表面静止不动,但蛹体内却进行着剧烈的组织解离和组织发生过程[1]。试验结果表明,处于发育中期的柞蚕蛹生理活性物质含量普遍较高,蛋白质种类和含量变化明显,这一变化是否与柞蚕蛹的发育机制有关尚有待于进一步的研究分析。
[1] 秦利,王学英,李建男,等.中国柞蚕学[M].北京:中国科学文化出版社,2003:82-160.
[2] 孟楠,都兴范,李学军,等.柞蚕幼虫、嫩蛹及滞育蛹营养成分的分析比较研究[J].北方蚕业,2013,34(4):11-13.
[3] 藏楠,王学英,孙佳,等.不同品种不同发育时期的柞蚕幼虫黄酮类化合物的提取及含量变化[J].科学研究,2008,29(5):35-39.
[4] 刘限,夏润玺,石生林,等.柞蚕5龄幼虫血淋巴中蛋白质和糖类物质的动态变化[J].蚕业科学,2009,35(2):412-414.
[5] Hultmark D,Steiner H,Rasmusn T,etal.Insect immunity purifica⁃tion and properties of three inducible bactericidal proteins from he⁃molymoph of immunized pupae of Hyalophera cecropia[J].Eur J Biochem,1980,106:7-16.
[6] Boman H G,Steiner H.Humoral immunity in cecropia pupae[J]. Current Topics in Microbiology and Immunology,1981,94/95:75-91.
[7] Keppi E,Zachary D,Robertson M,etal.Induced antibacterial pro⁃teins in the haemolymph of Phormia terreanovae[J].Insect Bio⁃chem,1986,16:395-402.
[8] 中国国家标准化管理委员会.GB/T 5537—2008粮油检验磷脂含量的测定[S].北京:中国标准出版社,2008:1-4.
[9] 中国国家标准化管理委员会.GB/T 5009.
124—2003食品中氨基酸的测定[S].北京:中国标准出版社,2004:1-3.
[10]张波,王林美,叶博,等.柞蚕溶菌酶基因的克隆和序列分析[J].蚕业科学,2009,35(3):539-545.
[11]夏润玺,李健男.柞蚕血淋巴超氧化物歧化酶(SOD)活性的变化[J].蚕业科学,2001,27(4):293-296.
[12]王鸿飞,徐超,周明亮,等.山核桃油改善小鼠记忆力功能的研究[J].中国粮油学报,2012,27(7):63-66.
[13]李树英.柞蚕抗病活性物质的提取及应用[J].中国蚕业,2015,36(1):20-24.
[14]蓝江林,吴珍泉,周先治,等.美洲大蠊血淋巴抗菌活性诱导差异比较[J].中国农学通报,2008,24(2):59-62.
[15]苏筱雨,黄大庄,贝蓓,等.球孢白僵菌侵染对桑天牛幼虫血淋巴游离氨基酸含量的影响[J].蚕业科学,2008,34(3):518-520.
S885.1
A
1007-0982(2015)03-0024-05
2015-04-10;接受日期:2015-05-25
辽宁省科学事业公益研究基金(编号2014002007);辽宁省科技攻关项目(编号2014209001)。
孟楠(1980—),女,辽宁沈阳,本科,助理研究员。Tel:0411-84790092,E⁃mail:mona0408@163.com
都兴范(1969—),男,辽宁丹东,硕士,研究员。Tel:0411-84790092,E⁃mail:dxfan68@126.com

