神经元损伤度对小胶质细胞表型的影响*
罗振钊,王 静,孔 曼,胡 绘,卢忠心,施 静
1华中科技大学同济医学院附属武汉市中心医院检验科,武汉 430014
2华中科技大学同济医学院基础医学院神经生物学系,武汉 430030
神经元损伤度对小胶质细胞表型的影响*
罗振钊1,王 静1,孔 曼1,胡 绘1,卢忠心1,施 静2△
1华中科技大学同济医学院附属武汉市中心医院检验科,武汉 430014
2华中科技大学同济医学院基础医学院神经生物学系,武汉 430030
目的 探讨不同的神经元损伤度对小胶质细胞表型的影响。方法 将原代培养的神经元进行缺氧处理,不同的时长(0.5、1、2、4h)后,复氧处理24h,收集神经元条件培养液(neuron-conditioned media,NCM),然后将NCM刺激原代培养的小胶质细胞24h(NCM∶小胶质细胞培养液=1∶1,V/V)。采用Western blot法检测小胶质细胞内的M2表型标记物精氨酸酶-1(arginase-1)和激活标记物离子钙结合衔接分子-1(Iba-1)的表达变化规律,采用免疫荧光法检测arginase-1的表达变化规律。同时,采用ELISA法检测小胶质细胞培养液上清中的营养因子,如脑源性神经营养因子(BDNF)、胶质细胞源性神经营养因子(GDNF)和炎性因子,如肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)的分泌变化规律。最后,将不同损伤度的NCM诱导小胶质细胞形成不同表型,将小胶质细胞和缺氧处理2h后的神经元共培养24h,MTT法检测神经元的活力。结果 轻微损伤(缺氧0.5、1h)的NCM明显下调M2型标记物arginase-1的表达水平,中度(缺氧2h)和重度(缺氧4h)损伤的NCM能够上调arginase-1的表达,各种损伤度的NCM都能上调Iba-1的表达水平,提示其在一定程度上激活小胶质细胞。同时,轻微损伤的NCM明显上调小胶质细胞TNF-α、IL-1β和IL-6的分泌,而中度和重度损伤的NCM对这些促炎因子的释放没有影响,各种损伤度的NCM都能明显上调营养因子的分泌。MTT法检测表明,轻微和重度损伤处理的NCM刺激的小胶质细胞进一步加重缺氧处理的神经元损伤,而中度损伤的NCM对缺氧处理后的神经元具有保护作用。结论 神经元损伤度是决定小胶质细胞表型的重要因素,进而使小胶质细胞进一步发挥神经毒性或保护作用。
小胶质细胞; 细胞因子; 神经元损伤度; 表型
越来越多的研究证据表明,神经炎症参与了脑缺血再灌注损伤的预后过程[1]。小胶质细胞作为中枢神经系统中的免疫细胞,持续不断地监控着大脑微环境[2]。当中枢神经系统受到损伤,例如感染、脑外伤、缺血性损伤时,小胶质细胞迅速地被激活,从苎麻状的静息状态转换为阿米巴状,迁移到受损部位,通过吞噬清除细胞碎片和毒性物质,同时释放一系列的炎性因子,例如肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、活性氧簇、活性氮簇、前列腺素等,进一步加重炎症损伤[34]。另一方面,激活的小胶质细胞通过分泌白细胞介素-10、干扰素-γ、转化生长因子-β、胰岛素样生长因子1和碱性成纤维细胞生长因子等神经营养因子,支持神经元的存活,促进基质重建,避免继发性的炎症损伤[5]。因此,小胶质细胞在脑损伤后具有促炎和抗炎的双重作用,由于小胶质细胞在脑损伤后,能够感受受损神经元释放的信号分子,那么,不同的神经元损伤度是否对小胶质细胞的表型有影响,目前仍不清楚。
本研究利用不同时长缺氧处理的神经元条件培养液(neuron-conditioned media,NCM)刺激小胶质细胞,检测小胶质细胞培养上清中神经营养因子和炎性因子的释放水平,同时采用Western blot法和免疫荧光法检测小胶质细胞M2表型标记物精氨酸酶-1(arginase-1)和激活标记物离子钙结合衔接分子-1(Iba-1)的表达变化规律,旨在探讨神经元损伤度对小胶质细胞表型的影响。
1 材料与方法
1.1 原代小胶质细胞培养
采用出生后1~3d的SD新生大鼠,将全脑置于预冷的D-Hank’s平衡盐溶液中,在解剖显微镜下用精细尖镊剥去嗅球、脑膜、端脑、脑干等,然后将大脑皮质用手术刀切成1mm3的小块,加入0.125%胰酶37℃消化5min,加入1/10消化液体积的胎牛血清(FBS)终止消化,用10mL刻度吸管将组织块吹打成单细胞悬液,然后用筛网直径为70 mm的细胞筛过滤,将细胞悬液以800r/min、4℃离心5min,细胞沉淀重悬于DMEM+10%FBS的培养液,计数,将细胞按照(1.0~1.2)×105/cm2的密度种植于用50mg/mL多聚赖氨酸包被过夜处理的75cm2细胞培养瓶中,此后每隔3d换液1次,体外培养14d以后,可见许多贴壁不牢的,折光率很强的小胶质细胞漂浮在星形胶质细胞上面。纯化小胶质细胞采用振摇法,将培养瓶置于37℃水平摇床,瓶口密封,150r/min振摇6h,将细胞悬液用50mL离心管收集,1 000r/min、4℃离心7min,将其沉淀重悬于DMEM+10%FBS,计数,接种于培养皿或Transwell插件,培养1d后用于下游实验。小胶质细胞的纯度通过标记Iba-1鉴定,纯度>95%,在和神经元共培养实验中,小胶质细胞培养液在共培养之前24h换成Neurobasal培养液,用于匹配神经元的培养液。
1.2 原代皮质神经元培养
原代皮质神经元采用孕16~18d的SD大鼠的胚胎鼠,将全脑置于预冷的D-Hank’s平衡盐溶液中,在解剖显微镜下用精细尖镊剥去嗅球、脑膜、端脑、脑干等,然后将大脑皮质用手术刀切成1mm3的小块,加入0.125%胰酶37℃消化5min,加入1/10消化液体积的胎牛血清(FBS)终止消化,用10mL刻度吸管将组织块吹打成单细胞悬液,然后用筛网直径为70mm的细胞筛过滤,将细胞悬液以800r/min,4℃离心5min,细胞沉淀用DMEM+10% FBS的培养液重悬,计数,将细胞按照1×106/mL的密度种植于用50mg/mL多聚赖氨酸过夜包被处理的24孔板或者35mm培养皿中。细胞贴壁3h后换成Neurobasal+2%B27+0.5mmol/L谷氨酰胺+25mmol/L谷氨酸+1%青霉素-链霉素的培养液,以后每隔2d半量换液,体外培养7~10d用于实验。
1.3 神经元和神经元-小胶质细胞共培养缺氧处理
将神经元从正常培养箱中取出,置于含有95% N2、5%CO2的厌氧培养箱中培养不同时长(箱内氧浓度低于1%),处理完毕后,将培养物置于正常的培养箱进行复氧培养24h,然后用于实验。神经元-小胶质细胞共培养实验如下:将小胶质细胞纯化后种植于Transwell小室内,先将神经元单独缺氧不同时长后复氧24h的NCM按照与小胶质细胞培养液1∶1的比例刺激小胶质细胞24h,然后将小胶质细胞与缺氧处理2h后的神经元共培养24h,最后采用MTT法检测神经元活力。
1.4 ELISA法检测细胞因子
细胞培养上清中的TNF-α、IL-1β、脑源性神经营养因子(BDNF)、胶质细胞源性神经营养因子(GDNF)的含量采用商业化的ELISA试剂盒按照说明书进行检测。TNF-α、IL-1β、IL-6检测试剂盒购自美国R&D公司,BDNF检测试剂盒购自美国Millipore公司,GDNF检测试剂盒购自美国Abnova公司。细胞培养上清收集于高压过的干净EP管中,2 000r/min,4℃,离心10min,取上清,按照250mL每管分装,保存于-20℃冰箱,待样品收集齐全后,再进行检测。ELISA检测试剂盒的检测限如下:TNF-α为5pg/mL,IL-1β为5pg/mL,IL-6为5pg/mL,BDNF为7.8pg/mL,GDNF为3.9pg/mL。
1.5 Western blot检测小胶质细胞的arginase-1和Iba-1的表达
小胶质细胞的总蛋白提取物经12%或15%分离胶浓度的SDS-PAGE电泳,将蛋白转移到PVDF膜上,TBST漂洗3次,然后采用含5%脱脂奶粉的TBST室温封闭1h,TBST充分洗涤后,加入一抗4℃冰箱孵育过夜。各种抗体来源和孵育浓度如下: arginase-1(Abcam,UK),Iba-1(Abcam,UK),β-actin(Santa Cruz,USA)。一抗孵育完成后TBST漂洗3次,辣根过氧化物酶结合的二抗常温孵育l h,TBST充分洗涤后以ECL法显色并拍照。NIH图像软件分析各条带吸光度(A)值,结果以与正常对照组的A值的百分比表示。
1.6 免疫荧光法检测小胶质细胞的arginase-1的表达
将不同损伤度的NCM刺激小胶质细胞24h后,PBS漂洗小胶质细胞3次,将其用4%的多聚甲醛室温固定30min,然后用PBS漂洗3次,采用含0.3%Triton-X100的PBS破膜15min,然后将其用含3%BSA的PBS室温封闭0.5h,采用arginase-1(Abcam,UK)一抗4℃孵育过夜。然后PBS漂洗3次,孵育带有绿色荧光的兔二抗,荧光显微镜下拍照。
1.7 细胞活力检测
本研究选用MTT法检测细胞的活力,神经元种植于24孔板中,处理完毕后,每孔加入80mL MTT(5mg/mL)在37℃的CO2培养箱孵育4h,让活细胞的琥珀酸脱氢酶将MTT充分形成甲脸瞅肝臜,然后尽量吸尽孔中的培养液,加入500mL二甲基亚砜(DMSO)在37℃水平摇床上充分溶解结晶物,用酶标仪在560nm处检测样品的A值,并在630nm处测定参考波长,将测定波长的A值减去参考波长的A值,以A值的大小反映细胞活力。
1.8 统计学分析
2 结果
2.1 缺氧时长对神经元活力的影响
细胞的存活率常用来检测细胞的损伤水平。对培养的神经元进行不同时长(0.5、1、2、4h)缺氧处理,然后再复氧培养24h,采用MTT法检测神经元活力,不同的处理时长对神经元产生不同程度的损伤,且随着缺氧时间延长,损伤逐级加重,根据损伤后的神经元活力,将其分为以下3种情况:轻度损伤(死亡率<40%,0.5、1h缺氧),中度损伤(40%~70%死亡率,2h缺氧),重度损伤(死亡率>70%,4 h缺氧)(图1)。
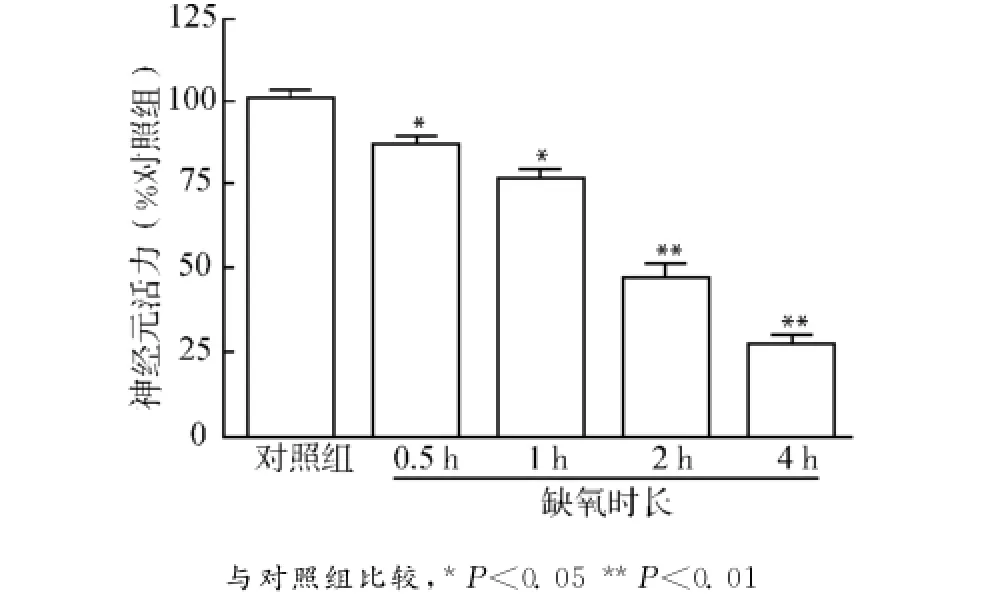
图1 不同缺氧时长处理对神经元活力的影响Fig.1 Effect of different time of hypoxia treatment on neuronal viability
2.2 不同损伤度的神经元条件培养液(NCM)对小胶质细胞表型的影响
由于小胶质细胞具有促炎和抗炎的双重属性,近期的研究将小胶质细胞划分为经典激活的促炎型(M1型)和选择性激活的抗炎型(M2型)。本实验采用M2型的标记蛋白精氨酸酶-1(arginase-1)来标记M2型,采用Iba-1来检测小胶质细胞的激活程度。采用缺氧处理之后的神经元条件培养液(按照NCM∶小胶质细胞培养液=1∶1,V/V)刺激小胶质细胞,然后检测小胶质细胞的arginase-1和Iba-1的表达情况。结果表明:轻度损伤的NCM明显下调arginase-1的表达水平,而中度和重度损伤的NCM能够上调arginase-1的表达水平;同时,各种损伤度的NCM都能够上调Iba-1的表达水平,说明其能在一定程度上激活小胶质细胞,其中轻度损伤的NCM对Iba-1的上调最为明显;采用免疫荧光染色法对上述处理的小胶质细胞进行arginase-1染色,结果与蛋白表达水平一致(图2)。
ELISA法检测小胶质细胞分泌的细胞因子,结果与Western blot的结果具有一致性,缺氧处理0.5h和1h的NCM明显地上调促炎因子TNF-α、IL-1β和IL-6的释放,缺氧处理2h和4h的NCM对促炎因子的分泌没有影响。由于小胶质细胞表达的两种营养因子为BDNF和GDNF[4],因此我们检测了各种损伤度的NCM对这两种营养因子释放的影响,结果表明,各种损伤度的NCM都能明显上调营养因子BDNF和GDNF的释放,但是不同神经损伤度NCM之间对于营养因子的影响没有差异(图3)。
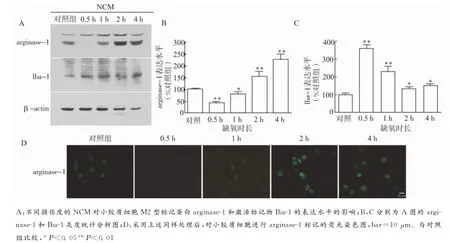
图2 不同损伤度的NCM刺激对小胶质细胞的M2型标记物arginase-1和激活标记物Iba-1表达水平的影响Fig.2 Effect of NCM of different severities on the expression levels of the microglial M2marker arginase-1and the activation marker Iba-1
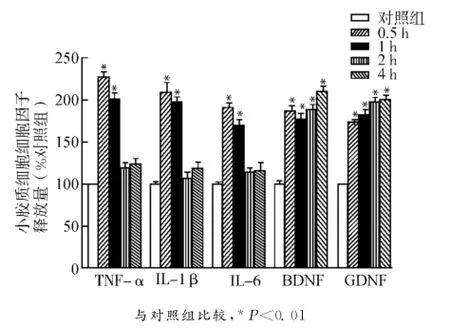
图3 不同损伤度的NCM刺激对小胶质细胞细胞因子释放的影响Fig.3 Effect of NCM of different severities on the release of microglial cytokines
2.3 不同损伤度的NCM诱导的小胶质细胞表型对缺氧损伤后的神经元存活率的影响
将不同损伤度的NCM刺激小胶质细胞24h,然后将小胶质细胞和缺氧处理2h后的神经元共培养24h,最后检测神经元的活力。结果表明,中度损伤的NCM刺激后的小胶质细胞对缺氧损伤后的神经元发挥保护作用,而轻度和重度损伤的NCM刺激后的小胶质细胞进一步加重缺氧处理神经元的损伤(图4)。
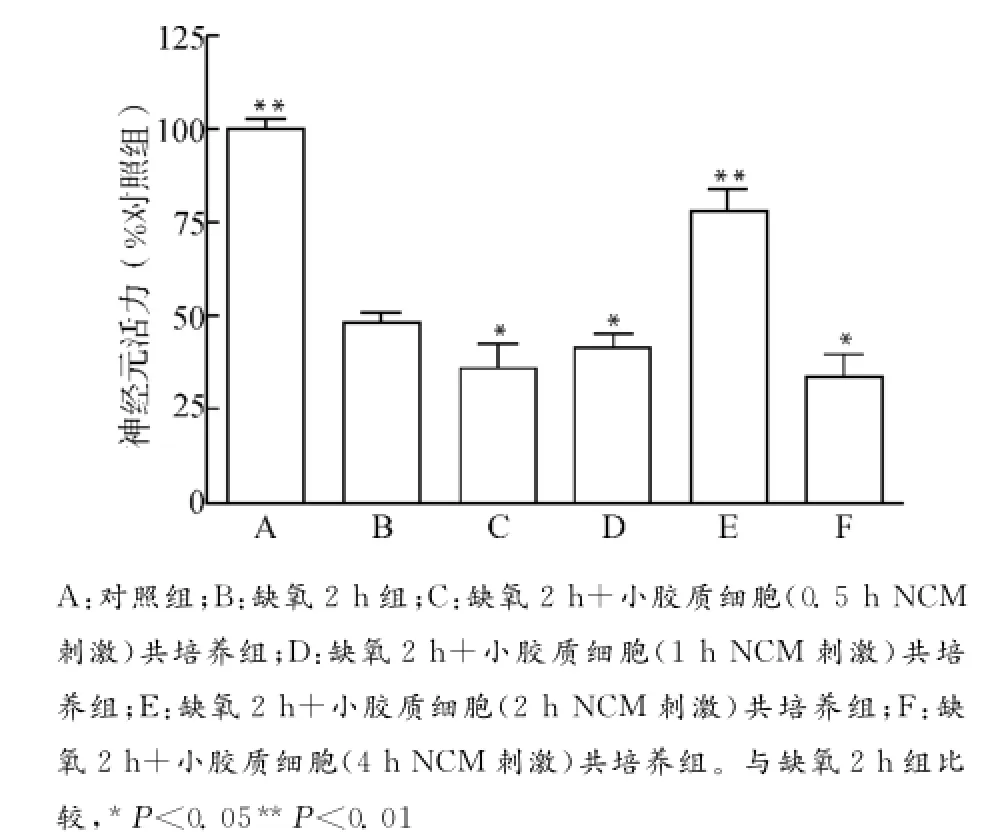
图4 不同损伤度NCM刺激的小胶质细胞对缺氧处理神经元活力的影响Fig.4 Effect of microglia treated with NCM of different severities on neuronal viability
3 讨论
许多学者认为,小胶质细胞的活化状态是多样的[6],有可能是促炎型的、抗炎型的,或者营养型的。随着研究的深入,近期有学者基于转录特点、蛋白组学和功能分析,提议将小胶质细胞划分为经典激活的M1型和选择性激活的M2型[78]。M1型的小胶质细胞,主要通过Toll样受体和干扰素-γ激活,产生促炎因子和氧化代谢物发挥促炎和组织损伤作用[910]。相反地,M2型巨噬细胞主要由白细胞介素-4或者白细胞介素-13诱导,通过清道夫受体和基质降解酶发挥抗炎作用和促进吞噬以及损伤组织修复重建,同时,它们还能促进血管再生和基质重建并且抑制过度炎症反应。本研究将神经元经缺氧处理后的条件培养液刺激小胶质细胞,然后检测与小胶质细胞表型有关的指标,结果表明小胶质细胞的抗炎和促炎表型转换依赖于神经元的损伤度,小胶质细胞能够对不同损伤度作出相应的反应。
本研究探讨神经损伤信号在没有星形胶质细胞和T细胞存在的情况下,它是如何影响小胶质细胞的表型转换。结果表明,轻度损伤的NCM刺激下调arginase-1表达水平,提示小胶质细胞向促炎的M1型转换,同时检测到促炎因子上调;中、重度损伤的NCM上调arginase-1的表达水平,提示小胶质细胞向抗炎的M2型转换,同时检测到促炎因子释放无变化,轻中度损伤的NCM刺激小胶质细胞后,小胶质细胞分别对缺氧处理神经元产生损伤和保护作用,这与小胶质细胞表型的转换一致。但是,重度损伤的NCM刺激小胶质细胞后,小胶质细胞亦加重了缺氧处理神经元的损伤,提示还有其它因素决定小胶质细胞的神经损伤或保护作用,由于神经元在损伤之后能够释放一系列的信号分子来激活小胶质细胞,其中最重要的就是神经递质,例如兴奋性的神经递质谷氨酸、ATP等,抑制性的递质γ-氨基丁酸和去甲肾上腺素等[11],可能是重度损伤的神经元大量释放某些兴奋性的递质分子,超过了小胶质细胞对这些神经毒性物质的摄取能力,从而加重神经损伤,所以仍需要进一步的实验证实。
综上所述,我们的研究从神经损伤的角度证明了其对小胶质细胞表型的影响作用。结果表明,小胶质细胞的活化状态是受多种因素影响的,例如依赖于它们作用于哪类细胞,它们接受了神经元哪种损伤程度的信号,然后作出相应的活化反应,从而呈现出不同的表型。
[1] Murray K N,Buggey H F,Denes A,et al.Systemic immune activation shapes stroke outcome[J].Mol Cell Neurosci,2013,53:14-25.
[2] Ransohoff R M,Perry V H.Microglial physiology:unique stimuli,specialized responses[J].Annu Rev Immunol,2009,27:119-145.
[3] Mitrasinovic O M,Grattan A,Robinson C C,et al.Microglia overexpressing the macrophage colony-stimulating factor receptor are neuroprotective in a microglial-hippocampal organotypic coculture system[J].J Neurosci,2005,25(17):4442-4451.
[4] Nakajima K,Kohsaka S.Microglia:neuroprotective and neurotrophic cells in the central nervous system[J].Curr Drug Targets Cardiovasc Haematol Disord,2004,4(1):65-84.
[5] Koizumi S,Shigemoto-Mogami Y,Nasu-Tada K,et al.UDP acting at P2Y6receptors is a mediator of microglial phagocytosis[J].Nature,2007,446(7139):1091-1095.
[6] Perry V H,Cunningham C,Holmes C.Systemic infections and inflammation affect chronic neurodegeneration[J].Nat Rev Immunol,2007,7(2):161-167.
[7] Colton C A.Heterogeneity of microglial activation in the innate immune response in the brain[J].J Neuroimmune Pharmacol,2009,4(4):399-418.
[8] Kigerl K A,Gensel J C,Ankeny D P,et al.Identification of two distinct macrophage subsets with divergent effects causing either neurotoxicity or regeneration in the injured mouse spinal cord[J].J Neurosci,2009,29(43):13435-13444.
[9] Gordon S.Alternative activation of macrophages[J].Nat Rev Immunol,2003,3(1):23-35.
[10] Mantovani A,Sica A,Sozzani S,et al.The chemokine system in diverse forms of macrophage activation and polarization[J].Trends Immunol,2004,25(12):677-686.
[11] Kuhn S A,van Landeghem F K,Zacharias R,et al.Microglia express GABA(B)receptors to modulate interleukin release[J].Mol Cell Neurosci,2004,25(2):312-322.
(2014-10-15 收稿)
Effect of Neuronal Injury Severity on Microglial Phenotype
Luo Zhenzhao,Wang Jing,Kong Man et al
Department of Clinical Laboratory,Wuhan Central Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430014,China
Objective To explore the effects of different severities of neuronal injury on microglial phenotype.Methods Primary neurons were treated by hypoxia for 0.5,1,2,and 4h,and then reoxygenated for 24h.Neuron-conditioned media(NCM)were collected and added to microglial cultures(1∶1volume).Twenty-four h later,Western blot was used to detect the expressions of the microglial M2phenotype marker arginase-1and the activation marker ionized calcium binding adapter molecule 1(Iba-1).Immunofluorescence was performed to detect the expression of arginase-1.Additionally,microglial trophic molecules brain-derived neurotrophic factor(BDNF),glial cell line-derived neurotrophic factor(GDNF)and proinflammatory cytokines TNF-α,IL-1β,IL-6were determined by ELISA.Finally,different phenotypes of primary microglia were formed after cells were treated with different NCM.MTT assays were used to determine the viability of neurons which were treated by hypoxia for 2hand then co-cultured with microglia for 24h.Results NCM from mild injuries(treated by hypoxia for 0.5or 1h)significantly down-regulated the expression of the microglial M2phenotype marker arginase-1,and those from moderate and severe injuries up-regulated the arginase-1expression.Iba-1was upregulated in all injury conditions,suggesting that all the injury conditions can induce microglial activation to some degree.Moreover,NCM from mild injuries up-regulated the secretion of microglial TNF-α,IL-1βand IL-6,but NCM from moderate(hypoxia 2h)and severe(hypoxia 4h)injuries had no effects on these proinflammatory cytokines.NCM of different injury severities significantly up-regulated the release of these trophic molecules.MTT assays demonstrated that microglia incubated with NCM of mild and severe injuries further exacerbated the injury of neurons treated by hypoxia.Microglia incubated with NCM of moderate injuries protected neurons from hypoxia injury.Conclusion The severity of neuronal injury is an important factor in determining microglial phenotypes,which has neurotoxic or neuroprotective effects.
microglia; cytokine; severity of neuronal injury; phenotype
R322.85
10.3870/j.issn.1672-0741.2015.01.009
*国家自然科学基金资助项目(No.31171029)
罗振钊,男,1984年生,技师,医学博士,E-mail:lzzbvy@163.com
△通讯作者,Corresponding author,E-mail:sj@mails.tjmu.edu.cn

