黄芩苷对对乙酰氨基酚诱导小鼠肝损伤中蛋白质氧化及硝化的影响*
高平章,陈金珍,李安娜,苏玉梅,高夏芳,张 旻,谢晓兰
泉州师范学院化学与生命科学学院,福建泉州 362000
黄芩苷对对乙酰氨基酚诱导小鼠肝损伤中蛋白质氧化及硝化的影响*
高平章,陈金珍,李安娜,苏玉梅,高夏芳,张 旻,谢晓兰△
泉州师范学院化学与生命科学学院,福建泉州 362000
目的 研究黄芩苷对对乙酰氨基酚(acetaminophen,AAP)诱导小鼠肝损伤的保护作用及其可能的机制。方法 采用腹腔注射AAP诱发小鼠肝损伤模型,检测血清谷丙转氨酶(ALT)、天门冬氨酸氨基转移酶(AST)活性和肝匀浆中谷胱甘肽(GSH)、超氧化物歧化酶(SOD)活性;苏木精-伊红(HE)染色观察肝脏病理形态学改变;免疫印迹法(Western blot)检测肝中羰基化蛋白(DNP)及硝化蛋白(3-NT)的表达。结果 与模型组比较,黄芩苷组血清ALT、AST活性明显低于模型组(P<0.05或P<0.01);肝匀浆SOD和GSH活性较模型组明显升高(均P<0.05);光镜下显示黄芩苷组肝脏病理损伤有所减轻,高剂量组(100mg/kg)与联苯双酯组效果相同;Western blot结果显示,随着黄芩苷剂量的增加,小鼠肝组织中分子量分别为100、45、34kD的蛋白质羰基化水平降低;分子量分别为60、37、25kD的3种蛋白质硝化程度下降。 结论 黄芩苷对AAP诱导小鼠肝损伤有保护作用,其作用机制可能与抑制肝脏蛋白质氧化和硝化有关。
黄芩苷; 对乙酰氨基酚; 肝损伤; 蛋白质氧化; 蛋白质硝化
对乙酰氨基酚(acetaminophen,AAP)是目前临床上应用最广泛的解热镇痛药物,在正常治疗剂量下服用比较安全,但过量使用会造成人和动物严重的肝损伤[1]。研究表明,活性氧(reactive oxygen species,ROS)和活性氮(reactive nitrogen species,RNS)介导的氧化应激是AAP诱导肝损伤作用机制之一[23]。ROS和RNS可以使肝中蛋白质等生物大分子受到损伤而丧失功能,羰基化蛋白质含量和硝基化蛋白质含量高低可以作为判断肝损伤程度的生物标志物[45]。
近年来,天然产物作为抗氧化剂预防AAP诱导肝损伤已引起国内外研究者的广泛关注[68]。黄芩苷(baicalin)作为中药黄芩的主要抗氧化活性成分[9],对化学性肝损伤、免疫性肝损伤以及AAP等药源性肝损伤均具有明显的保护作用[1012],然而其作用机制还有待进一步研究。迄今为止,黄芩苷对AAP诱导小鼠肝损伤中蛋白质氧化和硝化的影响尚未见相关报道。鉴于以上原因,本实验旨在通过建立AAP诱导小鼠肝损伤模型,观察黄芩苷对小鼠血清和肝组织中的生化指标、肝脏组织的结构形态、肝组织中蛋白质氧化和硝化的影响,探讨黄芩苷对AAP所致肝损伤的保护作用及作用机制,为防治AAP等药源性肝损伤提供理论依据。
1 材料与方法
1.1 材料及仪器
健康昆明种雄性小鼠,体重18~22g,动物等级为SPF级,由湖北省实验动物研究中心提供,动物合格证号为SCXF(鄂)2008-0005。黄芩苷(南京泽朗医药有限公司,纯度>98%),对乙酰氨基酚、兔多克隆抗3-NT抗体(美国Sigma公司),联苯双酯滴丸(浙江医药股份有限公司新昌制药厂),羧甲基纤维素钠(国药集团化学试剂有限公司),辣根过氧化物酶标记的羊抗兔IgG、NC膜(美国Millipore公司),ECL发光试剂(美国Thermo公司),BCA蛋白浓度测定试剂盒(北京鼎国生物技术有限公司),谷丙转氨酶(ALT)、天门冬氨酸氨基转移酶(AST)、谷胱甘肽(GSH)、超氧化物歧化酶(SOD)测定试剂盒(南京建成生物工程研究所),2,4-二硝基苯肼(DNPH)等其他试剂为国产分析纯。
主要仪器:UV752紫外可见分光光度计(上海佑科仪器仪表有限公司),TGL-16G型高速冷冻离心机(上海安亭科学仪器厂),DYCP-40C型半干式碳板转印槽、DYY-7C型电泳仪(北京市六一仪器厂),DMIL LED型倒置荧光显微成像系统(徕卡微系统股份有限公司),LAS-3000化学发光及影像分析仪(美国BioRad公司)。
1.2 实验分组及给药方法
依据文献方法[12],取60只小鼠,适应性饲养1周后,随机等分成6组:正常对照组(NC)0.5%羧甲基纤维素钠溶液灌胃;模型组(MC)0.5%羧甲基纤维素钠溶液灌胃;联合双酯组联苯双酯滴丸100 mg/kg灌胃,黄芩苷高、中、低剂量组分别以100、50、25mg/kg黄芩苷灌胃。每天给药1次,连续10 d。末次给药后禁食24h,可自由饮水。除正常对照组外,其余5组均腹腔注射400mg/kg对乙酰氨基酚制作药源性肝损伤模型。8h后,眼静脉取血后断颈处死,并迅速取肝组织冻于-80℃冰箱保存,待测相关指标。
1.3 生化指标测定
眼静脉取血后,离心制备血清。小鼠处死后取出肝脏,用肝脏右叶制备10%肝匀浆。血清ALT、AST活性及肝脏中SOD和GSH活性按试剂盒操作说明测定。
1.4 组织病理学观察
切取小鼠肝脏左叶,用10%的甲醛溶液固定,石蜡包埋、切片,苏木精-伊红染色,光镜下观察肝组织病理学变化。
1.5 免疫印迹法检测蛋白质氧化
取各组小鼠的肝匀浆50μL,加入150μL 10 mmol/L DNPH,混匀,室温摇床上反应30min,再加入200μL中和液(2mol/L三羟甲基氨基甲烷,30%丙三醇),混匀后,取100μL反应后的样品液,加25μL 5倍上样缓冲液,在冰浴上反应15min。各组取含10μg蛋白的样品经10%SDS-PAGE分离,采用半干法转至NC膜上,5%脱脂奶粉室温封闭1h。用PBS-T洗膜后,兔多克隆DNP一抗(1∶4 000)4℃孵育过夜。用PBS-T洗膜后,用辣根过氧化物酶标记的羊抗兔二抗(1∶5 000)室温孵育1 h,再用PBS-T洗膜后ECL法显色。
1.6 免疫印迹法检测蛋白质硝化
各组取含50μg蛋白肝匀浆进行10%SDSPAGE分离,半干法转至NC膜上,5%脱脂奶粉封闭1h,兔多克隆3-硝基酪氨酸一抗(1∶1 000)4℃孵育过夜。用PBS-T洗膜后,用辣根过氧化物酶标记的羊抗兔二抗(1∶4 000)室温孵育1h,再用PBS-T洗膜后,ECL法显色。
1.7 统计学处理
2 结果
2.1 黄芩苷对对乙酰氨基酚诱导肝损伤小鼠血清中ALT、AST活性的影响
由表1可知,APP模型组与正常对照组比较,血清中ALT、AST均明显增高(均P<0.05),说明小鼠肝损伤造模成功。与模型组比较,联合双酯组与黄芩苷各剂量组的ALT、AST均下降(P<0.05或P<0.01)。与联合双酯组比较,黄芩苷高剂量组的ALT有一定程度下降,但AST水平无明显变化,差异无统计学意义。这说明黄芩苷对血清ALT、AST的影响与联苯双酯作用效果相当。
表1 黄芩苷对对乙酰氨基酚诱导肝损伤小鼠血清中ALT和AST的影响,n=6)Table1 Effects of baicalin on the activities of serum ALT and AST in APP-induced liver injury in mice(,n=6)
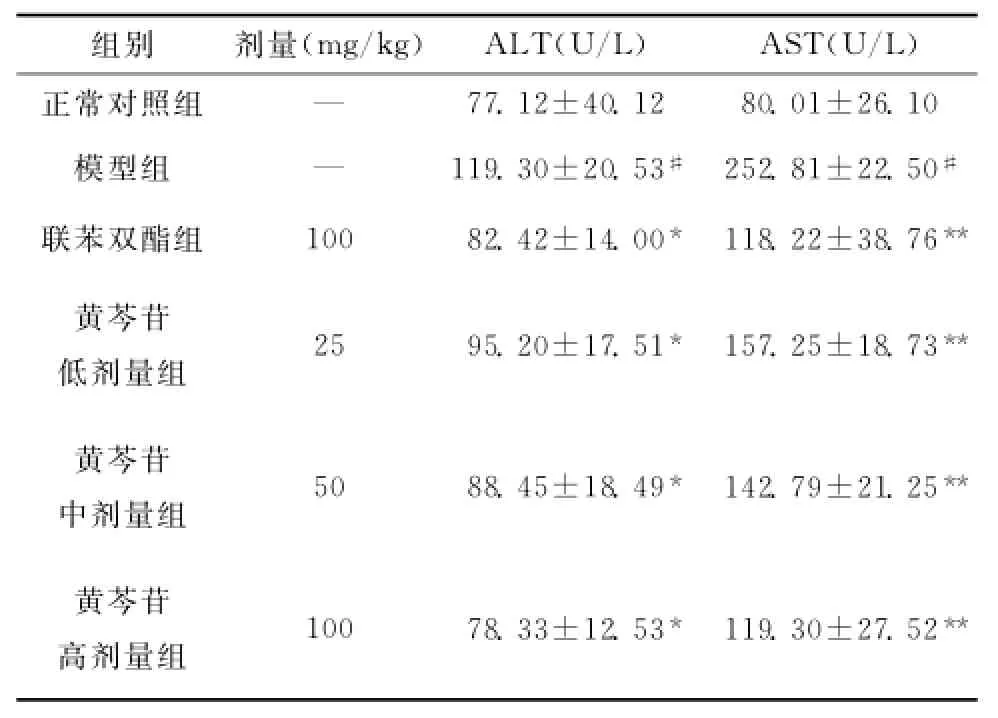
表1 黄芩苷对对乙酰氨基酚诱导肝损伤小鼠血清中ALT和AST的影响,n=6)Table1 Effects of baicalin on the activities of serum ALT and AST in APP-induced liver injury in mice(,n=6)
在造模时,模型组死亡4只小鼠,回收6个样本,故取n=6进行数据分析(后同)。与正常对照组比较,#P<0.05;与模型组比较,*P<0.05**P<0.01
?
2.2 黄芩苷对小鼠肝组织中SOD、GSH含量的影响
与正常组比较,模型组小鼠肝匀浆中SOD活性和GSH水平明显降低(P<0.05,P<0.01),这说明对乙酰氨基酚诱导肝损伤与氧化损伤有关。联苯双酯和黄芩苷明显升高小鼠肝匀浆中GSH水平和SOD活性(P<0.05),表明黄芩苷具有减少肝脏氧化损伤作用(表2)。
表2 黄芩苷对对乙酰氨基酚诱导肝损伤小鼠肝组织中SOD和GSH的影响(,n=6)Table2 Effects of baicalin on SOD and GSH in APP-induced liver injury in mice,n=6)
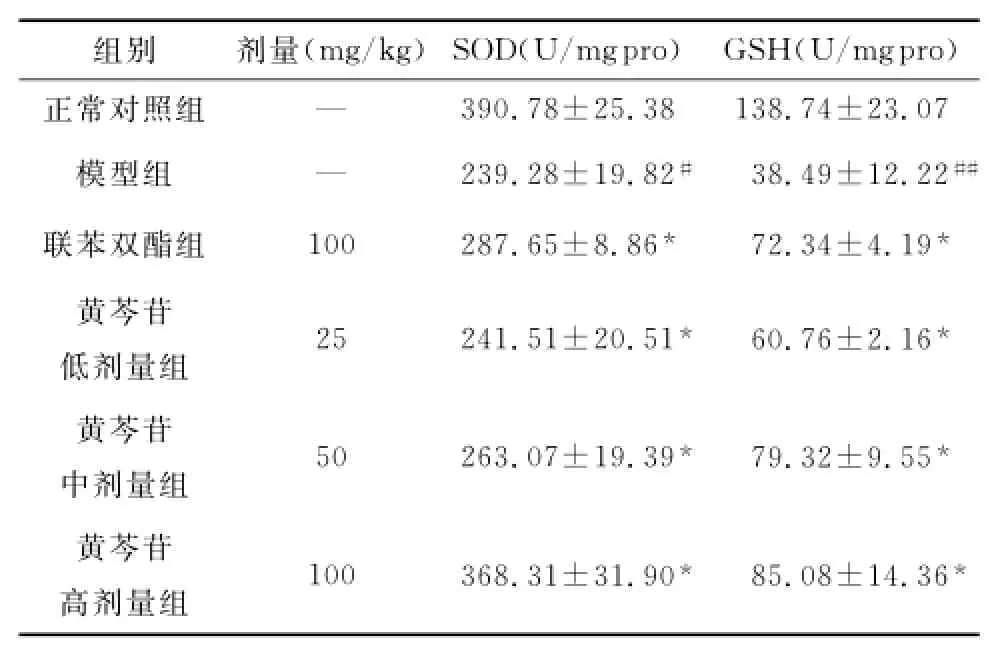
表2 黄芩苷对对乙酰氨基酚诱导肝损伤小鼠肝组织中SOD和GSH的影响(,n=6)Table2 Effects of baicalin on SOD and GSH in APP-induced liver injury in mice,n=6)
与正常对照组比较,#P<0.05##P<0.01;与模型组比较,*P<0.05
?
2.3 黄芩苷对AAP诱导肝损伤小鼠肝脏组织结构的影响
光镜下可见正常对照组小鼠肝脏无明显病理改变,肝细胞排列尚整齐,细胞分界清晰,核圆,位于细胞中间,胞质丰富,呈嗜碱性(图1A)。模型组可见肝小叶结构破坏,肝细胞肿胀明显,呈点、片状坏死,胞质可见脂肪空泡,小叶中央静脉周围和汇管区有炎细胞浸润(图1B)。联苯双酯组,中央静脉周围和汇管区炎细胞浸润明显减少,大部分细胞分界清晰,部分可见脂肪空泡(图1C)。随着黄芩苷剂量的增大,肝细胞肿胀程度减弱,点、片状坏死减少,胞质可见脂肪空泡减少,细胞分界清晰度增强。尤其黄芩苷高剂量组(100mg/kg)对肝损伤抑制程度与联苯双酯的作用效果相当(图1D~F)。
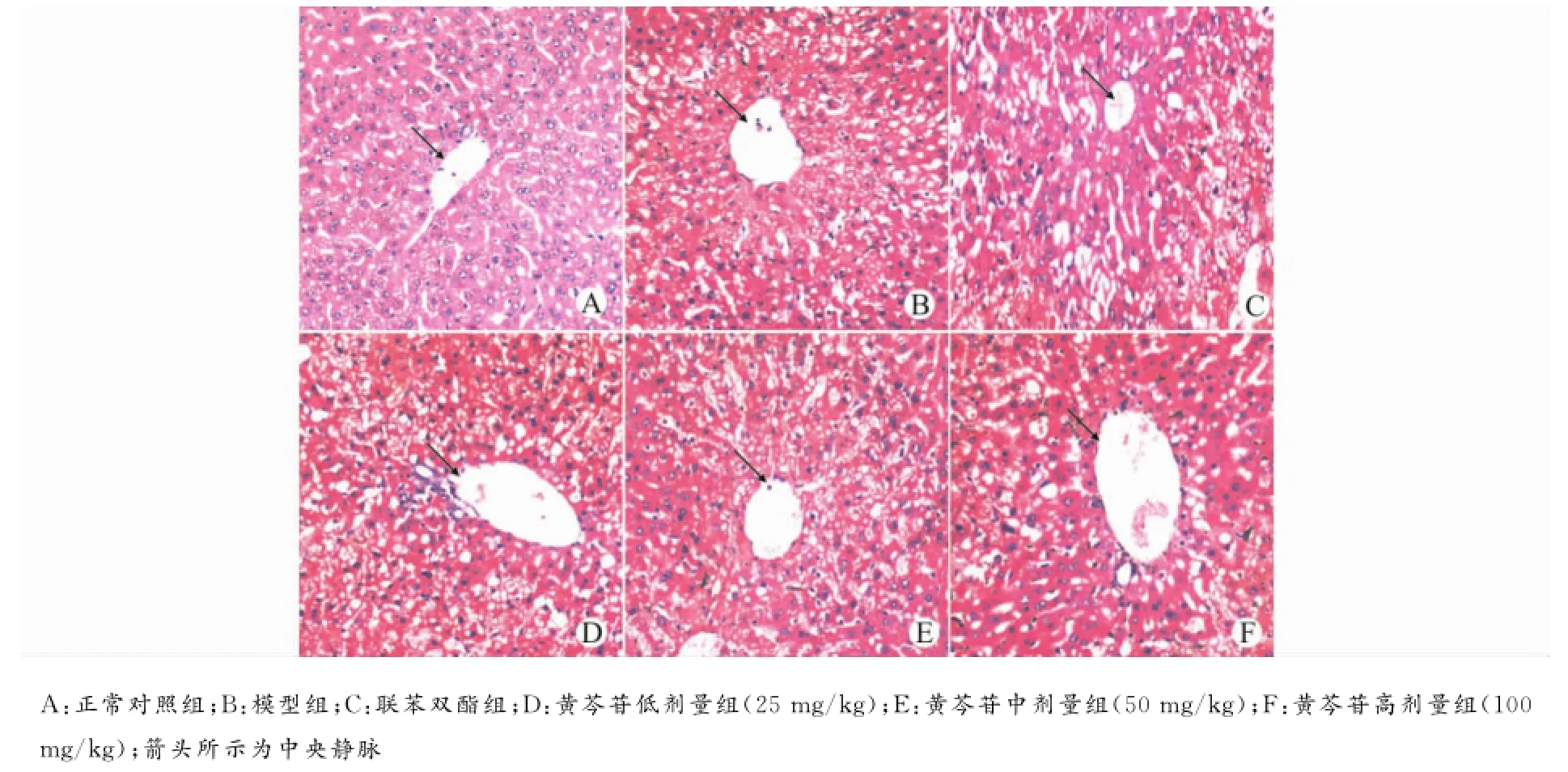
图1 黄芩苷对AAP诱导肝损伤小鼠肝脏组织结构的影响(苏木精-伊红染色,×200)Fig.1 Effects of baicalin on hepatic histopathological changes in AAP-induced liver injury in mice(HE staining,×200)
2.4 黄芩苷对AAP诱导肝损伤小鼠肝脏组织中蛋白质氧化的影响
ROS能通过各种氧化机制将蛋白质转换成羰基衍生物,后者是反映蛋白质氧化损伤的敏感指标之一。因而通过测定羰基含量可判断蛋白质是否被氧化损伤及其损伤程度。羰基含量的测定可以通过其与DNPH反应生成苯腙化合物(DNP),然后采用抗DNP抗体检测。在上样蛋白一致的情况下,与模型组比较,联苯双酯可以明显抑制肝损伤中蛋白氧化。而黄芩苷随着剂量的增大,AAP肝损伤中3种蛋白(分子量约为100、45、34kD)羰基含量也明显减少,但黄芩苷高剂量组抑制效果略差于联苯双酯组(图2)。因此,有必要进一步加大黄芩苷剂量,来观察其对蛋白质氧化的影响。
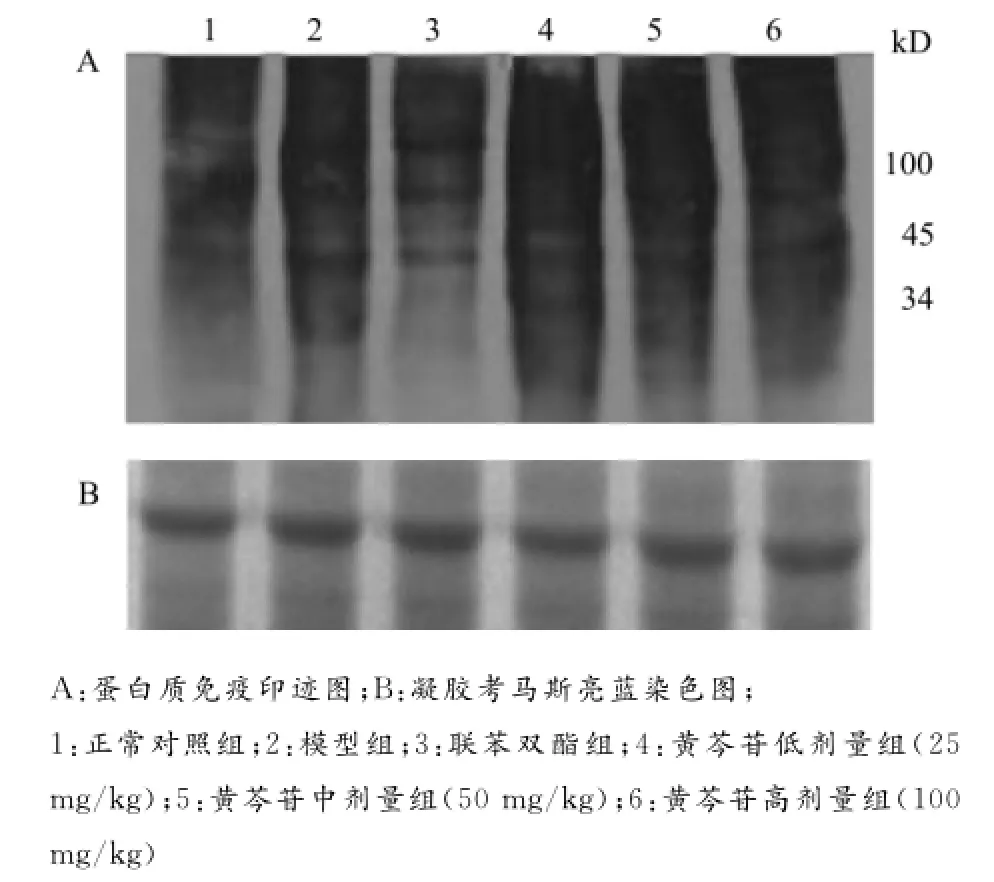
图2 黄芩苷对AAP诱导肝损伤小鼠肝脏组织中蛋白氧化的影响Fig.2 Effects of baicalin on protein oxidation in AAP-induced liver injury in mice
2.5 黄芩苷对AAP诱导肝损伤小鼠肝脏组织中蛋白质硝化的影响
蛋白质硝化是指蛋白质分子中的酪氨酸残基被RNS硝化形成3-硝基酪氨酸(3-nitrotyrosine,3-NT),也是氧化应激的产物之一。黄芩苷对AAP诱导小鼠肝损伤肝脏组织中蛋白质硝化的影响如图3所示。模型组中主要有3种蛋白质(分子量约为60、37、25kD)发生硝基化,联苯双酯组抑制效果明显。由图3A可见,黄芩苷中剂量组(50mg/kg),蛋白质硝化出现增强趋势,但是从图3B考马斯亮蓝染色结果显示该组上样蛋白也偏高。因此,从总体趋势上看,黄芩苷随着剂量的增大,AAP肝损伤中蛋白硝化受到明显的抑制。
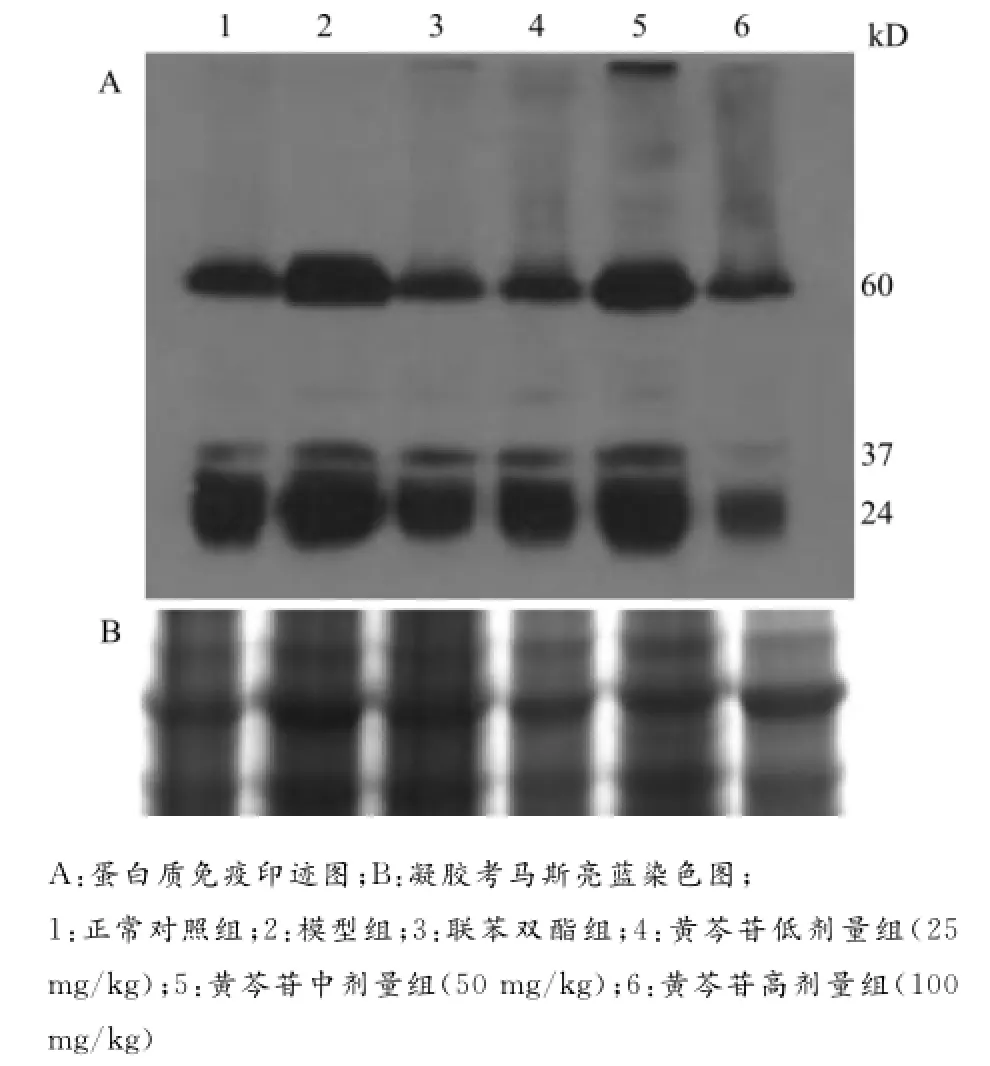
图3 黄芩苷对AAP诱导肝损伤小鼠肝组织中蛋白硝化的影响Fig.3 Effects of baicalin on protein nitration in AAP-induced liver injury in mice
3 讨论
目前认为AAP肝损伤机制是在长期或过量服用后,其代谢产物N-乙酰-对苯醌亚氨(NAPQI)耗竭完肝细胞中的GSH后,继而与线粒体和脂质膜中蛋白质共价结合,破坏线粒体功能而产生超氧阴离子()、过氧化氢(H2O2)等ROS。此外,在AAP中毒时,肝组织中诱导型NO合酶(iNOS)活性增强[13],一氧化氮(NO)的合成增加[14]。脂溶性的NO进入到线粒体内与反应生成氧化性更强的过氧亚硝基阴离子(ONOO-),这种活性氮氧化合物进而引起脂质过氧化、蛋白质氧化和硝基化,加速破坏线粒体功能,最终引起肝细胞坏死[2,5,15]。由此可见,氧化应激和蛋白质酪氨酸硝基化介导的线粒体生物大分子氧化损伤在AAP肝损伤的发生和(或)发展过程中具有重要作用。
自从中药五味子中成功开发保肝药联苯双酯后,在天然产物有效成分中筛选护肝药物已成为国内外研究热点[1617]。黄芩作为我国中医临床常用大宗药材品种之一,其有效成分黄芩苷具有较强的保肝作用。已有报道[12,18],黄芩苷对AAP诱导肝损伤具有一定防治作用,能显著增加肝组织中SOD活性及GSH水平,降低肝中丙二醛(MDA)水平,抑制细胞色素P4502E1酶活性,进一步提高组织的抗氧化能力。这可能与黄芩苷保护和稳定肝细胞膜,降低肝细胞膜通透性,减少肝内GSH消耗,减少自由基的损害、抑制肝细胞膜的脂质过氧化反应有关。本实验中,黄芩苷能明显降低AAP诱导肝损伤小鼠血清ALT、AST活性,减轻小鼠肝损伤组织病理改变,升高肝组织中抗氧化酶SOD和GSH活性,这与上述文献报道的研究结果一致。除此之外,我们还发现随着给药剂量的逐渐增大,黄芩苷可以抑制肝脏中3种蛋白质(分子量约为100、45、34kD)发生氧化,但是具体发生氧化的蛋白质种类以及氧化修饰后蛋白质功能的改变还有待利用生物质谱和生物信息学方法进一步验证。
蛋白质硝化是一种重要的蛋白质翻译后的选择性修饰。已证实,AAP诱导肝损伤与肝中的蛋白质硝化后失活密切相关[1920]。黄芩苷可以抑制体外hemin催化亚硝酸盐和过氧化氢介导的肝损伤中、铁超载肝损伤中以及酒精性肝损伤中的蛋白质硝化[2123]。但是,黄芩苷对AAP诱导肝损伤中蛋白质硝化的影响也未见有文献报道。我们实验发现,给予灌胃100mg/kg高剂量黄芩苷组,小鼠肝脏中分子量为25、37、60kD大小的3种蛋白质硝化受到显著抑制。Abdelmegeeda等[24]研究证实,AAP诱导小鼠肝损伤中P450 2E1酶活性升高,导致分子量为25kD的SOD1发生硝化而失活。此外,Agarwal课题组的研究也发现,在AAP诱导小鼠肝损伤中也是25、37、60kD 3种蛋白质发生硝基化,其中25kD的是锰超氧化物歧化酶(MnSOD)[20,25]。由此我们可以推测,抑制SOD硝化,提高肝组织的抗氧化能力是黄芩苷护肝作用的机制之一。
综上所述,黄芩苷对AAP诱导小鼠肝损伤具有保护作用,其作用机制与清除ROS和RNS、抑制氧化应激、降低肝中蛋白质氧化和抑制蛋白质硝化有关。
[1] Leise M D,Poterucha J J,Talwalkar J A.Drug-induced liver injury[J].Mayo Clin Proc,2014,89(1):95-106.
[2] Jaeschke H,Knight T R,Bajt M L.The role of oxidantive stress and reactive oxygen species in acetaminophen hepatotoxicity[J].Toxicol Lett,2003,144(3):279-288.
[3] Diesen D L,Kuo P C.Nitric oxide and redox regulation in the liver:PartⅡRedox biology in pathologic hepatocytes and implications for intervention[J].J Surg Res,2011,167(1):96-112.
[4] Sun J,Sugiyama A,Masuda A,et al.Expressions of protein oxidation markers,dityrosine and advanced oxidation protein products in acetaminophen-induced liver injury in rats[J].J Vet Med Sci,2011,73(9):1185-1190.
[5] Abdelmegeed M A,Jang S,Banerjee A,et al.Robust protein nitration contributes to acetaminophen-induced mitochondrial dysfunction and acute liver injury[J].Free Radic Biol Med,2013,60(7):211-222.
[6] 郭菁菁,杨秀芬.黄酮类化合物对动物实验性肝损伤保护作用的研究进展[J].中国药理学通报,2008,24(1):5-10.
[7] Sabir S M,Roch J B T.Antioxidant and hepatoprotective activity of aqueous extract of Solanum fastigiatum(false“Jurubeba”)against paracetamol-induced liver damage in mice[J].J Ethnopharmacol,2008,120(2):226-232.
[8] 汪德清,丁保国,马艳青,等.黄芪总黄酮对扑热息痛所致肝损伤的防护机理探讨[J].中国中药杂志2001,26(9):617-623.
[9] 高中洪,黄开勋,徐辉碧.黄芩中黄酮类生物活性的研究进展[J].中国药学杂志,1998,33(12):705-706.
[10] 王超云,傅风华,田京伟,等.黄芩苷对化学性肝损伤的保护作用[J].中草药,2005,35(5):730-732.
[11] 汪晓军,张奉学,朱宇同,等.黄芩苷对刀豆蛋白A致肝损伤小鼠肝组织NO含量的影响[J].中西医结合肝病杂志,2006,16(2):93-95.
[12] 李海燕,金向群,邸琳,等.黄芩苷预防扑热息痛所致小鼠肝损伤的研究[J].中国实验方剂学杂志,2008,14(5):50-51.
[13] Gardner C R,Heck D E,Yang C S,et al.Role of nitric oxide in acetaminophen induced hepatotoxicity in the rat[J].Hepatology,1998,27(3):748-754.
[14] Hinson J A,Pike S L,Pumford N R,et al.Nitrotyrosine protein adducts in hepatic centrilobular areas following toxic doses of acetaminophen in mice[J].Chem Res Toxicol,1998,11(6):604-617.
[15] James L P,Mayeux P R,Hinson J A.Acetaminophen-induced hepatotoxicity[J].Drug Metab Dispos,2003,31(12):1499-1056.
[16] Wang R B,Kong J,Wang D L,et al.A survey of Chinese herbal ingredients with liver protection activities[J].Chin Med,2007,2(1):5-13.
[17] Jaeschke H,McGill M R,Williams C D,et al.Current issues with acetaminophen hepatotoxicity-A clinically relevant model to test the efficacy of natural products[J].Life Sci,2011,88(17/18):737-745.
[18] Jang S I,Kim H J,Hwang K M,et al.Hepatoprotective effect of Baicalin,a major flavone fromscutellaria radix,on acetaminophen-induced liver injury in mice[J].Immunopharmacol Immunotoxicol,2003,25(4):585-594.
[19] Hinson J A,Michael S L,Ault S G,et al.Western blot analysis for nitrotyrosine protein adducts in livers of saline-treated and acetaminophen-treated mice[J].Toxicol Sci,2000,53(2): 467-473.
[20] Agarwal R,MacMillan-Crow L A,Rafferty Tonya M,et al.Acetaminophen-induced hepatotoxicity in mice occurs with inhibition of activity and nitration of mitochondrial manganese superoxide dismutase[J].J Pharmacol Exp Ther,2011,337(1):110-116.
[21] Zhao Y L,Li H L,Gao Z H,et al.Effects of flavonoids extracted from Scutellaria baicalensis Georgi on hemin-nitrite-H2O2induced liver injury[J].Eur J Pharmacol,2006,536(1/2):192-199.
[22] Zhang Y,Huang Y,Deng X R,et al.Iron overload-induced rat liver injury:Involvement of protein tyrosine nitration and the effect of baicalin[J].Eur J Pharmacol,2012,680(1-3):95-101.
[23] Xu Y,Feng Y C,Li H L,et al.Ferric citrate CYP2E1-independently promotes alcohol-induced apoptosis in HepG2cells via oxidative/nitrative stress which is attenuated by pretreatment with baicalin[J].Food Chem Toxicol,2012,50(9): 3264-3272.
[24] Abdelmegeeda M A,Moon K,Chen C,et al.Role of cytochrome P450 2E1in protein nitration and ubiquitin-mediated degradation during acetaminophen toxicity[J].Biochem Pharmacol,2010,79(1):57-66.
[25] Agarwal R,Hennings L,Rafferty T M,et al.Acetaminopheninduced hepatotoxicity and protein nitration in neuronal nitricoxide synthase knockout mice[J].J Pharmacol Exp Ther,2012,340(1):134-142.
(2014-07-16 收稿)
Effects of Baicalin on Protein Oxidation and Nitration in Acetaminophen-induced Liver Injury in Mice
Gao Pingzhang,Chen Jinzhen,Li Anna et al
College of Chemistry and Life Science,Quanzhou Normal University,Quanzhou 362000,China
Objective To investigate the protective effect of baicalin on acetaminophen-induced liver injury of mice and the possible mechanisms.Methods Mouse models of liver injury were obtained by intraperitoneal injection with acetaminophen.Activities of alanine aminotransferase(ALT),aspartate aminotransferase(AST)in the serum and the levels of glutathione(GSH)and superoxide dismutase(SOD)in liver homogenates were assayed with related reagent kits.Histopathological changes were observed by using hematoxylin and eosin(HE)staining.Protein carbonyl levels and protein nitration levels in the liver tissues were detected by Western blot.Results The activities of ALT and AST in baicalin treatment group were markedly lower than those in model group(P<0.05and P<0.01,respectively).Treatment with baicalin significantly increased SOD and GSH activities in liver homogenates compared with model group(P<0.05).Light microscopy showed that the pathological changes of the liver were alleviated in baicalin treatment group and the effect of high-dose(100mg/kg)baicalin was similar to that of bifendate.Western blot results showed that baicalin had a good inhibitory effect on protein oxidation and nitration in acetaminophen-induced liver injury.With the dose of baicalin increasing,the protein carbonyl levels of three protein(100,45and 34kD,respectively)and protein nitration levels of three protein(60,37and 25kD,respectively)were decreased.Conclusion Baicalin has protective effects on acetaminophen-induced liver injury.The mechanism may be partially due to the inhibition of protein oxidation and nitration in the liver.
baicalin; acetaminophen; liver injury; protein oxidation; protein nitration
R657.3
10.3870/j.issn.1672-0741.2015.01.012
*国家自然科学基金资助项目(No.30670481;31302190);国家大学生创新创业训练计划项目(No.201410399008);福建省教育厅科技项目(No.JA13266);泉州市科技计划项目(No.2011Z24)
高平章,男,1980年生,医学博士,讲师,E-mail:gaopingzhang@126.com
△通讯作者,Corresponding author,E-mail:xxl_qztc@sohu.com

