CYP2C9及VKORC1基因多态性对华法林稳态剂量和模型预测剂量的相关性研究*
陈晓英,彭 齐,胡大清,何 蕾
武汉亚洲心脏病医院心外科,武汉 430022
CYP2C9及VKORC1基因多态性对华法林稳态剂量和模型预测剂量的相关性研究*
陈晓英,彭 齐△,胡大清,何 蕾
武汉亚洲心脏病医院心外科,武汉 430022
目的 研究湖北地区汉族人性别、年龄、身高、体重、细胞色素P450酶2C9基因(CYP2C9)和维生素K环氧化物还原酶复合体亚单位1(VKORC1)基因型与华法林稳态剂量及计算机模型预测剂量的相关性。方法 收集湖北地区汉族人群临床使用华法林的患者,采用聚合酶链反应-限制性内切酶片段长度多态性(PCR-RFLP)技术检测CYP2C9和VKORC1基因型,同时记录患者的年龄、性别、体重、身高、国际标准化比值(INR)、华法林稳态剂量和计算机模型预测剂量等临床资料,并对这些临床资料进行相关分析及多元回归分析。结果 435例患者的CYP2C9基因型检测显示402例为*1/*1型(92.41%)、30例为*1/*3型(6.90%)、3例*3/*3型(0.69%)。前两型患者华法林剂量分别为(2.91 ±1.12)mg/d、(1.91±0.85)mg/d,*1/*3型较*1/*1型华法林需求量少,差异有统计学意义(P<0.01)(CYP2C9基因型*3/*3型样本量太少,未参与组间比较);VKORC1基因型检测显示354例为AA型(81.4%)、77例为杂合子GA型(17.7%)、4例为纯合子GG型(0.9%)。患者华法林剂量分别为(2.58±0.94)mg/d、(3.82±1.52)mg/d、(5.62± 1.77)mg/d,AA型较GA型华法林需求量少,两组间比较差异有统计学意义(P<0.01)(VKORC1基因型GG型样本量太少,未参与组间比较)。同时对患者的年龄、身高、体重、两种基因型、稳态剂量以及计算机模型预测剂量均分别行相关分析及多元回归分析,提示华法林剂量与患者的年龄、身高、体重及不同的基因型均有关,且相关分析提示计算机模型预测剂量与稳态剂量的相关系数为0.611,且有统计学意义;行稳态剂量的多元回归分析显示CYP2C9、VKORC1基因型、年龄、体重与稳态剂量相关,有统计学意义。结论 在湖北地区汉族人群中,存在CYP2C9和VKORC1基因多态性,且不同基因型患者间华法林用量存在差异,同时华法林剂量与年龄、体重及不同的基因型有关,计算机模型预测剂量与稳态剂量存在相关性且有统计学意义。
华法林; 剂量; 基因多态性; CYP2C9; VKORC1
为防止心脏瓣膜置换手术后血栓形成或栓塞发生需口服华法林抗凝治疗[12],但口服华法林抗凝需要监测国际标准化比值(INR),由于个体间细胞色素P450酶2C9基因(CYP2C9)和维生素K环氧化物还原酶复合体亚单位1基因(VKORC1)多态性的存在[12],使华法林剂量个体差异明显,要达到相同的抗凝效果,剂量差别极大[2],即使INR值在目标范围内仍有部分患者出现出血并发症。目前新型的、抗凝作用肯定、剂量固定、无需监测凝血指标的口服抗凝剂达比加群酯在非瓣膜病心房颤动患者的抗凝治疗中逐渐被认可[34]。但在心脏机械瓣膜置换术后患者中的应用尚未见研究报道,因此,目前口服华法林仍然是心脏瓣膜置换术后抗凝的标准治疗。本文旨在研究湖北地区汉族人群中CYP2C9和VKORC1的基因多态性、患者的临床特征和不同的基因型对华法林剂量的影响及华法林稳态剂量与模型预测剂量的相关性。
1 资料与方法
1.1 研究对象
收集2012年3月至2013年6月在武汉亚洲心脏病医院心外科行心脏瓣膜置换术患者435例。入选标准:湖北省内18岁以上汉族人(相互间无血缘关系及异族通婚史)、术后口服华法林抗凝、INR控制在2.0~3.0之间。剔除标准:肝、肾及甲状腺功能异常;服用利福平及巴比妥等影响华法林药动学效果的药物;服用阿司匹林、氯吡格雷、肝素及维生素K等影响INR的药物。
1.2 研究方法
1.2.1 资料采集收集 取入选受试者的静脉血(枸橼酸钠抗凝)3mL用于检测INR值、CYP2C9以及VKORC1基因型。同时记录患者的年龄、性别、体重、身高、INR、华法林稳态剂量和计算机模型预测剂量等临床资料。
1.2.2 方法 从血液中提取患者DNA,扩增目的片段,再进行测序。DNA提取采用TIANGEN血液基因组提取试剂盒,测序仪为美国ABI 3500Genetic Analyzer。采用国际华法林药理学联盟(IWPC:International Warfarin Pharmacogenetics Consortium)建立的华法林剂量预测模型来预测华法林剂量,该模型是联合9个国家的21个研究小组,收集了用华法林治疗的超过4 000例患者(亚洲人种1 200余例)的临床和遗传学数据而建立,模型中纳入了遗传因素以及临床因素。这个模型是目前最权威的两个华法林剂量预测模型之一[5]。
1.3 统计学分析
采用SPSS 17.0统计软件,Pearsonχ2检验用于检查基因型频率是否符合Hardy-Weinberg遗传平衡定律。分析华法林剂量与年龄、身高、体重以及INR值的关系及CYP2C9、VKORC1基因型之间华法林剂量的比较使用两样本t检验。多元线性回归用于分析华法林剂量与各变量之间的关系。采用双侧检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 不同基因型患者的临床资料及稳态剂量的比较
435例患者的CYP2C9基因型检测显示402例为*1/*1型(92.41%)、30例为*1/*3型(6.90%)、3例*3/*3型(0.69%)。患者华法林剂量分别为(2.91±1.12)mg/d、(1.91±0.85)mg/d,*1/*3型较*1/*1型华法林需求量少,差异有统计学意义(P<0.01)(表1,CYP2C9基因型*3/*3型样本量太少,未参与组间比较);VKORC1基因型检测显示354例为AA型(81.4%)、77例为杂合子GA型(17.7%)、4例为纯合子GG型(0.9%)。患者华法林剂量分别为(2.58±0.94)mg/d、(3.82± 1.52)mg/d、(5.62±1.77)mg/d,AA型较GA型华法林需求量少,两组间比较差异有统计学意义(P<0.01)(表1,VKORC1基因型GG型样本量太少,未参与组间比较)。
2.2 患者稳态剂量的相关因素分析
分别对年龄、性别、身高、体重、两种基因型与稳态剂量进行直线相关分析,显示华法林剂量与患者的年龄、身高、体重及VKORC1与CYP2C9基因型有关(其相关系数分别为-0.266,0.232,0.228,0.450,-0.227),且相关分析同时提示模型预测剂量与稳态剂量的相关系数为0.611,差异有统计学意义;同时纳入患者年龄、身高、体重、2种基因型,行稳态剂量的多元回归分析显示CYP2C9、 VKORC1基因型、年龄、体重有统计学意义(表2)。
表1 CYP2C9与VKORC1基因型患者的临床资料及稳态剂量的比较()Table1 Comparison of clinical data and stable warfarin dose between patients with different CYP2C9and VKORC1genotypes
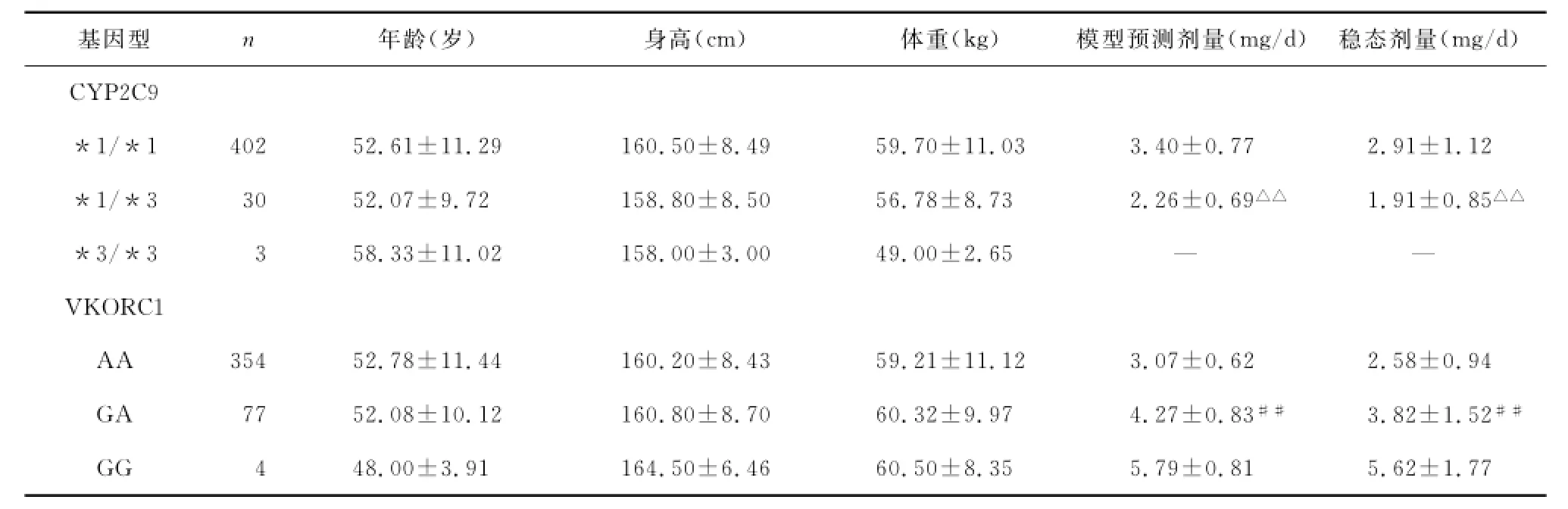
表1 CYP2C9与VKORC1基因型患者的临床资料及稳态剂量的比较()Table1 Comparison of clinical data and stable warfarin dose between patients with different CYP2C9and VKORC1genotypes
与*1/*1比较,△△P<0.01;与AA比较,##P<0.01
?
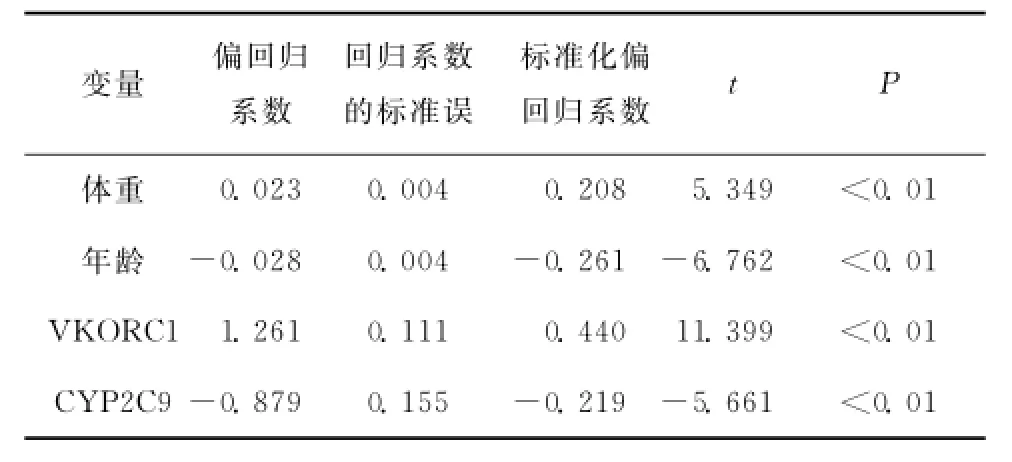
表2 患者稳态剂量多元回归分析Table2 Multivariate regression analysis on the factors related to stable warfarin dose in patients
3 讨论
口服华法林抗凝临床适用范围广,目前主要用于瓣膜病合并房颤或者瓣膜置换手术后患者、深静脉血栓形成患者、肺栓塞患者、脑梗死患者、房颤患者、心肌梗死后心尖部血栓形成患者等。但其剂量在不同种族间及个体间存在较大差异,影响华法林剂量的因素中,个体因素包括种族、遗传、性别、年龄、身高、体重等;临床因素主要表现在药物间相互作用,例如:胺碘酮、利福平及巴比妥等药物影响华法林药代动力学;阿司匹林、氯吡格雷、肝素及维生素K等药物影响凝血功能[6]。其中遗传因素可解释约40%~74%的个体剂量差异[7]。目前研究发现,VKORC1和CYP2C9基因与华法林药效学和药代学相关。在药效学方面,VKORC1基因启动子区-1 639位基因G突变为A后转录活性下降,其基因多态性影响华法林临床用药剂量;在药代学方面,CYP2C9是CYP2C亚家族中的一种同功酶,也是许多药物的重要代谢酶,约占肝微粒体中CYP总量的20%,其基因多态性会影响代谢酶活性,特别是存在基因突变的个体药物不良反应的发生率更高[8-9]。
本研究探讨了湖北地区汉族人群中CYP2C9和VKORC1的基因多态性、患者的临床特征和不同的基因型对华法林剂量的影响及华法林稳态剂量与模型预测剂量的相关性。
本研究选取2012年3月至2013年6月在我院心外科行心脏机械瓣膜置换术的湖北地区汉族患者435例,CYP2C9基因型检测显示402例为*1/*1型、30例为*1/*3型、3例*3/*3型,以等位基因A为主,其基因型频率分别为92.41%、6.90%、0.69%,与文献报道的国人的基因型频率一致[1011]。Aquilante等[12]的研究提示在西方人群中CYP2C9的等位基因同样是以A为主(其基因型频率为79.80%~95.30%),说明其等位基因分布未显示存在人种差异。本研究中VKORC1基因型检测354例为AA型、77例为杂合子GA型、4例为纯合子GG型,以AA型居多,其基因型频率分别为81.4%、17.7%、0.9%,与文献报道的国人的基因型频率一致[1011]。同时有文献报道,在高加索人和非洲裔美国人中VKORC1基因以GG、GA型占大多数(GG型的基因型频率为38.44%~79.57%,GA型的基因型频率为19.27%~47.12%)[13],提示在不同种族间VKORC1基因多态性分布存在人种差异。
在湖北地区汉族人群中,存在CYP2C9和VKORC1基因多态性,且本研究同样提示CYP2C9和VKORC1的基因多态性是造成个体间华法林稳态剂量差异的主要原因[1112]。具体表现为CYP2C9*1/*3型较*1/*1型华法林需求量少,这与突变型的CYP2C9*1/*3型比野生型*1/*1型对华法林的代谢能力下降有关[12]。VKORC1基因位于16号染色体,含3个外显子,编码163个氨基酸的18kD内质网跨膜蛋白,此蛋白质主导维生素K依赖性凝血因子的生成,是华法林的作用靶点。VKORC1基因启动子区-1 639G>A多态性与华法林临床用药剂量相关,AA基因型华法林需求较GA型和GG型低[13]。
影响华法林剂量的因素主要有遗传因素以及身高、体重、年龄、性别、种族、药物相互作用等[14]。本研究中,对患者的年龄、身高、体重、两种基因型、稳态剂量以及计算机模型预测剂量均分别行相关分析,结果提示华法林剂量与患者的年龄、身高、体重及不同的基因型均有关,行多元回归分析显示稳态剂量与CYP2C9、VKORC1基因型、年龄、体重均有关,有统计学意义。本研究中性别未显示出相关性,可能与样本量有关,我们将在以后的研究中进一步关注此问题。
我们采用的预测模型中纳入了遗传因素以及临床因素。其计算机模型中包含患者年龄、身高、体重、不同类型的CYP2C9和VKORC1基因型(包括未知基因型)、不同人种、酶诱导剂状况和胺碘酮用药状况等因素,能够准确地估计华法林的剂量。本研究相关分析提示此计算机模型预测剂量与实际稳态剂量的相关系数为0.611,且有统计学意义,说明该模型应用于湖北地区汉族人群的华法林剂量预测是准确可行的,可以降低治疗引导阶段华法林过量的风险,并缩短华法林达到稳定治疗的时间。
华法林的应用范围不只限于心脏瓣膜置换术后,在肺栓塞、持续性心房颤动及反复静脉血栓形成、心肌梗死后心尖部血栓形成的患者中亦需要口服华法林抗凝,同时需要控制INR在目标范围,而反复的抽血检测及调整亦带来诸多不便。我院目前对临床需要口服华法林的患者进行基因型检测,通过基因分型及计算机剂量模型预测华法林剂量,以指导临床选择合适的华法林剂量并尽量缩短药物剂量的调整周期,希望能藉此减少对患者反复抽血检测以及降低患者血栓和出血的风险。
[1] Wadelius M,Chen L Y,Lindh J D,et al.The largest prospective Warfarin-treated cohort supports genetic forecasting[J].Blood,2009,113(4):784-792.
[2] 高菲,宋洪涛,曾志勇,等.CYP2C9和VKORC1基因多态性对心脏瓣膜置换术后华法林维持剂量和抗凝效果的影响[J].中国药房,2010,21(21):2053-2057.
[3] Huber K,Connolly S J,Kher A,et al.Practical use of dabigatran etexilate for stroke prevention in atrial fibrillation[J].Int J Clin Pract,2013,67(6):516-526.
[4] 中华心血管病杂志编辑委员会血栓栓塞防治循证工作组.达比加群酯用于非瓣膜病心房颤动患者卒中预防的临床应用建议[J].中华心血管病杂志,2014,42(3):188-192.
[5] Ansell J,Hirsh J,Hylek E,et al.Pharmacology and management of the vitamin K antagonists American College of Chest Physicians Evidence-Based Clinical Practice Guidelines(8thE-dition)[J].Chest,2008,133(Suppl.6):160S-198S.
[6] Loebstein R,Yonath H,Peleg D,et al.Interindividual variability in sensitivity to warfarin-nature or nurture?[J].Clin Pharmacol Ther,2001,70(2):159-164.
[7] Wang T L,Li H L,Tjong W Y,et al.Genetic factors contribute to patient-specific warfarin dose for Han Chinese[J].Clin Chim Acta,2008,396(1):76-79.
[8] Cha P C,Mushiroda T,Takahashi A,et al.Genome-wide association study identifies genetic determinants of warfarin responsiveness for Japanese[J].Hum Mol Genet,2010,19(23): 4735-4744.
[9] Takeuchi F,Mcginnis R,Bourgeois S,et al.A genome-wide association study confirms VKORC1,CYP2C9,and CYP4F2 as principal genetic determinants of warfarin dose[J].PLoS Genetics,2009,5(3):e1000433.
[10] Miao L,Yang J,Huang C,et al.Contribution of age,body weight,and CYP2C9and VKORC1genotype to the anticoagulant response to warfarin:proposal for a new dosing regimen in Chinese patients[J].Eur J Clin pharmacol,2007,63(12): 1135-1141.
[12] Aquilante C L,Langaee T Y,Lopez L M,et al.Influence of coagulation factor,vitamin K epoxide reductase complex subunit 1,and cytochrome P450 2C9gene polymorphisms on warfarin dose requirements[J].Clin Pharmacol Ther,2006,79(4):291-302.
[13] Limdi N A,Wadelius M,Cavallari L,et al.Warfarin pharmacogenetics:a single VKORC1polymorphism is predictive of dose across 3racial groups[J].Blood,2010,115(18):3827-3834.
[14] Chern H D,Ueng T H,Fu Y P,et al.CYP2C9polymorphism and warfarin sensitivity in Taiwan Chinese[J].Clin Chim Acta,2006,367(1):108-113.
(2014-10-10 收稿)
Correlation of CYP2C9 and VKORC1 Polymorphisms with Warfarin Stable Dose and Computer Model-predicted Dose
Chen Xiaoying,Peng Qi△,Hu Daqing et al
Department of Cardiac Surgery,Wuhan Asia Heart Hospital,Wuhan 430022,China
Objective To investigate the association of gender,age,height,body weight,cytochrome P450 2C9(CYP2C9)and vitamin K epoxide reductase complex 1(VKORC1)genotypes with warfarin stable dose and computer model-predicted dose in Han population in Hubei province of China.Methods CYP2C9and VKORC1genotypes were determined by polymerase chain reaction-restriction fragment length polymorphism(PCR-RFLP)technique in patients who were Han Chinese and administered with stable warfarin dose.Their clinical data including age,gender,body weight,height,international normalised ratio(INR),warfarin stable dose and computer model-predicted dose were recorded and analyzed by correlation analysis and multivariate regression analysis.Results CYP2C9genotyping showed that there were 402cases of*1/*1type,30of*1/*3type and 3of*3/*3type.The required warfarin dose was much lower in patients with CYP2C9*1/*3type than those with*1/*1type[(1.91±0.85)mg/d vs.(2.91±1.12)mg/d]with significant difference found(P<0.01).Comparison between groups didn't include patients with*3/*3type due to the limited samples.VKORC1genotyping showed that the frequencies of AA,GA,GG were 81.4%(354/435),17.7%(77/435)and 0.9%(4/435),respectively.The required warfarin dose in VKORC1 AA patients was significantly lower than that in GA patients[(2.58±0.94)mg/d vs.(3.82±1.52)mg/d],with statistically significant difference found(P<0.01).VKORC1GG patients[warfarin dose:(5.62±1.77)mg/d]failed to enter the statistical analysis because of less sample size.Correlation analysis and multivariate regression analysis showed that age,body weight,CYP2C9and VKORC1genotypes were related to warfarin dose.The correlation coefficient of warfarin stable dose and predicteddose was 0.611,and these was statistically significant difference(P<0.01).Multivariate regression analysis showed that there was statistical association between the warfarin stable dose and CYP2C9genotype,VKORC1genotype,age or body weight.Conclusion There are CYP2C9and VKORC1polymorphisms in Han Chinese in Hubei province.There is a significant difference in daily mean warfarin dose between patients with different genotypes of CYP2C9and VKORC1.The warfarin dose is related to age,body weight,CYP2C9and VKORC1genotypes.There is a statistical correlation between warfarin stable dose and computer model-predicted dose.
warfarin; dosing regimen; gene polymorphism; CYP2C9; VKORC1
R969
10.3870/j.issn.1672-0741.2015.01.018
*武汉市卫计委临床医学科研项目(No.WX13B28)
陈晓英,女,1975年生,副主任医师,医学硕士,E-mail:908230364@qq.com△
,Corresponding author,E-mail:pq_0511@163.com

