诸氏鲻虾虎鱼致病性创伤弧菌的分离与鉴定
余露军,蔡 磊,陈小曲,叶惠欣,李建军
(广东省实验动物监测所 广东省实验动物重点实验室,广东广州510663)
弧菌广泛分布于近海及河口的海洋环境,能引起多种鱼类、虾、贝类等水生动物的暴发性疾病,是海水水产养殖动物中危害最大的一类细菌性病原。其中大部分为人兽共患病病原,尤以霍乱弧菌、副溶血性弧菌(Vibrioparahaemolyticus)、创伤弧菌(Vibriovulnificus)最为重要[1]。诸氏鲻虾虎鱼(Mugilogobiuschulae)属于鲈形目(Perciformes),虾虎鱼亚目(Gobioidei),虾虎鱼科(Gobiidae),鲻虾虎鱼属(Mugilogobius),为暖水性底层小型鱼类,栖息于河口、咸淡水水域中,具有体形小、繁殖周期短、对许多毒物敏感性强的特点[2],作为一种海洋水生实验动物,已开展海洋污染物的相关毒性评价[3-4],但对其病害的研究尚未见报道。疾病问题一直是实验动物养殖过程中关注的焦点,鱼类实验动物病害在研究中可引起大量的死亡,因此,开展诸氏鲻虾虎鱼病原的研究对其质量控制尤为重要。
2014年8月,广东省实验动物重点实验室对诸氏鲻虾虎鱼疾病情况进行了调查,从番禺南沙采样的诸氏鲻虾虎鱼在暂养过程中发生病害,病鱼主要症状为腹部红肿,甚至溃烂,腹腔积液。分别从病鱼的肝脏组织中分离得到1株优势菌,对分离菌株的生物学性状、HSP60基因序列系统发育及其毒力基因进行研究,以期了解创伤弧菌对诸氏鲻虾虎鱼的致病性,为诸氏鲻虾虎鱼病原微生物的控制提供参考。
1 材料与方法
1.1 材料
1.1.1 试验用鱼 发病诸氏鲻虾虎鱼采自番禺南沙。人工感染用的试验鱼:广东省实验动物重点实验室内繁殖的子9代封闭群诸氏鲻虾虎鱼(4月龄~5月龄),半静态方式养殖,体长24mm~30mm,水质条件为盐度25±2,温度26℃±2℃,光周期14 h∶10h(光照∶黑暗)。
1.1.2 主要试剂和仪器 TCBS、TSA培养基,北京陆桥技术有限责任公司产品,用于弧菌的分离培养和纯化;细菌基因组DNA提取试剂盒,天根生化科技有限公司产品;Taq酶、PCR反应相关试剂、琼脂糖凝胶纯化等相关试剂,宝生物工程(大连)有限公司产品;其余试剂均为国产分析纯试剂;PCR扩增仪(Mastercycler),Eppendorf公司产品;电泳仪、凝胶成像分析系统,美国BIO-RAD公司产品;ATB系统细菌自动鉴定仪,法国Biomerieux公司产品。
1.2 方法
1.2.1 病原菌的分离、纯化与生化鉴定 从患病鱼肝脏组织取样,划线接种于TSA琼脂平板上,28℃培养24h后,挑选优势菌菌落在TCBS平板上划线纯化培养,用于进行生物学性状、生理生化分析、分子鉴定和人工感染试验。选取纯化分离菌株菌落,观察菌落特征,经革兰染色、氧化酶等试验后,采用ATB细菌半自动鉴定仪(API ID32E)进行细菌生化鉴定。
1.2.2 分离菌株回归感染 纯化培养的分离菌株,用8.5g/L无菌生理盐水洗涤,配制成悬液。在预试验的基础上,麦氏比浊法分别稀释成5个浓度梯度(表1),腹腔注射健康诸氏鲻虾虎鱼。注射剂量20μL/尾,10尾/组,同时设生理盐水对照组。试验期间水温28℃~30℃,观察和记录试验鱼的症状和死亡情况,连续观察10d,SPSS17.0计算LD50。从感染出现症状的病鱼中再次分离菌株并进行感染试验。
1.2.3 弧菌HSP60基因序列测定分析和hemo毒力基因检测 纯化培养的分离菌株,按照DNA提取试剂盒说明书提取细菌基因组DNA。弧菌HSP60基因[5]扩增的引物为 P1:ACA ACA GCA ACG GTA CTA GC,P2:CAA CTT TCA CGA TGC CAC;根据GenBank登录的创伤弧菌hemo基因设计毒力检测基因,Hemo1:5′-GGA GCT GAG TAT CCC TGC TGT G-3′,Hemo2:5′-GAT TTG TGA CTT ATC GTC CGA A-3′,引物由上海生工生物工程技术服务有限公司合成。以提取的DNA为模板,PCR反应条件为:95℃4min;94℃30s,55℃45s,72℃1min,30个循环;72℃延伸10min。HSP60产物回收纯化后,送上海生工生物工程技术服务有限公司测序。
获得的HSP60序列采用Blast进行相似性比对。根据比较的结果,采用MEGA4软件,进行系统发育树的构建,自举数集1 000。
2 结果
2.1 分离菌株形态特征和生理生化指标
分离菌株PYMc14-2在TCBS培养基28℃培养24h后,菌落呈绿色菌落,革兰阴性,杆菌,对弧菌抑制剂O/129(50μg/片)敏感,氧化酶阳性,葡萄糖发酵型,符合弧菌属特征。经API系统鉴定菌株PYMc14-2为创伤弧菌(%id=99.9/T=0.49),试剂条显示为非常好的鉴定结果,生化结果见表2。
2.2 分离菌株回归感染试验
分离菌株PYMc14-2回归感染试验结果见表1。结果显示,菌株PYMc14-2对诸氏鲻虾虎鱼具有致病性,LD50为2.4×104CFU/尾。接种后3d出现死亡高峰,严重感染的鱼出现与自然发病相似的症状,鳍条、腹部充血发红,甚至溃烂,腹水。对照组在10d内无死亡。从感染后症状明显的病鱼再次分离细菌,与原感染菌形态、生化特征完全相同,并再次感染成功,证实所分离的菌株为诸氏鲻虾虎鱼的致病菌。
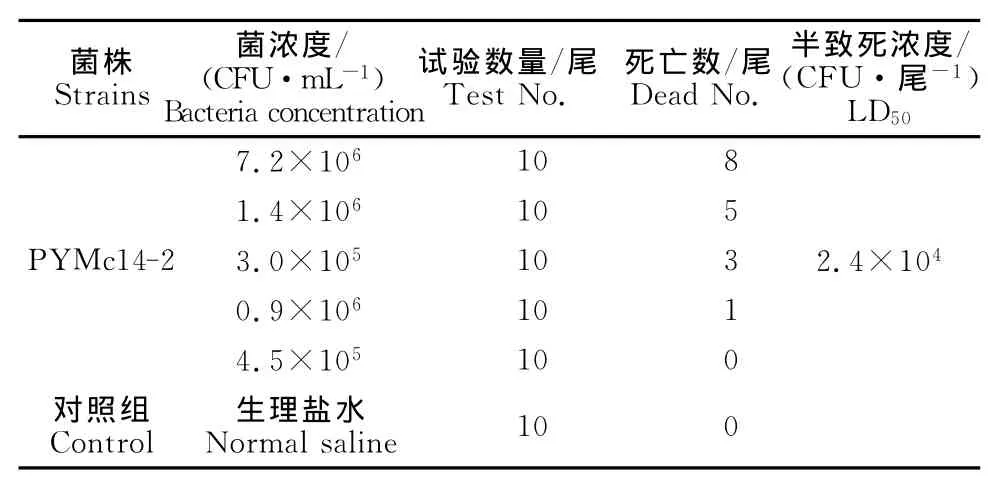
表1 人工感染试验结果Table 1 Results of artificial infection experiment

表2 API-ID32E系统菌株PYMc14-2生化反应结果Table 2 The biochemical reaction results of PYMc14-2 by API-ID32Esystem
2.3 菌株PYMc14-2的HSP60基因序列分析及hemo毒力基因检测
PCR扩增分离菌株PYMc14-2的HSP60基因,获得486bp的片段,毒力基因检测结果显示,菌株PYMc14-2的hemo基因检测结果阳性(图1)。HSP60基因测序结果Blast分析显示,PYMc14-2与GenBank上登录的创伤弧菌(登录号AF230955.1)同源性最高,为94%。分离的菌株HSP60片段与GenBank已登录的序列建立系统发育树,PYMc14-2与创伤弧菌(登录号AF230955.1)聚为一簇(图2)。
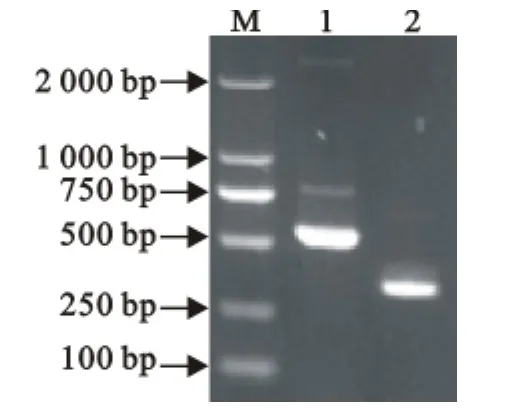
图1 菌株PYMc14-2的HSP60、hemo基因PCR产物电泳Fig.1 Electrophoresis PCR products of HSP60gene,hemo gene of strain PYMc14-2

图2 基于弧菌HSP60基因序列的系统发育树Fig.2 Phylogenetic tree based on HSP60sequences of Vibrio
3 讨论
基于PCR技术的分子生物学分类方法已经成为细菌分类的标准方法之一[6-7]。热激蛋白(heat shock protein)是一类常用于生物进化及分类的大分子物质,广泛存在于细菌及真核生物细胞中[8],由于进化速度比16SrRNA快,HSP60基因广泛应用于亲缘关系较近的细菌的分类鉴定[9]。李宁求等[10]研究表明,HSP60基因比16SrRNA携带更多的多态信息,更适合于海水鱼类致病性弧菌的分类研究。本研究中,菌株PYMc14-2与GenBank上登录的创伤弧菌(登录号AF230955.1)同源性最高,为94%,与其他弧菌同源性小于85%,表明HSP60基因适合于创伤弧菌进行分类。此外,溶血素(hemolysin)是鱼类感染弧菌病的重要毒力决定簇,会引起宿主的溶血性败血症和肠炎等症状[11]。本研究中分离菌株hemo毒力基因检测结果阳性,表明菌株含有溶血素毒力基因,这与患病鱼腹部红肿等症状表现相符。利用毒力基因快速鉴定菌株是否具有致病性是一种行之有效的方法[12],但由于弧菌的感染和致病是由多种致病毒力因子相互协调的结果,因此毒力基因检测方法确定创伤弧菌致病性还需要进一步的研究。
创伤弧菌广泛分布于沿海地区的养殖鱼类和水产品中,可以感染鳗鲡[13]、石斑鱼[14]、黄姑鱼[15]、罗非鱼[16]等多种鱼类,也有发现虾虎鱼科的矛尾腹虾虎鱼感染创伤弧菌的报道[17]。创伤弧菌不仅危害海水养殖业,还能引起人类伤口感染和败血症,严重者可导致死亡,为重要的人鱼共患病病原[18]。本研究从患病的诸氏鲻虾虎鱼肝脏组织分离到1株革兰阴性杆菌PYMc14-2,经回归感染证实其为诸氏鲻虾虎鱼的病原菌,通过细菌生物学特征和生理生化特性分析,初步鉴定为创伤弧菌。采用分子生物学方法对该菌的HSP60基因序列进行了同源性分析和系统发育树的构建,进一步确定菌株PYMc14-2为创伤弧菌,该菌导致诸氏鲻虾虎鱼发生疾病尚属首次报道。创伤弧菌为条件致病菌,本研究中诸氏鲻虾虎鱼为采样暂养过程中患病,推测自然环境中的诸氏鲻虾虎鱼可能携带有创伤弧菌,由于采样过程的损伤和应激导致鱼体抵抗力下降,从而暴发疾病。本实验室在诸氏鲻虾虎鱼养殖过程中极少发生疾病,但随着养殖条件变化和养殖规模的扩大,病原菌的感染和传播应该引起足够的重视。
鱼类实验动物属于较低等的动物,具有方便、易得等多方面的优势,符合国际上实验动物替代理念,近年鱼类实验动物在科研试验上的应用快速增加,但其标准化研究明显落后于啮齿类实验动物。因此,建立鱼类实验动物质量控制标准需求十分迫切。本试验对诸氏鲻虾虎鱼创伤弧菌引起的疾病进行了研究,为我国海水鱼类实验动物诸氏鲻虾虎鱼病原的控制以及标准化研究提供技术基础。
[1]熊 盼,彭喜春,魏 霜,等.溶藻弧菌的毒力相关基因及其对小鼠的致病力[J].微生物学报,2014,54(1):80-88.
[2]李建军,杨笑波,魏社林,等.裸项栉虾虎鱼的全人工繁殖及其胚胎发育[J].中国实验动物学报,2008,16(2):111-116.
[3]李建军,吴美慧,叶惠欣,等.不同发育期诸氏鲻虾虎鱼对钻井液的敏感性比较[J].中国比较医学杂志,2013,23(4):48-51.
[4]李建军,林忠婷,陈小曲,等.四种重金属离子对诸氏鲻虾虎鱼的单一和联合毒性[J].海洋环境科学,2014,33(2):236-241.
[5]余露军,李宁求,刘礼辉,等.日本鳗鲡混合感染迟缓爱德华氏菌与创伤弧菌的分离与鉴定[J].中国人兽共患病学报,2009,25(8):799-803.
[6]兰 云,胡秀彩,沈晓静,等.黄喉拟水龟腐皮病病原菌的分离鉴定及药敏试验[J].动物医学进展,2014,35(9):127-131.
[7]胡秀彩,边延峰,赵腊梅,等.鱼源维氏气单胞菌的分离鉴定[J].动物医学进展,2013,34(12):232-235.
[8]Goh S H,Facklam R R,Chang M.Identification ofEnterococcusspecies and phenotypically similarLactococcusandVagococcusspecies by reverse checkerboard hybridization to chaperonin 60 gene sequences[J].J Clin Microbiol,2000,38(11):3953-3959.
[9]Kowk A Y,Chow A W.Phylogenetic study ofStaphylococcusandMacrococcusspecies based on partial Hsp60gene sequences[J].Int J Syst Evol Microbiol,2003,53(1):87-92.
[10]李宁求,白俊杰,吴淑勤,等.斜带石斑鱼3种致病性弧菌的分子生物学鉴定[J].水产学报,2005,29(3):356-361.
[11]钟英斌,张晓华,陈吉祥,等.哈维氏弧菌溶血素基因vhhA在大肠杆菌中的表达及活性研究[J].中国海洋大学学报,2007,37(1):97-102.
[12]王远微,汤 承,于学辉,等.三重PCR检测鱼类致病性嗜水气单胞菌[J].微生物学报,2008,48(7):947-951.
[13]许斌福,林天龙,董传甫.鳗鲡创伤弧菌的分子鉴定[J].中国人兽共患病学报,2005,21(11):995-980.
[14]刘秀珍,邹晓理,莫小燕,等.海水网箱养殖石斑鱼病原菌研究[J].热带海洋,1994,13(1):81-86.
[15]马爱敏,闫茂仓,常维山,等.黄姑鱼创伤弧菌的分离和鉴定[J].中国人兽共患病学报,2008,24(10):960-964.
[16]黎 炯,叶 星,卢迈新,等.罗非鱼创伤弧菌的分离鉴定和药敏试验[J].江西农业大学学报,2011,33(5):965-970.
[17]张晓君,毕可然,阎斌伦,等.矛尾复虾虎鱼病原哈氏弧菌的鉴定及特异性检测方法的建立[J].水产科学,2011,30(12):759-763.
[18]吴后波,潘金培.弧菌属细菌及其所致海水养殖动物疾病[J].中国水产科学,2001,8(1):89-93.

